암모니아로부터 수소 제조를 위한 다양한 조촉매를 사용한 루테늄 및 코발트계 기반 촉매의 활성에 관한 연구
2024 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
In this study, we aimed to investigate the ammonia decomposition activity of various promoters in ammonia decomposition reactions by using ruthenium and cobalt-based catalysts. The effects of different promoter types and their concentrations were examined, along with experiments at varying reaction temperatures, to understand their influence on the catalytic activity in ammonia decomposition for hydrogen production. It was observed that when lithium was supported as a promoter on ruthenium-based catalysts, the ammonia decomposition efficiency was excellent. Similarly, when lanthanum was used as a promoter on cobalt-based catalysts, high ammonia decomposition efficiency was achieved. Additionally, to determine the optimal promoter content for each catalyst, various concentrations were applied during catalyst preparation, and the optimal promoter loading was identified.
Keywords:
Ammonia, Decomposition, Hydrogen, Ruthenium based, Cobalt based, Promoter키워드:
암모니아, 분해 반응, 수소, 루테늄계, 코발트계, 조촉매1. 서 론
수소는 21세기 들어 에너지 자원 고갈과 환경 오염 문제를 동시에 해결할 수 있는 잠재력을 지닌 청정 에너지원으로 각광받고 있다. 특히 수소는 높은 에너지 효율성을 지니고 있으며 연료전지 기술과 결합될 경우 전기와 열을 생성하면서 물만 배출하여 온실가스 감축에 크게 기여할 수 있다. 수소는 그 자체로 에너지원으로 활용될 수 있을 뿐만 아니라 저장 및 운송 측면에서도 우수한 성능을 보여 에너지 공급망의 안정성을 보장한다. 최근 암모니아 분해 반응을 통한 수소 제조 기술이 주목받고 있으며 이는 고온의 환경에서 암모니아를 수소와 질소로 분해하는 과정에서 높은 효율을 얻을 수 있는 혁신적인 방식이다1-4).
메탄올은 초기부터 수소 저장을 위한 적합한 액체로 여겨졌다. 그 이유는 메탄올이 낮은 발열값(19.9 MJ/kg)과 87 kg/m3 (질량 기준 12.5%)의 수소 부피 함량을 가지고 있기 때문이다. 그러나 메탄올을 이용한 수소 저장 및 생산 시스템 개발은 몇 가지 단점에 의한 제한이 있다. 예를 들어 메탄올은 반응을 위해 물과 함께 사용하여야 하는데 이는 메탄올이 실제로 전달할 수 있는 에너지 밀도를 감소시킨다. 또한 최종 생성물에 포함된 일산화탄소와 이산화탄소 같은 탄소 화합물이 문제가 된다. 그러나 암모니아는 이미 전 세계적으로 널리 사용되는 화학 물질로, 주로 비료 제조 과정에서 중요한 역할을 한다. 전 세계 암모니아 생산량의 90% 이상이 하버-보슈 공정을 통해 이루어지며 이 과정에서 대규모 에너지가 소비된다. 동시에 암모니아 합성에서 발생하는 탄소 배출량은 세계 탄소 배출량의 1.6%를 차지할 정도로 크다. 이러한 문제를 해결하기 위하여 블루 암모니아와 그린 암모니아라는 두 가지 새로운 개념이 도입되었는데 이는 각각 탄소 포집 기술과 물의 전해를 통해 수소를 생성하는 방식을 활용해 생산 과정에서의 탄소 배출을 최소화하려는 시도들이다. 최근 암모니아를 수소로 전환하는 분해 기술은 한 걸음 더 나아가 수소 에너지를 좀 더 효율적이고 친환경적으로 얻을 수 있는 대안으로 떠오르고 있다5,6).
암모니아를 분해하는 과정은 암모니아 합성의 역과정으로 높은 온도에서 수소와 질소로 분해되는 흡열 반응이며 식 (1)과 같이 나타낼 수 있다.
| (1) |
이때 암모니아의 분해 반응은 표준 조건에서 진행되며 반응 온도는 보통 450℃ 이상으로 설정된다. 그러나 최근에는 촉매 기술이 발전하면서 더 낮은 온도에서도 효율적으로 암모니아를 수소로 분해할 수 있는 방법이 개발되고 있다. 특히 니켈 및 알루미늄 산화물 촉매를 사용하는 기술이 고온의 암모니아 분해에서 주요하게 사용되며 최근에는 이러한 촉매를 활용하여 450℃ 이하에서도 높은 암모니아 전환율을 달성하는 데 성공하였다. 이 기술은 청정 수소를 대량으로 생산할 수 있는 가능성을 열어주었고 에너지 전환에서 핵심적인 역할을 할 수 있다7,8).
암모니아 분해를 통한 수소 생산 방식은 단순히 수소를 생성하는 것에 그치지 않고 수소를 저장하고 운송하는 문제에서도 해결책을 제시한다. 암모니아는 액체 상태로 저장이 가능하기 때문에 기존의 수소 저장 및 운송 방식에 비해 더 경제적이고 효율적인 장점을 지니고 있다. 그렇기 때문에 암모니아는 수소 경제의 중요한 매개체로 인식되고 있으며 암모니아 분해 반응을 통한 수소 생산이 앞으로 에너지 시스템의 변화에 중요한 기여를 할 것으로 기대된다9,10).
본 연구에서는 암모니아 분해 반응을 이용하여 수소를 제조함에 있어 루테늄 및 코발트계 기반 촉매에 다양한 조촉매 사용 및 함량을 조절하여 다양한 반응 온도 변화 실험을 통하여 암모니아 분해 반응에서의 조촉매의 암모니아 분해 활성 특성을 파악하고자 하였다. 실험에는 쿼츠 고정층 반응기를 사용하였으며 암모니아 분해 반응의 온도를 고려하여 400-700℃의 온도 범위에서 반응을 수행하였다.
2. 실 험
2.1 촉매 제조
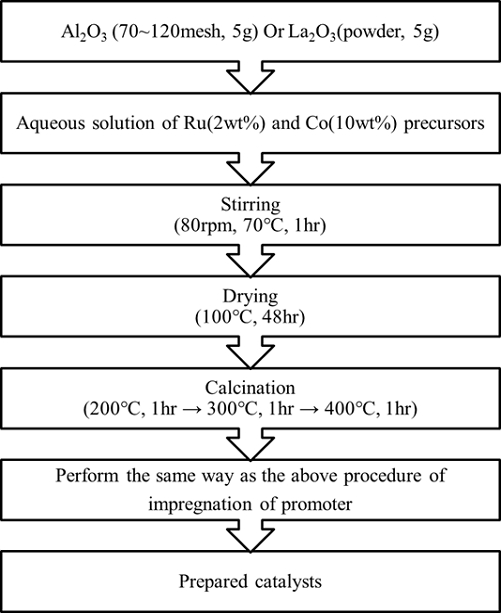
본 연구에서는 Al2O3와 La2O3를 지지체로 사용하였고 대표적인 전이금속계인 코발트 및 귀금속계 루테늄을 주 활성 금속으로 하여 촉매를 제조하였다. 그리고 다양한 조촉매, 특히 리튬과 란타늄의 함량을 변경하며 사용하여 암모니아 분해 반응에 미치는 촉매 활성 영향을 확인하였다. 촉매는 함침법을 사용하여 Fig. 1과 같은 방법으로 제조되었으며 귀금속계인 루테늄의 함량은 2 wt%로, 전이금속계인 코발트의 함량은 10 wt%로 설정하였다. 지지체는 함침 전에 수분 제거를 위하여 전처리를 하였으며 정량된 전구체를 일정량의 증류수에 녹인 용액을 지지체에 함침과 건조를 반복하여 수행하여 촉매를 제조하였다. 용액을 다 지지체에 완전히 함침시킨 후 일정 시간 건조 후에 소성로에서 200℃, 300℃, 400℃에서 각각 1시간 동안 유지하면서 총 3시간 동안 소성하였으며 조촉매 또한 동일한 방법을 사용하여 제조하였다.
2.2 촉매 특성 분석
지지체와 제조된 촉매의 입자 형태 및 크기 측정을 위해 X선 회절 분석기(X-ray diffraction, XRD)를 사용하여 분석을 진행하였다. 분석은 Cu-Kα (λ=1.5404 Å) 회절기를 사용하여 40 kV 전압과 30 mA 전류 조건에서 수행되었다. 또한 촉매 표면의 형상을 분석하기 위하여 주사전자현미경(scanning electron microscope, SEM) 장비를 사용하였으며 JSM-7610F Plus (JEOL, Akishima, Japan) 분석기를 통해 표면 상태를 확인하고 에너지 분산형 X선 분광기(energy dispersive X-ray spectroscopy, EDS) 결과로 촉매 성분을 파악하였다.
2.3 촉매 반응성 테스트
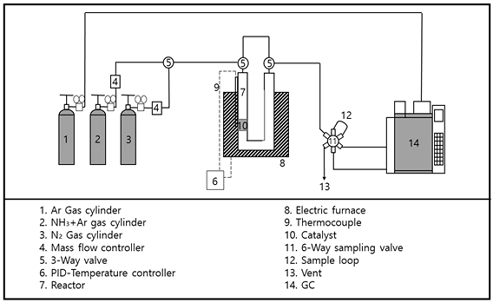
촉매의 반응성을 평가하기 위하여 Fig. 2에 나타난 것처럼 반응 시스템을 구성하였다. 촉매는 질소 분위기에서 400℃, 1시간 동안 전처리를 실시하였으며 실험은 400-700℃의 반응 온도와 상압 조건에서 진행되었고 암모니아와 아르곤 가스를 1:1의 몰비로 주입하면서 반응을 수행하였다. 생성물의 분석을 위하여 Carboxen (Supelco, Bellefonte, PA, USA) 컬럼과 열전도도 검출기(thermal conductivity detector, TCD)가 장착된 가스 크로마토그래피(Shimadzu, Kyoto, Japan)를 사용하여 생성물을 분리하고 확인하였다.
2.4 공정 모사
암모니아 분해 반응의 온도와 압력에 따른 평형 전환율을 확인하기 위하여 공정 모사 프로그램인 Aspen Plus (AspenTech, Bedford, MA, USA)를 사용하였다. 반응기는 Gibbs 모델을 적용하였으며 반응 온도와 압력 변화에 따른 암모니아 전환율을 분석하였다.
3. 결과 및 고찰
3.1 암모니아 분해 반응의 열역학적 특성 및 메커니즘
암모니아 분해 반응은 식 (1)에서 볼 수 있듯이 흡열 반응으로 온도가 상승할수록 암모니아의 전환율이 증가한다. 또한 암모니아 1몰이 수소 1.5몰과 질소 0.5몰로 변환되며 몰 수가 증가하는 반응이므로 르 샤틀리에 원리에 따르면 반응 압력이 낮을수록 암모니아 전환율이 더 높아진다. Fig. 3에 나타난 Aspen Plus 시뮬레이션 결과에서도 확인할 수 있듯이 온도가 높아질수록 암모니아 전환율이 상승하고 동일한 온도 조건에서는 압력이 높아질수록 전환율은 감소하는 경향을 보인다11). 특히 1 bar의 반응 압력에서는 350℃ 이상에서 암모니아 전환율이 99%를 넘고 압력이 증가함에 따라 전환율은 감소한다. 51 bar에서는 반응 온도가 700℃에 이르러도 암모니아 전환율이 98.8%에 머무는 것으로 나타났다.
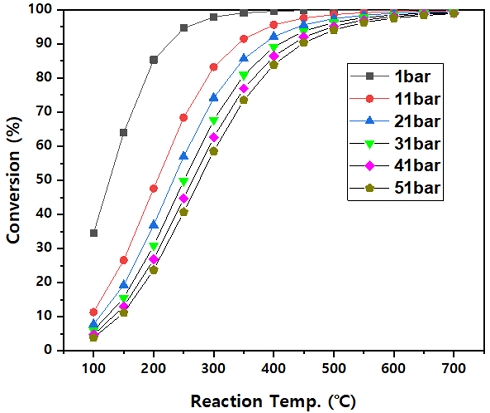
Equilibrium conversion results from the simulation were obtained by varying the reaction pressures and temperatures11)
암모니아의 해리 반응의 메커니즘은 몇 가지 단계로 나누어진다. 먼저 암모니아(NH₃)가 촉매 표면에 흡착되어 표면 NH₃를 생성한다. 이 흡착된 NH₃는 단계적으로 탈수소화 과정을 거쳐 표면에 N과 H 원자들이 형성되고 N과 H는 각각 재결합 및 탈착 과정을 통해 N₂와 H₂ 분자로 변환되어 가스상으로 방출된다12).
이 과정의 반응 단계를 정리하면 다음과 같다.
- 1. NH₃ (g) + ∗ ⇋ NH₃ (ads) (암모니아가 표면에 흡착)
- 2. NH₃ (ads) ⇋ NH₂ (ads) + H (ads) (암모니아의 첫 번째 탈수소화)
- 3. NH₂ (ads) ⇋ NH (ads) + H (ads) (두 번째 탈수소화)
- 4. NH (ads) ⇋ N (ads) + H (ads) (세 번째 탈수소화)
- 5. 2N (ads) ⇋ N₂ (g) + 2∗ (질소 분자의 재결합)
- 6. 2H (ads) ⇋ H₂ (g) + 2∗ (수소 분자의 재결합)
이 반응에서 촉매의 역할은 암모니아 분자의 결합을 약화시키고 탈수소화를 촉진하는 것이다. 암모니아 해리 반응은 높은 에너지를 요구하는데 촉매가 없을 경우 반응 속도가 매우 느리고 높은 온도를 필요로 한다. 따라서 촉매를 통한 반응의 활성화 에너지 감소와 효율적인 수소 생산이 필요하다.
3.2 다양한 암모니아 분해반응 촉매
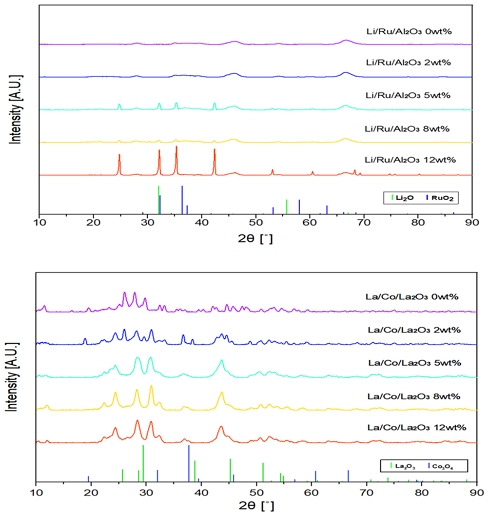
XRD와 SEM-EDS 분석을 통하여 촉매가 제대로 제조되었음을 확인하였다. Fig. 4는 제조된 촉매의 XRD 패턴을, Fig. 5는 SEM 이미지와 SEM-EDS를 통해 촉매에 증진제와 활성금속이 잘 담지되어 있음을 나타내고 있다. 루테늄의 경우 함침량이 매우 작아서 XRD로는 검출이 제대로 되지 않았다. 하지만 리튬의 함량이 증가함에 따라서 리튬의 peak가 커지는 것을 확인하였다. 또한 코발트 란타늄 촉매에서는 2 wt% 란타늄이 함침되었을 경우 코발트와 란타늄이 각각의 산화물 형태로 존재하고 있음을 확인하였다. 하지만 란타늄의 함침량이 그 이상으로 증가할 경우 코발트 산화물의 peak가 작아지는 것으로 보아 란타늄의 함침량 증가로 인하여 발생하는 것으로 추측된다.
암모니아 분해를 통한 수소 생산에 사용되는 다양한 촉매에 대한 최근 연구들은 주로 활성금속, 지지체 그리고 조촉매의 성능 향상에 초점을 맞추고 있다. 또한 다양한 지지체와 조촉매가 촉매 성능에 큰 영향을 미치며 이는 특히 경제적이고 효율적인 비귀금속 촉매 개발에서 중요한 역할을 한다.
루테늄(Ru) 기반 촉매가 암모니아 분해 반응에서 높은 활성을 나타내는 이유는 몇 가지 중요한 특성에 기인한다. 첫째, 루테늄은 암모니아 분해 반응에서 N-H 결합을 약화시켜 쉽게 끊어질 수 있게 하고 흡착되어 있는 N-N 원자의 재결합 및 탈착을 용이하게 하여 높은 전환율을 보여준다. 특히 루테늄 표면에 존재하는 활성 사이트는 암모니아 분자의 분해를 촉진하는 데 매우 효과적이다. 또한 루테늄을 기반으로 한 촉매에 칼륨(K) 등의 증진제가 첨가되면 루테늄 입자의 크기가 줄어들고 금속 분산이 증가하여 더 많은 활성 사이트가 노출된다. 이는 반응의 활성화를 더 효율적으로 이루게 하여 반응 속도와 전환율을 높이는 결과를 가져온다. 이와 관련된 연구는 Ru-K/CaO 촉매가 다른 루테늄 기반 촉매보다 더 높은 성능을 발휘하는 것을 보여주고 있으며 이는 전자적 상호작용과 입자 크기 감소로 인한 활성 에너지 감소에 기인한다고 알려져 있다13-15).
하지만 본 연구에서는 루테늄을 기반으로 한 촉매에서 Al2O3 지지체를 사용하였기 때문에 Ru-K/CaO 촉매에서 K 증진제보다 Li이 더 높은 활성을 보이는 것으로 확인되었다. 그리고 550℃ 이상에서는 온도로 인하여 암모니아 전환율이 비슷하지만 그 이하의 온도에서는 Li>Ba>Na>K≈Ca≈Ce>La과 같은 순서로 촉매의 활성이 높은 것으로 Fig. 6과 같이 관찰되었다.
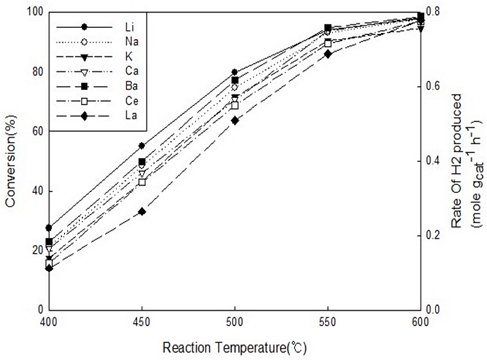
Catalytic activity results of ammonia decomposition reaction with different temperatures using various promoted (Li, Na, K, Ca, Ba, Ce, La) Ru-base catalysts
Fig. 7은 Li의 함침량을 달리하여 루테늄을 활성금속으로 사용하여 암모니아 분해 반응 온도가 변화함에 따라서 촉매의 활성이 어떻게 달라지는지를 나타낸 그림이다. Li의 함침량이 2 wt% 일 때 촉매의 활성이 가장 높았으며 함침량이 2 wt% 이상으로 증가함에 따라서 활성이 감소하는 현상을 보여주고 있다. 특히나 12 wt% 이상에서는 온도를 500℃에서 600℃까지 높였음에도 불구하고 촉매의 활성이 증가하지 않았다. 촉매의 활성이 증진제가 증가함에 따라 감소한 이유는 증진제가 촉매 표면에서 너무 많이 자리 잡으면 원래 반응을 촉진하는 활성 사이트를 차폐하여 반응이 일어날 공간을 감소시킬 수 있으며 증진제의 과도한 첨가는 촉매 표면의 비표면적을 감소시키기 때문으로 추측된다.
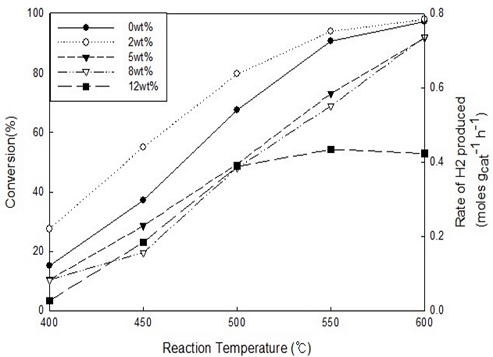
Catalytic activity results of ammonia decomposition reaction with different temperatures using various Li loading on Ru/Al2O3 catalysts
니켈(Ni)과 코발트(Co)는 루테늄(Ru)과 같은 귀금속에 비해 저렴하지만 높은 활성을 보이는 촉매로 주목받고 있다. 니켈과 코발트 기반 촉매는 특히 페로브스카이트형 지지체(LaNiO3, LaCoO3)를 사용하여 암모니아 분해 반응에서 높은 전환율을 보였으며 이는 금속 크기를 작게 유지하고 분산도를 높이는 결과를 가져왔다. 산화물 기반 지지체와 함께 사용할 경우 촉매의 열적 안정성과 활성 사이트의 노출이 향상된다고 보고되고 있다12).
Fig. 8은 La2O3 지지체에 코발트를 활성금속으로 사용하여 다양한 증진제를 사용하였을 때 암모니아 분해 반응 온도가 변화함에 따라서 촉매의 활성이 어떻게 달라지는지를 나타낸 그림이다. 550℃ 이하에서는 La>Na>Ce>Ca>Ba>K>Li과 같은 순서로 촉매의 활성이 높은 것으로 확인되었으나 650℃에서는 La>Ca>Ce>Ba≈Li>Na≈K 순서로 촉매의 활성이 높은 것으로 관찰되었다.
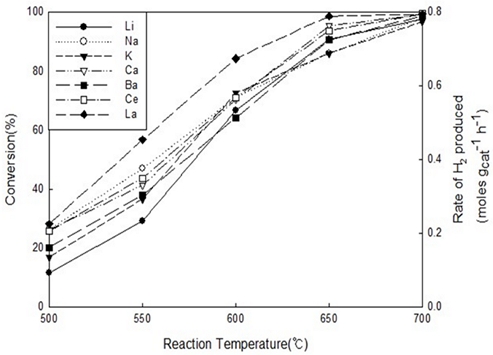
Catalytic activity results of ammonia decomposition reaction with different temperatures using various promoted (Li, Na, K, Ca, Ba, Ce, La) Co-base catalysts
Fig. 9는 La의 함침량을 달리하여 코발트를 활성금속으로 사용하여 암모니아 분해 반응 온도가 변화함에 따라서 촉매의 활성이 어떻게 달라지는지를 나타낸 그림이다. La의 함침량이 2 wt%일 때 촉매의 활성이 가장 높았으며 함침량이 2 wt% 이상으로 증가함에 따라서 활성이 증가하거나 감소하는 뚜렷한 양상을 나타내지는 않았다. 이는 La2O3 지지체의 매우 작은 비표면적 및 기공의 크기 때문에 함침하는 과정에서 La의 함량이 너무 많으면 활성점으로 작용하는 Co를 가리기 때문에 과량의 La 담지는 부정적인 영향을 준 것으로 추측된다. 또한 문헌에 따르면 적정량의 란타늄을 함침하였을 경우 란타늄이 전자를 공여하는 능력이 좋아서 흡착된 N 원자의 결합에너지를 감소시키고 이로 인하여 질소 탈착을 가속화하여 촉매 활성 증진에 영향을 미치며 이 때문에 높은 활성을 보인 것으로 예측된다16).
4. 결 론
다양한 증진제 및 루테늄 및 코발트를 활성금속으로 하여 각각의 지지체에 함침법을 통해 촉매가 성공적으로 제조되었음을 XRD를 통하여 확인하였다.
Ru/Al2O3 촉매에서는 Li>Ba>Na>K≈Ca≈Ce>La와 같은 순서로 촉매의 활성이 높은 것으로 확인되었다. 특히나 Li-Ru/Al2O3 촉매에서 Li의 함량이 2 wt%일 때 가장 높은 암모니아 전환율을 보여주었다.
Co/La2O3 촉매에서는 Ru/Al2O3 촉매와 비교하여 반응 온도가 약 100℃이상 높은 온도에서 동일한 수준의 암모니아 전환율을 보여주었다. 온도 구간별로 증진제에 따라서 촉매의 활성 순서가 달라지나 La이 가장 높은 활성을 보였으며 증진제 함량이 2 wt%일 때 가장 높은 활성을 보였다.
촉매의 활성은 첨가되는 증진제의 종류에 따라 달라지며 특정 금속이 첨가되면 촉매 성능에 긍정적인 영향을 미칠 수 있다. 또한 반응 온도에 따라 촉매가 최적의 성능을 발휘하는 온도 범위가 있으며 이를 통해 특정 활성금속이 어느 환경에서 가장 효과적으로 작용하는지를 확인하였다.
Acknowledgments
본 과제(결과물)는 2024년도 교육부의 재원으로 한국연구재단의 지원을 받아 수행된 지자체-대학 협력 기반 지역 혁신 사업의 결과입니다(No. 2021RIS-002).
References
-
W. A. Braff, J. M. Mueller, and J. E. Trancik, “Value of storage technologies for wind and solar energy”, Nature Climate Change, Vol. 6, No. 10, 2016, pp. 964-969.
[https://doi.org/10.1038/nclimate3045]

-
J. Markard, “The next phase of the energy transition and its implications for research and policy”, Nature Energy, Vol. 3 No. 8, 2018, pp. 628-633.
[https://doi.org/10.1038/s41560-018-0171-7]

-
R. York and S. E. Bell, “Energy transitions or additions?: why a transition from fossil fuels requires more than the growth of renewable energy”, Energy Research & Social Science, Vol. 51, 2019, pp. 40-43.
[https://doi.org/10.1016/j.erss.2019.01.008]

- International Energy Agency (IEA), “Renewables 2020: analysis and forecast to 2025”, IEA, 2020. Retrieved from https://www.iea.org/reports/renewables-2020, .
-
L. Capobianco, Z. Del Prete, P. Schiavetti, and V. Violante, “Theoretical analysis of a pure hydrogen production separation plant for fuel cells dynamical applications”, International Journal of Hydrogen Energy, Vol. 31, No. 8, 2006, pp. 1079-1090.
[https://doi.org/10.1016/j.ijhydene.2006.02.013]

-
R. Metkemeijer and P. Achard, “Comparison of ammonia and methanol applied indirectly in a hydrogen fuel cell”, International Journal of Hydrogen Energy, Vol. 19, No. 6, 1994, pp. 535-542.
[https://doi.org/10.1016/0360-3199(94)90009-4]

-
D. K. Lim, A. B. Plymill, H. Paik, X. Qian, S. Zecevic, C. R. I. Chisholm, and S. M. Haile. “Solid acid electrochemical cell for the production of hydrogen from ammonia”, Joule, Vol. 4, No. 11, 2020, pp. 2338-2347.
[https://doi.org/10.1016/j.joule.2020.10.006]

-
S. Chiuta, R. C. Everson, H. W. J. P. Neomagus, P. van der Gryp, and D. G. Bessarabov, “Reactor technology options for distributed hydrogen generation via ammonia decomposition: a review”, International Journal of Hydrogen Energy, Vol. 38, No. 35, 2013, pp. 14968-14991.
[https://doi.org/10.1016/j.ijhydene.2013.09.067]

-
A. Di Carlo, L. Vecchione, and Z. Del Prete. “Ammonia decomposition over commercial Ru/Al2O3 catalyst: an experimental evaluation at different operative pressures and temperatures”, International Journal of Hydrogen Energy, Vol. 39, No. 2, 2014, pp. 808–814.
[https://doi.org/10.1016/j.ijhydene.2013.10.110]

-
K. Trangwachirachai, K. Rouwenhorst, L. Lefferts, and J. A. F. Albanese, “Recent progress on ammonia cracking technologies for scalable hydrogen production”, Current Opinion in Green and Sustainable Chemistry, Vol. 49, 2024, pp. 100945.
[https://doi.org/10.1016/j.cogsc.2024.100945]

-
J. H. Lee, K. H. Shin, J. Kang, H. Shin, S. Park, Y. Choi, W. Song, and H. G. Ahn, “A study on activity testing of various catalysts for hydrogen production from ammonia”, Journal of Hydrogen and New Energy, Vol. 34, No. 6, 2023, pp. 587-593.
[https://doi.org/10.7316/JHNE.2023.34.6.587]

-
X. Huang, K. Lei, Y. Mi, W. Fang, and X. Li, “Recent progress on hydrogen production from ammonia decomposition: technical roadmap and catalytic mechanism”, Molecules, Vol. 28, No. 13, 2023, pp. 5245.
[https://doi.org/10.3390/molecules28135245]

-
S. Sayas, N. Morlanés, S. P. Katikaneni, A. Harale, B. Solami, and J. Gascon, “High pressure ammonia decomposition on Ru–K/CaO catalysts”, Catalysis Science & Technology, Vol. 10, 2020, pp. 5027-5035.
[https://doi.org/10.1039/D0CY00686F]

-
S. Kang, J. Cha, Y. S. Jo, Y. J. Lee, H. Sohn, Y. Kim, C. K. Song, Y. Kim, D. H. Lim, J. Park, and C. W. Yoon, “Heteroepitaxial growth of B5-site-rich Ru nanoparticles guided by hexagonal boron nitride for low-temperature ammonia dehydrogenation” Advanced Materials, Vol. 35, No. 4, 2022, pp. 2203364.
[https://doi.org/10.1002/adma.202203364]

-
T. E. Bell and L. Torrente-Murciano, “H2 production via ammonia decomposition using non-noble metal catalysts: a review”, Topics in Catalysis, Vol. 59, 2016, pp. 1438–1457.
[https://doi.org/10.1007/s11244-016-0653-4]

-
T. Weissenberger, R. Zapf, H. Pennemann, and G. Kolb, “Catalyst coatings for ammonia decomposition in microchannels at high temperature and elevated pressure for use in decentralized and mobile hydrogen generation”, Catalysts, Vol. 14, No. 2, 2024, pp. 104.
[https://doi.org/10.3390/catal14020104]