백금 기반 촉매의 구조적 특성에 따른 저농도 수소 제거 장치 연구
2025 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
This study focuse on the development of a low-concentration hydrogen removal filter to enhance hydrogen explosion safety. To overcome the limitations of passive autocatalytic recombiner, which are designed for high-concentration hydrogen removal, Pt based powder type catalysts were tested. Pt nano based catalyst, dominated by Pt0-terrace structure, demonstrated the ability to remove 0.05% hydrogen and showed durability against nitrogen oxides. Pt Nano/TiO2 coated honeycomb type catalyst was tested in a batch reactor, reducing hydrogen 0.001% in a short time. Therefore, this approach is considered more advantageous for ensuring hydrogen explosion safety compared to passive autocatalytic recombiner.
Keywords:
H2 removal, Pt based catalyst, Pt nano cluster, Pt structure, H2 safety키워드:
수소 제거, 백금 기반 촉매, 나노 백금, 백금 구조, 수소 안전1. 서 론
수소는 무색, 무취의 타 연료 대비 높은 발열량을 지닌 청정한 에너지원이지만 수소를 생산, 저장, 운송, 응용하기 위해서는 사용 공정에서의 폭발 안정성을 확보하여야 한다. 수소는 상온, 상압 조건에서 산소와 점화원이 존재할 때 4% 조건에서 폭발 가능성이 존재하는 물질이다. 만약 온도와 압력이 높아진다면 더 낮은 농도에서 수소 폭발 가능성이 존재하게 된다. 따라서 수소를 사용하는 모든 공정에는 폭발에 대한 안전성 확보가 필요하다1,2).
현재 원자력발전소, 잠수함 등에서는 수소 누출에 의한 폭발 방지를 위하여 열 재결합기(thermal recombiner), 수소 점화기(igniter), 피동형 수소 재결합기(passive autocatalytic recombiner, PAR) 등을 사용하고 있다. 백금, 팔라듐 등의 촉매가 사용되는 PAR은 국내뿐만 아니라 해외에서도 주로 사용되는 장치로 상온에서 자발적으로 수소와 산소를 재결합시키고 이때 발생하는 열로 자연 대류를 일으킴으로써 별도의 전원 없이 운전되는 설비이다3). 하지만 PAR은 1% 이상의 고농도 수소가 존재해야 수소 반응 촉매층과 대기층의 온도 편차가 발생하기 때문에 밀폐 공간 내 미량의 저농도 수소가 연속적으로 누출되는 초기에는 수소 제거가 불가능하다는 단점을 가지고 있다.
따라서 본 연구에서는 촉매가 적용된 PAR과 유사하게 백금계 촉매를 사용하되 촉매의 구조적 제어를 통해 저농도 수소 산화 성능을 확인하고 이를 수소 제거 장치에 적용하여 성능을 평가하였다.
2. 실 험
2.1 촉매 제조
본 연구에서 사용된 촉매는 습윤 함침법(wet impregnation method)을 사용하였으며 TiO2 지지체에 Pt를 활성금속으로 담지하여 제조하였다. 상용 TiO2 (G-5, Millennium Co., Silver Spring, MD, USA) 지지체의 무게 비로 활성금속 Pt의 담지량을 2.0 wt.%로 계산하였다. 이때 사용된 Pt는 수산화백금(Pt[OH]2, SNS Corporation, Hwaseong, Korea)과 나노 백금(Pt nano cluster, H-CHEM Co., Gangneung, Korea)을 각각 증류수에 완전히 용해하여 정량된 지지체와 혼합하여 촉매 슬러리(slurry)를 제조한다. 슬러리 상태의 혼합 용액을 1시간 교반 후 65℃, 65 mmHg에서 진공 회전 증발기(Eyela N-N series; Eyela, Tokyo, Japan)를 이용하여 수분을 증발시켰다. 이후 미세기공에 포함된 수분을 완전히 제거하기 위하여 103℃의 건조기에서 24시간 건조시켰다. 건조된 촉매는 10℃/min의 승온 속도로 400℃까지 상승시킨 후 4시간 동안 공기 분위기에서 소성 처리하였다. 추가적으로 수산화백금으로 만든 촉매는 10℃/min의 승온 속도로 600℃까지 상승시킨 후 1시간 동안 수소 분위기에서 환원 처리하였다. 최종적으로 제조된 분말형 촉매는 각각 Pt(OH)2/TiO2, Pt Nano/TiO2로 명명하였다.
다음으로 수소 제거 장치 적용 촉매는 300 cpsi의 honeycomb에 360 rpm에 1시간 동안 볼밀한 분말형 촉매의 액상을 50 g/L 코팅한 후 10℃/min의 승온 속도로 400℃까지 상승시킨 후 4시간 동안 공기 분위기에서 소성 처리하였다.
2.2 장치 및 실험 방법
다음으로 honeycomb 형태의 수소 제거 장치 실험은 가로, 세로, 높이가 각각 2 m인 정사각형의 회분식 반응기에서 진행하였다. 실험은 반응기 내부에 수소를 충진한 후 진공 펌프를 이용하여 수소 계측기로 가스를 주입하였으며 계측기 후단으로 나오는 가스를 다시 회분식 반응기에 주입하면서 수소 농도 변화를 측정하였다. 분말형 촉매와 honeycomb 형태의 수소 제거 장치에 대한 실험 조건은 Table 1에 나타내었다. 분말 및 honeycomb 촉매는 모두 상온에서 진행하였다. 분발형 촉매를 이용한 연속식 실험은 공간속도 60,000 h-1 조건에서 0.05%의 저농도부터 1.50%의 고농도까지 수소 농도를 달리하여 실험하였으며 상대습도 55%의 공기 분위기에서 진행하였다. Honeycomb 촉매를 이용한 회분식 실험은 공간속도 30,000 h-1 조건에서 수소 농도를 0.20%로 고정하고 분말형 촉매와 동일한 대기 조건에서 실험을 진행하였다. 분말 및 honeycomb 촉매를 이용한 실험에서 수소의 전환율은 다음 식과 같이 계산하였다.
| (1) |
본 연구의 분말형 촉매의 수소 산화 반응을 위한 실험 장치는 연속식 반응기를 사용하였다. 반응기에 공급되는 가스는 N2, O2, H2의 가스로 mass flow controller (1179C; MKS Instruments, Andover, MA, USA)를 사용하여 유량을 조절하였다. 또한 수분 공급은 N2가 bubbler를 통과함으로써 수분을 함유하고 반응기로 주입되도록 하였으며 공급되는 양을 일정하게 하기 위하여 이중 jacket 형태의 bubbler 외부에 circulator를 이용하여 40℃의 물을 순환시켰다. 반응물(H2)이 제거되는 농도를 측정하기 위하여 cold trap을 거쳐 수분을 완전히 제거 후 고농도용 비분산 적외선 가스 분석기(ZKJ-2; Fuji Electronic Co., Tokyo, Japan) 와 저농도용 수소 측정기(FTC-300; Messkonzept GmbH, Frankfurt, Germany)로 측정하였다.
3. 결과 및 고찰
3.1 백금계 분말형 촉매의 수소 산화 성능
본 절에서는 Pt(OH)2/TiO2와 Pt Nano/TiO2 분말형 촉매를 이용하여 연속 흐름형 반응기에서 수소 농도 별 성능 실험을 진행하였으며 이를 Fig. 1에 나타내었다. 실험은 수소 반응에 따른 발열 반응 최소화를 위해 0.05%의 저농도 수소부터 점차 농도를 높이면서 1.50%의 고농도 수소까지 진행하였다. 먼저 Pt(OH)2/TiO2 촉매는 0.05%부터 1.00%의 수소 농도까지 수소 산화 반응이 일어나지 않았으며 1.50%의 고농도 수소에 도달하였을 때 100%의 수소 산화 반응이 진행되었다. 반면 구조 제어된 Pt Nano를 사용한 촉매에서는 수소 0.05%에서 86%, 0.10%에서 94%의 산화 반응이 진행되었으며 0.15% 이상의 수소에서는 100%의 산화 반응이 확인되었다.
서로 다른 구조를 지닌 백금계 촉매의 수소 산화 성능 비교를 통해 Pt Nano/TiO2 촉매만이 0.05%라는 저농도에서 수소 산화 반응이 진행됨을 확인하였다. 문헌들에 따르면 백금계 촉매는 상온에서 강력한 산화력을 나타내기 위하여 금속 지지체와 활성금속의 강한 상호작용, 결합인 strong metal support interaction (SMSI) effect가 필요하다고 언급되고 있다4). 또한 SMSI effect를 확인하기 위한 방법으로 촉매의 입자 크기, 금속의 valance state 상태 등을 분석하였다. 실제로 Pt/TiO2 촉매를 환원함으로써 백금의 입자 크기가 작게 형성되고 metallic Pt의 중심 peak가 70.9 eV에서 더 낮은 쪽으로 이동함으로써 SMSI effect가 강하게 발생하고 이에 따라 성능이 증진되는 것이 확인되었다고 보고되었다5-8). 따라서 본 절에서는 서로 다른 Pt/TiO2 촉매의 구조적 특성과 수소 산화 성능 간의 상관관계를 확인하는 분석을 진행하였다.
먼저 촉매의 입자 크기 및 비표면적 분석을 위하여 transmission electron microscope (TEM) 및 Brunauer Emmett Teller (BET) 분석을 진행하였으며 그 결과를 Fig. 2와 Table 2에 나타내었다.
두 촉매의 입자 크기를 비교하였을 때 저농도 수소 산화 성능이 우수한 Pt Nano/TiO2 촉매는 Pt(OH)2/TiO2 촉매 대비 약 2배인 4.85 nm로 평균 크기가 크게 형성되었으며 비표면적은 약 3배인 184.19 m2/g으로 확인되었다. 이는 문헌들에서 언급하는 SMSI effect에 의한 입자 크기 감소와는 다른 결과를 보였다9,10).
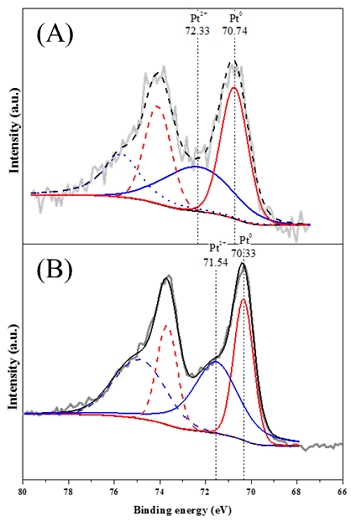
다음으로 촉매 내 백금의 valance state 비교를 위하여 X-ray photoelectron spectroscopy (XPS) 분석을 수행하였으며 Fig. 3과 Table 3에 나타내었다.
두 촉매의 metallic Pt (Pt0)를 비교하였을 때 Pt Nano/TiO2 촉매는 제조 중 환원 공정이 배제되어도 초기 백금 전구체를 nano cluster 형태를 사용함에 따라 42.92%의 metallic Pt가 확인되었으며 Pt(OH)2/TiO2 촉매보다 약 10% 낮은 비율을 나타내었다. 또한 Pt Nano/TiO2 촉매의 metallic Pt binding energy 중심 peak는 70.9 eV보다 낮은 70.33 eV로 Pt(OH)2/TiO2 촉매보다 더 이동됨을 확인하였다11,12).
마지막으로 metallic Pt의 결정면 분석을 위하여 CO 흡착에 따른 Fourier transform infrared spectrometer (FT-IR) 분석을 수행하였으며 이를 Fig. 4에 나타내었다.
XPS 분석 결과에서도 확인할 수 있듯이 두 촉매는 모두 metallic Pt에 의한 Pt0의 흡착 peak가 확인되었다. Metallic Pt의 흡착종은 Pt0-kink (2,050 cm-1) peak, Pt0-step (2,075 cm-1) peak, Pt0-terrace (2,091 cm-1) peak에서 확인되었다13,14). 서로 다른 백금을 사용한 두 촉매의 흡착 peak를 비교하면 Pt Nano/TiO2 촉매는 Pt0-terrace peak가 지배적으로 형성되고 나머지 metallic Pt 흡착 peak는 낮게 형성됨을 확인하였다. 반면, Pt(OH)2/TiO2 촉매는 Pt0-step peak가 지배적으로 형성되었으며 Pt0-kink가 두 번째로 크게 나타나고 Pt0-terrace peak는 매우 작은 것을 확인하였다. 또한 Pt(OH)2/TiO2 촉매는 2,120 cm-1에서 Pt2+의 흡착 peak도 크게 형성됨을 확인하였다.
앞서 수행한 TEM, BET, XPS, FT-IR 결과를 토대로 촉매의 저농도 수소 산화 반응성과 상관관계를 확인하면 Pt(OH)2/TiO2, Pt Nano/TiO2 촉매는 입자 크기, Pt0/(Pt0+Pt2+) 비율, metallic Pt binding energy shift 정도의 차이가 존재하였지만 두 촉매 모두 문헌들에서 언급하고 있는 SMSI effect 현상이 확인되었다. 반면 저농도 수소 산화 반응이 우수한 Pt Nano/TiO2 촉매는 상온에서 사용하는 일반적인 Pt(OH)2/TiO2 촉매들과는 달리 추가 환원 공정 없이 metallic Pt를 만들고 이 중 Pt0-terrace 구조를 지배적으로 형성할 수 있으면서 400℃라는 고온에서 소성하여도 비표면적이 크게 형성됨에 따라 Pt가 고분산되어 저농도 수소 산화 반응이 우수하였을 것으로 판단된다.
3.2 백금계 분말형 촉매의 수소/질소산화물 내구성
문헌들에 따르면 Pt/TiO2 촉매는 200℃ 이하의 저온 산화 반응 중 NOx가 동시 주입되면 백금의 활성점에서 경쟁 흡착에 따라 산소 이동성을 억제하여 촉매 산화 성능이 감소한다고 보고되고 있다. 또한 NOx 농도가 높을수록 성능 감소 폭은 더 크게 발생한다15-17).
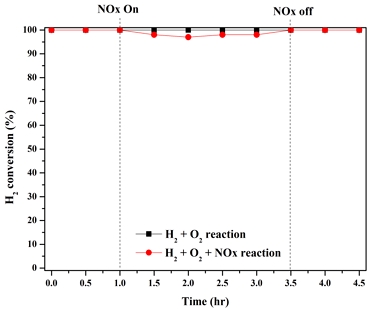
따라서 3.1절에서 진행한 촉매 실험 결과를 토대로 저농도 수소 산화 성능이 우수한 Pt Nano/TiO2 촉매를 honeycomb 형태의 수소 제거 장치 적용 전 수소 0.20%와 질소산화물(NOx) 5 ppm 동시 반응에 따른 상온 수소 산화 성능 변화를 확인하였으며 이를 Fig. 5에 나타내었다.
먼저 0.20% 수소와 21% 산소가 포함된 가스를 촉매에 연속적으로 주입하였을 때 수소 산화 성능은 100%를 유지함을 확인하였다. 이후 동일 촉매를 이용하여 동일 가스 조건에 5 ppm의 질소산화물를 동시 주입하는 ON/OFF 실험을 진행하였다. 질소산화물을 주입하였을 때 약 2% 정도의 성능 저하가 확인되었지만 변화가 미미하였다. 이후 질소산화물을 차단하면 초기 성능인 100%로 회복됨을 확인하였다.
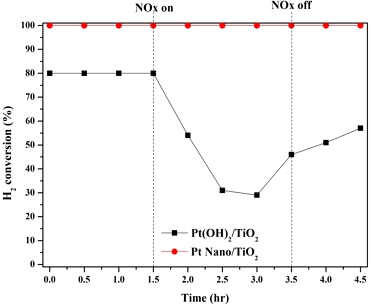
다음으로 Pt(OH)2/TiO2 촉매는 상온에서 0.20% 수소에 반응성이 없으므로 50℃에서 Pt(OH)2/TiO2, Pt Nano/TiO2 두 촉매의 질소산화물에 대해 ON/OFF 실험을 진행하였다. 실험 결과 상온과는 달리 Pt Nano/TiO2 촉매는 질소산화물 주입과 상관없이 모두 100%의 성능을 나타내었다. Pt(OH)2/TiO2 촉매는 Fig. 1의 상온 수소 산화 반응 실험과는 달리 온도가 상승함에 따라 0%에서 약 80%의 초기 성능을 나타내었다. 반면 질소산화물을 동시 주입함에 따라 약 30%로 성능 저하가 나타났으며 질소산화물을 차단하여도 초기 성능으로 회복되지 않음을 확인하였다.
앞서 수행한 질소산화물 ON/OFF 실험 결과를 토대로 Pt Nano/TiO2 촉매의 질소산화물 내구성을 확인하였으며 Fig. 6에 나타내었다. 또한 성능이 저하된 Pt(OH)2/TiO2 촉매와의 비교를 위하여 흡착 특성 분석으로 NO-temperature programmed desorption (TPD) 분석을 수행하였으며 Fig. 7에 나타내었다.
NO-TPD 분석은 상온에서 수소와 질소산화물을 동시에 1시간 흡착한 후 비활성 기체인 질소를 주입하면서 10℃/min의 승온 속도로 700℃까지 상승시키며 흡/탈착 정도를 확인하였다. Pt(OH)2/TiO2 촉매는 온도가 증가함에 따라 3번의 큰 탈착 peak가 나타났으며 흡착량이 높은 것을 확인하였다. 반면 Pt Nano/TiO2 촉매는 온도가 증가하여도 NOx 탈착이 매우 미미하였으며 Pt(OH)2/TiO2 촉매 대비 약 300배 이하의 흡착량 차이를 나타냈다. Pt Nano/TiO2 촉매는 Pt(OH)2/TiO2 촉매와 달리 3배 넓은 비표면적을 가지면서 백금이 고분산되어 활성 사이트를 많이 가지고 있더라도 Pt0-terrace 구조가 지배적인 특성을 보이며 질소산화물 흡착을 억제하였기 때문에 촉매 내구성에 문제가 없었다고 판단된다.
3.3 분말형 촉매가 코팅된 honeycomb 촉매 성능
3.1절과 3.2절의 수소 산화 성능 및 내구성 결과를 토대로 Pt Nano/TiO2 분말형 촉매를 300 cpsi honeycomb에 코팅하여 회분식 반응기에서 수소 산화 실험을 진행하였다. 실험에 사용된 촉매는 1.125 L (150 mm × 150 mm × 50 mm)의 honeycomb을 이용하였으며 촉매 방향으로 혼합가스(수소, 공기, 수분)가 유입될 수 있도록 촉매 전단에 ON/OFF가 가능한 fan을 설치하여 수소 제거 장치를 구성하였다. 장치의 실제 사진을 Fig. 8에 나타내었다.
회분식 반응기에서의 실험은 수소 제거 장치를 반응기 최상단에 설치하고 0.20%의 수소가 혼합된 가스를 반응기 내부에 충진하였다. 이후 fan을 작동시켜 수소 제거 속도와 농도 변화를 연속적으로 측정하였으며 이를 Fig. 9에 나타내었다.
회분식 반응기 실험은 수소 ON/OFF 방식의 두 가지로 진행하였다. 먼저 회분식 반응기 내부에 0.20%의 수소가 포함된 혼합가스를 충진한 상태에서 주입 가스를 차단한 후 fan을 작동하여 수소 농도 변화를 확인하였다. 이때 0.10%까지 수소가 감소하는 시간은 30초 이내, 0.001%까지는 90초 이내였다. 다음으로 동일 조건의 가스를 연속적으로 주입하면서 fan을 작동시켰다. Fan 작동에 따라 0.20%의 수소는 0.10%까지 60초, 0.001%의 수소 농도까지 130초 이내에 도달함을 확인하였다.
4. 결 론
본 연구는 기존 피동형 수소 재결합기의 고농도 수소 제거 기술을 보완하여 수소 폭발 안정성 확보를 위한 방법 검토에 관한 것이다. 분말형 촉매 및 honeycomb 촉매가 포함한 수소 제거 장치 실험을 통해 얻은 결론은 다음과 같다.
- 1) 분말형 촉매의 구조적 특성과 수소 산화 반응과의 상관관계를 확인하였을 때 metallic Pt가 고분산되기 위해서는 비표면적이 넓어야 하며 Pt0-terrace 구조가 지배적일 경우 저농도 수소 반응이 유리함을 확인하였다.
- 2) Pt0-terrace 구조가 지배적인 Pt Nano/TiO2 촉매를 이용한 수소 제거 장치는 0.20%라는 저농도에서 짧은 시간 내 수소 제거가 가능함을 확인하였으며 이를 통해 고농도 수소 제거에 적합한 기존 PAR 대비 수소 폭발 안정성 확보가 유리할 것으로 판단된다.
References
-
M. J. Jeon, D. J. Jang, and M. C. Lee, “A study on the risk assessment and improvement methods based on hydrogen explosion accidents of a power plant and water electrolysis system”, Journal of Hydrogen and New Energy, Vol. 35, No. 1, 2024, pp. 66-74.
[https://doi.org/10.7316/JHNE.2024.35.1.66]

-
H. K. Kim and I. Choi, “Exploration of hydrogen research trends through social network analysis”, Journal of Hydrogen and New Energy, Vol. 33, No. 4, 2022, pp. 318-329.
[https://doi.org/10.7316/KHNES.2022.33.4.318]

-
B. Gera, P. K. Sharma, R. K. Singh, and K. K. Vaze, “CFD analysis of passive autocatalytic recombiner”, Science and Technology of Nuclear Installations, Vol. 2011, 2011, pp. 862812.
[https://doi.org/10.1155/2011/862812]

-
S. B. Kim, J. H. Shin, G. J. Kim, and S. C. Hong, “Promoting metal–support interaction on Pt/TiO2 catalyst by antimony for enhanced carbon monoxide oxidation activity at room temperature”, Industrial & Engineering Chemistry Research, Vol. 61, No. 40, 2022, pp. 14793-14803.
[https://doi.org/10.1021/acs.iecr.2c01518]

-
S. T. Hossain, Y. Almesned, K. Zhang, E. T. Zell, D. T. Bernard, S. Balaz, and R. Wang, “Support structure effect on CO oxidation: a comparative study on SiO2 nanospheres and CeO2 nanorods supported CuOx catalysts”, Applied Surface Science, Vol. 428, 2018, pp. 598-608.
[https://doi.org/10.1016/j.apsusc.2017.09.199]

-
M. A. Aramendía, J. C. Colmenares, A. Marinas, J. M. Marinas, J. M. Moreno, J. A. Navío, and F. J. Urbano, “Effect of the redox treatment of Pt/TiO2 system on its photocatalytic behaviour in the gas phase selective photooxidation of propan-2-ol”, Catalysis Today, Vol. 128, No. 3-4, 2007, pp. 235-244.
[https://doi.org/10.1016/j.cattod.2007.07.009]

-
L. Nie, J. Yu, X. Li, B. Cheng, G. Liu, and M. Jaroniec, “Enhanced performance of NaOH-modified Pt/TiO2 toward room temperature selective oxidation of formaldehyde”, Environmental Science & Technology, Vol. 47, No. 6, 2013, pp. 2777-2783.
[https://doi.org/10.1021/es3045949]

-
G. J. Kim, D. W. Kwon, and S. C. Hong, “Effect of Pt particle size and valence state on the performance of Pt/TiO2 catalysts for CO oxidation at room temperature”, The Journal of Physical Chemistry C, Vol. 120, No. 32, 2016, pp. 17996-18004.
[https://doi.org/10.1021/acs.jpcc.6b02945]

-
S. S. Kim, K. H. Park, and S. C. Hong, “A study on HCHO oxidation characteristics at room temperature using a Pt/TiO2 catalyst”, Applied Catalysis A: General, Vol. 398, No. 1-2, 2011, pp. 96-103.
[https://doi.org/10.1016/j.apcata.2011.03.018]

-
S. S. Kim, K. H. Park, and S. C. Hong, “A study of the selectivity of the reverse water–gas-shift reaction over Pt/TiO2 catalysts”, Fuel Processing Technology, Vol. 108, 2013, pp. 47-54.
[https://doi.org/10.1016/j.fuproc.2012.04.003]

-
D. W. Kwon, P. W. Seo, G. J. Kim, and S. C. Hong, “Characteristics of the HCHO oxidation reaction over Pt/TiO2 catalysts at room temperature: the effect of relative humidity on catalytic activity”, Applied Catalysis B: Environmental, Vol. 163, 2015, pp. 436-443.
[https://doi.org/10.1016/j.apcatb.2014.08.024]

-
G. J. Kim, J. H. Shin, and S. C. Hong, “ Study on the role of Pt and Pd in Pt–Pd/TiO2 bimetallic catalyst for H2 oxidation at room temperature”, International Journal of Hydrogen Energy, Vol. 45, No. 35, 2020, pp. 17276-17286.
[https://doi.org/10.1016/j.ijhydene.2020.03.062]

-
S. Zafeiratos, G. Papakonstantinou, M. M. Jacksic, and S. G. Neophytides, “The effect of Mo oxides and TiO2 support on the chemisorption features of linearly adsorbed CO on Pt crystallites: an infrared and photoelectron spectroscopy study”, Journal of Catalysis, Vol. 232, No. 1, 2005, pp. 127-136.
[https://doi.org/10.1016/j.jcat.2005.03.003]

-
N. Li, Q. Y. Chen, L. F. Luo, W. X. Huang, M. F. Luo, G. S. Hu, and J. Q. Lu, “Kinetic study and the effect of particle size on low temperature CO oxidation over Pt/TiO2 catalysts”, Appied Catalysis B: Environmental, Vol. 142-143, 2013, pp. 523-532.
[https://doi.org/10.1016/j.apcatb.2013.05.068]

-
M. S. Kim, S. W. Kim, and S. C. Hong, “A study on the characteristics of CO oxidation by NO poisoning in Pt/TiO2 catalyst”, Clean Technology, Vol. 25, No. 4, 2019, pp. 296-301.
[https://doi.org/10.7464/ksct.2019.25.4.294]

-
S. H. Oh and J. E. Carpenter, “Role of NO in inhibiting CO oxidation over alumina-supported rhodium”, Journal of Catalysis, Vol. 101, No. 1, 1986, pp. 114-122.
[https://doi.org/10.1016/0021-9517(86)90234-4]

-
S. An, S. Oh, E. Kim, J. Lee, and B. Ma, “Optimization of designing barrier to mitigate hazardous area in hydrogen refueling stations”, Journal of Hydrogen and New Energy, Vol. 34, No. 6, 2023, pp. 734-740.
[https://doi.org/10.7316/JHNE.2025.36.1.64]