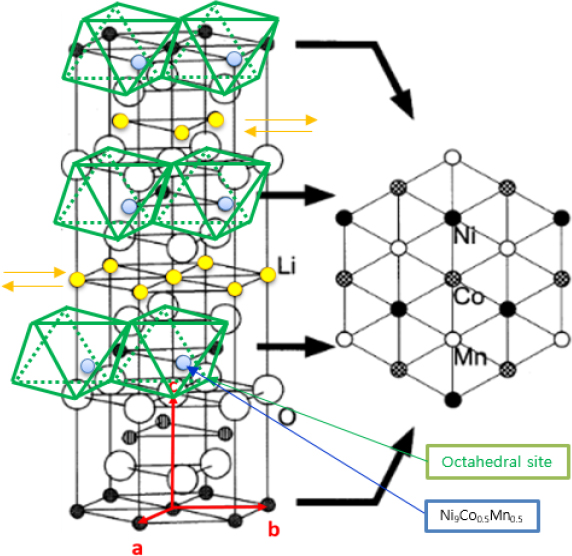
블랙 파우더 침출용액을 이용한 재활용 리튬이온전지의 양극 활물질 공침법에 대한 연구
2024 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
In this study, a Ni0.9Co0.05Mn0.05(OH)2 precursor used as an anode active material using a black powder leaching solution of a recycled lithium ion battery was prepared through coprecipitation synthesis with co-precipitation time, NH4OH concentration, pH, and stirring time as variables. The characteristics of the prepared powder were analyzed by X-ray diffraction (XRD), scanning electron microscope (SEM), particle size analysis (PSA), and inductively coupled plasma optical emission spectroscopy (ICP-OES). It was confirmed that the single crystal thickness of the LiNi1-x-yCoxMnyO2 (NCM) precursor changes depending on the NH4OH concentration and reaction pH value, and thicker single crystals are formed at 2 M NH4OH compared to 1 M and at pH 10.8-11.8 compared to pH 11.8-12.0. NCM precursor particles increased with coprecipitation time, and it was confirmed that the 72 hours NCM precursor had the largest particle size. Through ICP-OES analysis, it was confirmed that the NCM precursor was synthesized with the target composition of Ni2+:Co2+:Mn2+=90:5:5.
Keywords:
Lithium ion battery, Cathode active material, Co-precipitation, Precursor, Black powder키워드:
리튬이온전지, 양극 활물질, 공침법, 전구체, 블랙 파우더1. 서 론
리튬이차전지의 4대 요소인 양극, 음극, 전해질, 분리막 중 전지의 전체적인 성능을 좌우하는 요소는 양극 활물질이다. 양극 활물질은 리튬이온을 포함하기 때문에 이 활물질이 갖는 에너지 용량과 리튬이온 탈착의 용이성 등이 리튬이차전지의 전체 성능을 좌우한다. 이러한 중요성으로 인해 다양한 결정 구조와 특성을 갖는 양극 활물질이 활발히 개발되고 있다1,2). 이 중 LiCoO2는 다른 양극재 대비 고온 안정성, 고출력, 고에너지 밀도의 특성으로 인해 현재에도 많이 사용되고 있다. LiCoO2에 사용되는 Co는 환경 문제 및 높은 제조비로 인해 Co를 대체할 수 있는 치환원소에 대한 연구가 활발히 진행되고 있다. Co의 함량을 줄이면서 구조적 안정성, 높은 에너지 용량, 낮은 인체 유해성 등의 특성을 향상시킬 수 있는 3성분계의 LiNi1-x-yCoxMnyO2 (NCM)가 개발되었으며 원자 함량비에 따른 특성 연구가 활발히 진행되고 있다3,4). 리튬이차전지에 사용되는 소재 중 3성분계 NCM 소재는 리튬니켈산화물의 고용량, 리튬코발트산화물의 전기화학적 안정성, 리튬망간산화물의 낮은 가격 및 열적 안정성의 장점들을 포함하여 리튬이차전지의 양극 소재로 널리 사용되고 있다5). 대용량 리튬이차전지 사용의 증가는 곧 원가 부담 증가 및 폐전지 발생 증가로 이어지고 심각한 환경 문제 역시 초래될 것으로 전망된다. 이러한 상황으로 인해 현재 재활용 리튬이차전지로부터 회수된 고가의 전이금속을 원료로 한 양극 소재 개발에 대한 재활용 연구가 활발히 진행되고 있다6). 재활용 리튬이차전지에서 3성분계 NCM 소재를 재활용하기 위해서는 재활용 리튬이차전지로부터 침출 공정을 통해 회수된 전이금속들을 공침 공정을 통해 전구체(Ni1-x-yCoxMny)로 재합성하는 과정을 거쳐야 한다. 공침 조건에 따라 다양한 조성의 NCM 전구체를 만들 수 있으며 요구되는 전구체를 효율적으로 제어하기 위해 온도, pH, stirring 속도, 금속염 농도 대비 착화제 종류 및 농도 등 공침 변수에 대한 활발한 연구가 진행되고 있다7). 본 논문에서는 global electric vehicle (EV) 시장의 증가와 함께 폐배터리도 증가할 것으로 예상됨에 따라 폐배터리 내 유독 물질로부터 야기되는 환경 문제와 또한 그 처리 비용 발생에 대한 해결 방안으로 폐배터리 내 유가금속을 재활용하는 연구를 진행하였다. 사용 후 리튬이온배터리의 유가금속 재활용을 위해 니켈(Ni), 코발트(Co), 망간(Mn) 등이 함유된 black powder 침출용액을 이용하여 공침 합성을 통해 NCM 전구체를 제조하였으며 NCM 전구체의 형상에 영향을 미치는 변수(공침 시간, 착화제 농도, pH, stirring time)에 대한 영향을 확인하였다. X-ray diffraction (XRD), scanning electron microscope (SEM), particle size analysis (PSA), inductively coupled plasma optical emission spectroscopy (ICP-OES)를 통해 재활용 black powder 침출 용액을 이용해 합성된 NCM 전구체의 구형화도, crystal microstructure, 입자 크기, 밀도, Ni1-x-yCoxMny(OH)2의 성분 분석을 진행하였다.
2. 실 험
2.1 연속교반식 반응기
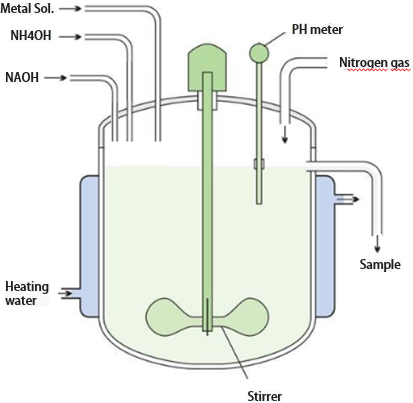
전구체 제조에 필요한 공침 합성을 하기 위해서는 연속교반식 반응기(continuously stirred tank reactor, CSTR)가 필요하다. 공침에 필요한 용액들이 반응기 내부로 투입되고 stirrer에 의해 교반되면서 공침 반응이 일어나 시간이 지남에 따라 전구체의 핵 생성과 성장이 증가하게 된다. Fig. 1은 CSTR의 모식도이다.
CSTR 외부는 이중 자켓으로 되어 있어 순환식 항온기를 이용하여 반응기 내부 온도를 반응 온도인 50℃로 유지하게 하였으며 질소 가스를 0.5 mL/min로 투입하여 외부 산소와의 접촉을 차단함으로써 전구체가 합성되면서 산소와 반응하여 산화되지 않도록 하였다. 반응에 참여하는 용액인 금속염용액, 착화제는 외부 자동 조절 펌프를 이용하여 시간당 120 mL로 동일한 양이 들어가도록 설정하였으며 pH 조절제는 반응기 내부에 pH meter를 pH 10.8-11.0와 11.8-12.0으로 세팅하여 공침 반응 중 pH 값이 설정값으로 유지되도록 하였다. 반응기 내부 교반은 stirrer을 이용하여 Ostwald ripening 현상이 원활히 이뤄질 수 있도록 Rpm 값을 1,000으로 고정하였다. Table 1에 CSTR 조건에 대해 표기하였다.
본 연구에서는 유가금속이 함유된 recycling 침출용액을 이용하여 NCM 공침 합성을 진행하였으며 NCM 전구체 형성은 Fig. 2와 같다.
NCM 전구체 공침 반응식은 식 (1)과 같다.
| (1) |
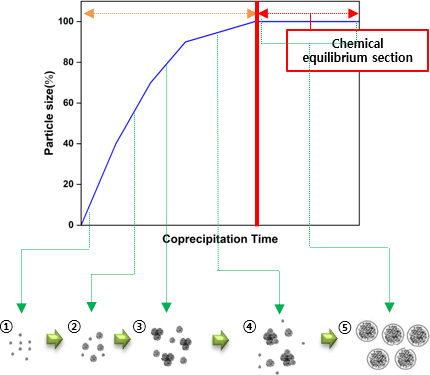
Fig. 3은 공침 시간에 따른 전구체 입도 변화 모식도이다. 변화 단계는 NCM 전구체 시드 생성, 일부 NCM 전구체 성장, NCM 전구체 응집 시작, 작은 NCM 전구체는 더 작아지고 큰 NCM 전구체는 더 커지는 과정, 작은 입자는 융해되어 사라지고 일정한 크기의 NCM 전구체 형성이다.
2.2 금속염용액, 착화제(NH4OH), pH 조절제(NaOH)
금속염용액은 폐리튬이차전지에서 1차 가공되어 회수된 black powder 침출용액을 Ni:Co:Mn=90:5:5의 성분으로 조성되도록 NiSO4·6H2O (nickel[II] sulfate hexahydrate, 98.5%), CoSO4·7H2O (cobalt[II] sulfate heptahydrate, 98.0%), MnSO4·H2O (manganese [II] sulfate monohydrate, 98.0%)를 증류수와 함께 첨가하여 제조하였다. 성분 조정 전 재활용 black powder의 Ni, Co, Mn 성분 분석 후 Ni:Co:Mn=90:5:5 atomic contents에 맞춰 추가로 첨가하였으며 2 M의 금속염용액을 만들기 위하여 증류수를 추가로 넣어 용융시킨 후 사용하였다. 착화제로 사용되는 NH4OH (ammonium hydroxide [ammonia water], 25-28%)는 증류수와 함께 1, 2 M의 용액으로 제조하여 사용하였다. pH 조절제는 pellet 형태인 NaOH (sodium hydroxide, pellet 순도 97%)를 증류수에 넣어 2 M의 용액으로 제조하여 사용하였다.
2.3 공침반응 시험
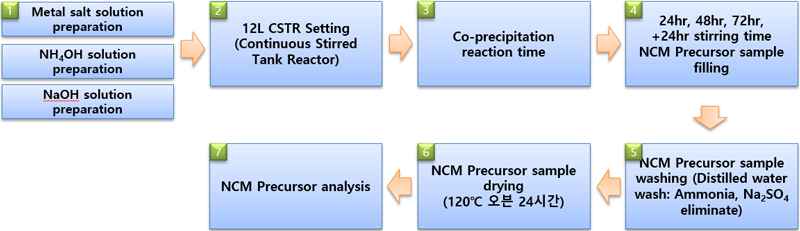
공침반응기 내부에 증류수를 overflow 라인까지 채운 후 stirrer 속도를 Rpm 1,000으로 유지하였다. 항온기를 가동하여 내부 deionized (DI) water의 온도를 50℃까지 올라가도록 1시간 동안 유지하였다. 50℃까지 올라간 DI water에 NaOH 용액을 투입하여 pH 10.8-11.0과 pH 11.8-12.0으로 맞춰서 공침반응 시험을 준비하였다. 공침반응 시험 시작 10분 전 질소 가스를 0.5 mL/min의 유량으로 반응기 내부로 10분간 투입 유지하여 불활성 분위기가 되도록 하였다. 공침반응은 NaOH 용액이 pH 10.8-11.0과 pH 11.8-12.0에 맞춰 들어가도록 펌프 설정 후 시작하였고 120 mL/hr의 유량으로 설정된 금속염용액과 NH4OH 용액을 동시에 투입하여 공침반응을 시작하였다. 1 M과 2 M의 NH4OH 농도 그리고 pH 10.8-11.0과 pH 11.8-12.0의 변수를 통한 공침시험에서 24시간, 48시간에 전구체를 샘플링하였으며 pH 변수 공침시험에서는 stirring 시간이 전구체 형상에 미치는 영향을 알아보기 위하여 72시간 샘플링 이후 24시간 동안 stirring만 진행 후 추가 샘플링하였다. 공침시험 중 샘플링 후 pH meter를 calibration한 후 시험을 재시작하였다.
2.4 NCM 전구체 샘플 후처리
공침반응에서 합성된 NCM 전구체를 증류수로 15분간 3회 세척 후 120℃의 건조기를 이용하여 24시간 이상 건조하였다. 건조가 완료된 NCM 전구체는 세라믹 유발을 이용하여 미세분말 형태로 만든 후 분석을 진행하였다. Fig. 4는 공침반응 실험 플로우차트 도형이다.
2.5 분석 방법
CSTR에서 니켈(Ni), 코발트(Co), 망간(Mn)이 Ni1-x-yCoxMny(OH)2 전구체의 결정 구조로 합성되었는지 확인하기 위하여 XRD 분석을 통해 결정 구조를 확인하였다. Cu-Kα (λ=1.54 Å)로 분당 5°/min의 scan speed로 10-80의 범위의 XRD peak을 탐색하였다. NCM 전구체의 XRD 데이터는 Rietveld analysis를 이용하여 격자상수에 대한 정보와 Scherrer equation을 통해 single crystal grain size에 대한 정보를 얻었다. SEM 분석에서 공침반응 동안 생성된 전구체 샘플의 표면 형상과 입자 크기 변화에 대해 확인하였다. 시간이 지남에 따라 전구체 표면에 형성되는 NCM 화합물의 형태 변화를 시간별로 분석하였으며 NH4OH 착화제 및 pH 변수에 따른 형태 변화와 stir-ring time에 따른 NCM 전구체의 형태 차이를 분석하였다. 입도 분석인 PSA에서는 공침반응 변수에 대한 NCM 전구체의 입자 크기를 분석하였으며 공침반응 시작 이후 입자의 성장 변화에 대한 정보를 얻었다. 그리고 NH4OH 착화제 및 pH 변수에 따른 형태 변화와 stirring time에 따른 전구체의 입자 크기 변화도 PSA를 통해 정보를 얻었다. ICP-OES 분석에서는 공침반응에 참여하는 재활용 리튬배터리 black powder 침출용액과 보정된 금속염용액 그리고 공침반응으로 생성된 NCM 전구체의 니켈(Ni), 코발트(Co), 망간(Mn)의 atomic contents 함량비를 확인하기 위하여 ICP-OES 분석을 통해 Ni, Co, Mn 성분 함량에 대한 정보를 얻었다.
3. 결과 및 고찰
3.1 재활용 리튬배터리 black powder 침출용액을 이용한 공침반응 실험
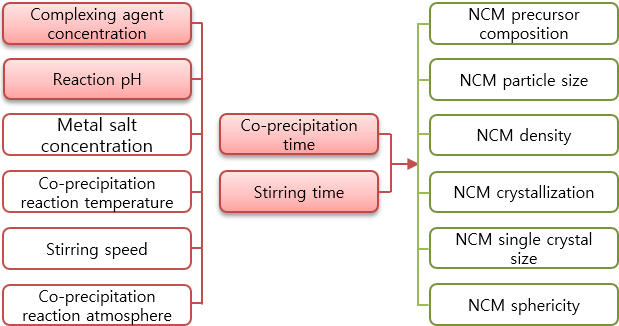
재활용 리튬배터리 black powder 침출용액의 공침법에 대한 연구로 NCM 전구체 형성에 영향을 미치는 반응 시간, NH4OH 농도, 공침반응 pH, stirring time 총 4가지의 변수를 가지고 공침시험을 진행하였다. 변수 조건에 대한 sample 번호와 해당 변수 조건을 정리하여 Table 2에 나타내었다.
3.2 XRD 분석
공침반응 중 형성되는 NCM 전구체의 결정 구조를 알아보기 위하여 XRD 분석을 진행하였다. Fig. 5는 공침 과정 중 생성된 NCM 전구체 분말의 XRD 그래프 및 commercial NCM 전구체 XRD 그래프를 나타내었다. NCM hexagonal 결정 구조(P3m1)는 Fig. 6으로 표현하였다. XRD data와 hexagonal crystal structure의 면간거리 계산식을 통해 a, c의 격자 상수를 계산하여 Table 3에 나타내었다. Hexagonal crystal structure 공식은 식 (2)과 같다.
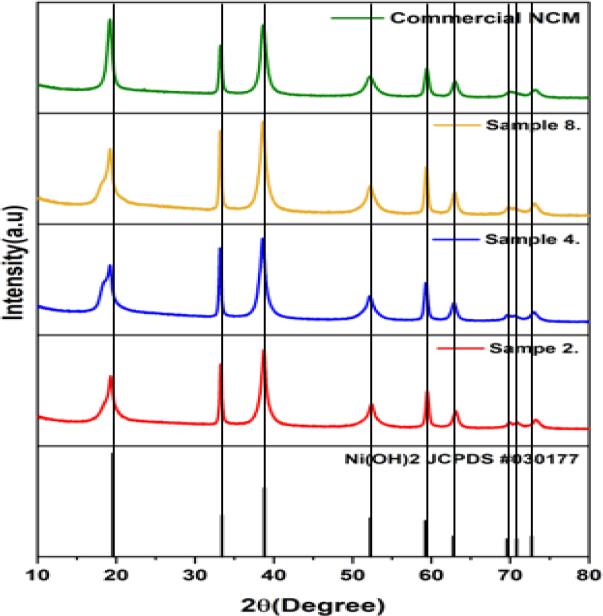
(a) Ni(OH)2 JCPDS PDF #030177. (b) Commercial NCM. (c) NH4OH 1 M (pH 11.8-12.0) 48 hours sample 2. (d) NH4OH 2 M (pH 11.8-12.0) 48 hours sample 4. (e) NH4OH 2 M (pH 10.8-11.0) 48 hours sample 8. XRD comparison graphs
Hexagonal lattice plane spacing equation: (a=b≠c)
| (2) |
3.3 SEM 분석
공침 시간, stirring 시간, NH4OH 농도, pH 변화에 따른 NCM 전구체 형상 변화를 알아보기 위하여 SEM-energy dispersive spectrometer (EDS) 분석을 진행하였고 commercial NCM 전구체와 비교 분석하였다. SEM 분석을 통해 공침 시간이 증가함에 따라 입자가 성장하는 것을 알 수 있다. Fig. 7에서 보면 Ostwald ripening 원리에 의해 시간이 지남에 따라 초기의 작은 입자는 융해되어 사라지고 큰 입자는 NCM 전구체로 성장한다. 72시간 NCM 전구체 sample의 경우 얇은 1차 입자(단결정)가 뭉쳐 2차 입자(구형)로 성장한 것을 확인하였다. Fig. 8에서 NH4OH 2 M보다 1 M에서 형성된 NCM 전구체의 1차 입자(단결정)가 더 얇은 침상의 형태를 보이며 치밀한 구조를 형성하는 것으로 확인된다. 1차 입자들이 안정화되기 위해 2차 입자(구형)로 성장하는 과정에서 얇은 입자들의 경우 사이사이 빈 공간을 차지하여 전구체 밀도가 치밀하게 형성될 것으로 판단된다. 1차 입자가 두꺼운 경우 입자 사이에 형성되는 공극의 크기가 얇은 입자의 NCM 전구체보다 상대적으로 크게 되고 이러한 공극이 리튬이온의 이동을 방해할 것으로 판단된다. Fig. 9에서는 pH 11.8-12.0보다 pH 10.8-11.0에서 형성된 NCM 전구체의 1차 입자(단결정)가 더 얇은 침상의 형태를 보이며 치밀한 구조를 형성하는 것으로 확인되었다. Stirring time 증가에 따른 NCM 전구체 형상 변화를 육안으로는 확인할 수 없었다. Stirring time 증가에 따라 NCM 전구체 간 충돌로 일부 NCM 전구체의 mechanical 구형화가 진행되었을 것으로 판단되며 입도 또는 밀도에서 차이가 있을 것으로 예상된다.
3.4 PSA 분석
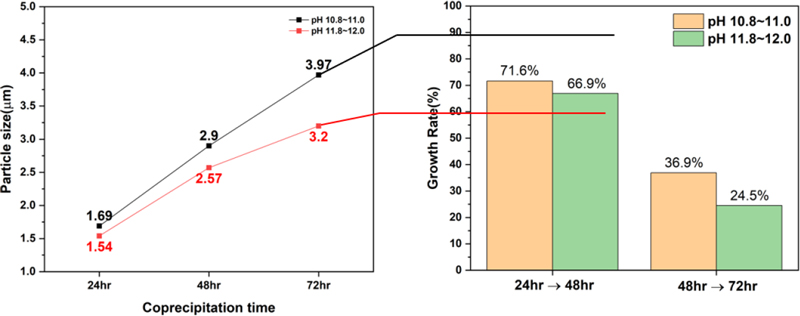
공침 시간, stirring 시간, NH4OH 농도, pH 변화에 따른 NCM 전구체의 입자 크기 변화를 알아보기 위하여 PSA 분석을 진행하였고 commercial NCM 전구체와 비교 분석하였다. Fig. 10의 그래프를 보면 Ostwald ripening 원리로 시간이 지남에 따라 NCM 전구체 입자가 성장하는 것을 확인하였다. 분석 결과 반응 pH 조건에 따라 입자 크기 차이가 있으며 pH 10.8-11.0 조건에서 더 큰 입자를 형성하였다. pH 조건에 의해 입자 성장률 차이가 있으며 48시간에서 72시간으로 갈수록 성장률 차이는 더 심해지는 것을 확인하였다. 화학적 평형 상태를 이루게 되는 구간에서의 입자 최대 크기는 반응 pH에 영향을 받을 것으로 예상된다. Fig. 11에서는 1 M의 NH4OH 농도보다 2 M에서 더 큰 입자 성장을 확인하였고 NH4OH 농도 조건에 따라 1차 입자(단결정)의 두께와 입자 성장에 영향을 미치는 것으로 확인하였다. Stirring 시간 증가에 따른 전구체 형상 변화는 육안으로 확인되지 않으나 입도에서 미세한 차이를 보인다. pH 조건에 관계없이 24시간 추가 stirring 진행 시 0.01 μm의 입도 감소가 발생한다.
3.5 ICP-OES 분석
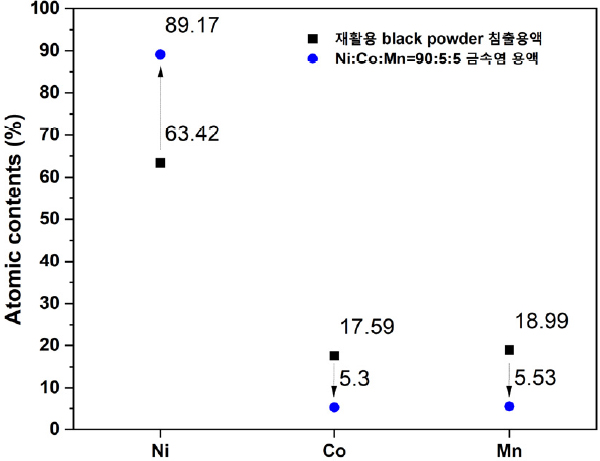
재활용 리튬배터리 black powder 침출용액과 Ni:Co:Mn=90:5:5로 보정된 금속염 그리고 공침시험에 의해 형성된 NCM 전구체의 Ni, Co, Mn의 성분 함량을 확인하기 위하여 ICP 분석을 진행하여 Table 4에 나타내었다. Fig. 12에 나타낸 것과 같이 재활용 리튬배터리 black powder 침출용액을 이용하여 목표로 하였던 Ni:Co:Mn=90:5:5의 조성에 근접한 atomic contents (%)를 갖는 금속염용액으로 보정된 것을 확인하였고 보정된 금속염용액을 이용한 공침실험에서 오차값 0.1% 미만의 atomic contents (%)를 갖는 NCM 전구체가 합성된 것을 확인하였다.

Atomic contents (%) analysis table of black powder leaching solution, corrected metal salt solution, and NCM precursor
4. 결 론
본 연구는 재활용 리튬이온배터리 black powder 침출 및 용매 추출을 통해 회수한 고순도의 Ni, Co, Mn 유가금속을 100% 사용하여 NCM 전구체를 제조하는 기존의 재활용 순환 공법과는 달리 유가금속 용매 추출 이전의 black powder 침출용액을 이용하여 공침 합성을 함으로써 용매 추출 중 발생되는 환경 문제 및 추가 공정비용 문제를 해소하고자 하였다. 연구 결과 재활용 black powder 침출용액을 이용하여 Ni2+:Co2+:Mn2+=90:5:5의 전구체 공침 합성이 가능하며 NH4OH 농도, 반응 pH, 공침 시간 등의 변수를 조절하여 commercial NCM 전구체와 동일한 특성을 갖는 NCM 전구체를 합성할 수 있는 것으로 판단된다. 향후 추가 교반 시간의 기계적인 구형화에 대한 연구가 필요하다.
Acknowledgments
본 결과물은 2024년도 교육부의 재원으로 한국연구재단의 지원을 받아 수행된 지자체-대학 협력 기반 지역혁신사업의 결과입니다(2021RIS-002).
References
-
H. J. Sun, J. H. Lee, H. Y. Jeong, D. C. Seok, Y. Jung, G. Park, and J. Shim, “Characterization of atmospheric H2-plasma-treated LiNi1/3Co1/3Mn1/3O2 as cathode materials in lithium rechargeable batteries”, Journal of Hydrogen and New Energy, Vol. 24, No. 2, 2013, pp. 160-171.
[https://doi.org/10.7316/KHNES.2013.24.2.160]

-
H. S. Ryu and I. S. Kim, “Research of electrochemical properties with metal sulfide electrode for lithium batteries”, Journal of Hydrogen and New Energy, Vol. 31, No. 1, 2020, pp. 138-143.
[https://doi.org/10.7316/KHNES.2020.31.1.138]

-
T. Ohzuku and Y. Makimura, “Layered lithium insertion material of LiCo1/3Ni1/3Mn1/3O2 for lithium-ion batteries”, Chemistry Letters, Vol. 30, No. 7, 2001, pp. 642-643.
[https://doi.org/10.1246/cl.2001.642]

-
I. Belharouak, Y. K. Sun, J. Liu, and K. Amine, “Li(Ni1/3Co1/3Mn1/3)O2 as a suitable cathode for high power applications”, Journal of Power Sources, Vol. 123, No. 2, 2003, pp. 247-252.
[https://doi.org/10.1016/S0378-7753(03)00529-9]

-
L. Liang, K. Du, Z. Peng, Y. Cao, J. Duan, J. Jiang, and G. Hu, “Co-precipitation synthesis of Ni0.6Co0.2Mn0.2(OH)2 precursor and characterization of LiNi0.6Co0.2Mn0.2O2 cathode material for secondary lithium batteries”, Electrochimica Acta, Vol. 130, 2014, pp. 82-89.
[https://doi.org/10.1016/j.electacta.2014.02.100]

-
D. Han, I. Park, M. Kim, D. Kim, and H. Jung, “Study on the optimum conditions for synthesizing a cathode active material precursor in Li-ion batteries using a Taylor reactor”, Korean Journal of Metals and Materials, Vol. 57, No. 6, 2019, pp. 360-365.
[https://doi.org/10.3365/KJMM.2019.57.6.360]

-
C. Deng, L. Liu, W. Zhou, K. Sun, and D. Sun, “Effect of synthesis condition on the structure and electrochemical properties of Li[Ni1/3Mn1/3Co1/3]O2 prepared by hydroxide coprecipitation method”, Electrochimica Acta, Vol. 53, No. 5, 2008, pp. 2441-2447.
[https://doi.org/10.1016/j.electacta.2007.10.025]