시멘트 산업에서 배출한 CO2로부터 메탄올 생산에 대한 공정 시뮬레이션 연구
2024 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
The cement industry emits a large amount of greenhouse gases compared to other industries, with about 60% of CO2 emissions from the decarbonation of limestone and about 40% from the combustion of fossil fuels. Therefore, the cement industry needs to reduce greenhouse gases through carbon capture, utilization, and storage technology. Capturing CO2 and synthesizing it into methanol is feasible and also useful as raw material for the chemical industry and as marine fuel. In this study, We aimed to produce methanol from syngas produced by capturing CO2 emissions. Process simulations were performed under various conditions such as syngas ratio, temperature, and pressure for the production of synthesis gas and methanol, and the results showed that the optimal amount of methanol production at a synthesis gas ratio of 2.03.
Keywords:
Carbon neutral, CO2 utilization, Methanol, Exergy키워드:
탄소중립, 이산화탄소 활용, 메탄올, 엑서지1. 서 론
현재 지구는 심각한 기후 변화 위기에 직면해 있다. 이는 주로 인간 활동으로 인해 대기 중에 방출되는 온실가스, 특히 이산화탄소(CO2) 증가 때문이다. CO2는 열을 가두는 성질을 가지고 있어 지구온난화를 가속화하는 주범으로 지목된다. 만약 지속적인 CO2 배출을 방치한다면 지구온난화는 더욱 심각해져 극심한 기상 현상, 해수면 상승, 식량 부족, 생태계 파괴 등 돌이킬 수 없는 피해를 초래할 수 있다. 따라서 지구 환경을 보호하고 지속 가능한 미래를 위해서는 배출된 CO2를 줄이는 노력과 더불어 이미 대기 중에 존재하는 CO2를 포집하고 활용하는 CO2 전환 기술 개발이 시급하다.
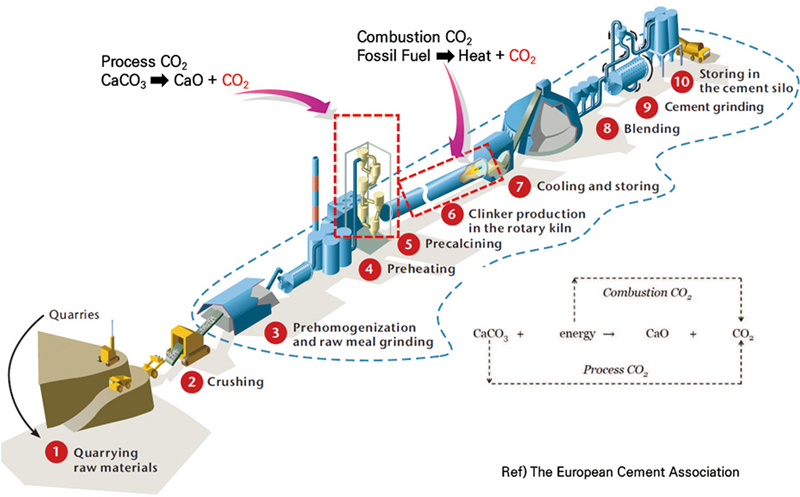
특히 시멘트 산업에서 발생하는 CO2 배출량은 전체 산업에서 3번째로 많은 양을 차지하고 있으며 화석연료에 의한 배출이 대부분의 배출량을 차지하는 다른 산업들과는 달리 화석연료의 연소 과정에 배출되는 양은 40%이고 시멘트의 원료인 석회석의 탈탄소 과정에서 배출되는 양이 60%를 차지한다(Fig. 1)1). 화석연료 연소 시의 CO2 배출은 유연탄을 폐합성수지로 대체하는 등의 에너지원 대체를 통해 감축할 수 있으나 원료인 석회석에서 배출되는 CO2의 경우 포집하여 고부가가치의 물질을 만드는 carbon capture, utilization, and storage (CCUS) 기술이 경제적이며 배출량 감축에 중요한 역할을 할 것으로 예상된다.
전 세계적으로 포집된 CO2를 바이오연료, 플라스틱, 건축 자재 등 다양한 물질로 전환하는 기술 개발에 힘쓰고 있다. 특히 광합성 인공 시스템, 생물학적 전환 기술, 전기화학적 전환 기술 등 새로운 전환 기술 개발 연구가 활발하게 진행되고 있으며 이러한 기술들은 CO2를 활용한 다양한 신소재, 신에너지 개발에 기여할 것으로 기대된다. 현재 CCUS의 기술로 탈탄소 공정을 통한 화학적 전환 공정으로 메탄올, 암모니아, 디젤, 가솔린과 같은 연료를 생산할 수 있다. 또한 CO2 포집과 정제 공정을 거친 CO2를 개질을 통해 합성가스를 제조하고 합성가스의 촉매반응을 통해 다양한 화학제품으로 전환할 수 있으며 그린수소와의 CO 또는 CO2 촉매 반응에 의한 메탄올과 메탄 등으로 전환하는 power-to X 공정 기술을 통해 E-fuel과 전기화학적 전환 물질을 생산한다2). 전기 촉매에 의한 이산화탄소의 환원 반응은 탄소 배출을 제어할 수 있으며 촉매를 통해 원하는 생성물을 형성할 수 있다3). Power-to X는 신재생에너지로부터 수전해 방식으로 수소를 생산하고 포집 CO2 또는 바이오가스나 천연가스의 개질로부터 생성된 합성가스(H2, CO)에 수소를 첨가하여 E-fuel을 생산하거나 수소와 CO2를 촉매 반응을 통해 CH4으로 환원시키는 열화학적 메탄화 기술이 있다4). 수소를 생산하는 과정을 거치지 않고 CO2와 물을 직접 전기화학적으로 전환하는 연구도 진행되고 있지만 지금까지는 매우 제한적이며 많은 양의 에너지와 큰 규모의 전해조를 필요로 한다5).
다양한 제품에서 메탄올은 미래 연료 시장에서 핵심적인 역할을 할 것으로 예상된다. 에너지 안보, 탄소 배출, 연료 다양화 등의 문제를 해결할 수 있는 잠재력이 있기 때문이다. 다목적이고 지속 가능한 연료인 메탄올은 기존 화석 연료에 비해 깨끗하게 연소되면서 탄소 배출량도 낮다는 이점이 있다. 뿐만 아니라 메탄올은 기존 인프라 및 엔진과 호환되기 때문에 실행 가능한 전환 연료로써 재생 에너지원으로의 전환을 촉진한다. 그리고 바이오매스와 포집된 이산화탄소 등 다양한 원료로부터 생산될 수 있어 수입 석유 의존도를 줄이고 에너지 자급을 촉진한다. 엄격한 배출 규제와 탈탄소화 추진 맥락에서 보면 메탄올은 특히 해상 및 대형 운송 부문에서 보다 친환경적인 운송 방식을 위한 잠재적인 길이 되고 있다6). 메탄올은 화석연료 기반의 연료에 비해 산소를 가지고 있기 때문에 완전 연소가 가능하며 분자량이 작은 단순한 알코올 연료이다. 메탄올은 옥탄가가 높아 노크 방지 특성이 우수하여 자동차의 연료로 적합하며 메탄올의 열효율 역시 가솔린보다 30% 높다. 따라서 메탄올은 효율적이며 자동차 또는 연료전지에 이용 가능한 청정 연료이다.
본 연구에서는 시멘트 산업에서 배출되는 CO2를 천연가스의 개질에 활용하여 생산한 합성가스를 기반으로 메탄올을 합성한다. 시멘트 공정에서 배출되는 CO2 50 ton/day와 천연가스 30 ton/day로부터 합성가스를 거쳐 메탄올을 생산하는 최적 조건을 찾고자 하였으며 엑서지를 통해 공정 조건별 에너지 효율을 분석하고자 하였다.
2. 연구 방법
2.1 CO2 전환을 통한 메탄올 공정
시멘트 생산 공정에서 발생하는 CO2를 포집하고 포집된 CO2를 메탄 개질 반응에 이용하여 합성가스를 생산한다. CO2와 H2O가 메탄의 산화제로 작용하여 CO와 H2가 생성되는 반응이 일어남과 동시에 CO2와 H2O의 산소 원자가 CH4과 반응하면서 partial oxidation 반응이 일어난다7,8).
| (1) |
| (2) |
| (3) |
따라서 steam CO2 reforming (SCR) 반응은 CH4가 CO2, H2O와 각각 반응하며 강한 흡열 반응으로 높은 에너지를 필요로 하여 675℃ 이상의 온도에서 반응하고 800-850℃에 가까울수록 CO2의 초기 농도가 낮아진다9).
앞의 반응으로부터 생산된 합성가스(H2/CO)는 합성 촉매 반응기 내에서 다음과 같은 반응을 통해 생산된다.
| (4) |
| (5) |
메탄올을 생산하는 과정은 발열 반응으로 개질 반응 대비 낮은 온도(200-300℃)에서 생산하는 것이 유리하나 전통적인 산업에서의 메탄올 생산은 고온, 고압에서 수행되어 CO의 이론적 전환율은 화학적 평형값에 제한되어 있다. 반응열 발생으로 인한 열축적과 온도 변화에 대한 해결을 위해 많은 연구가 이루어져 왔으며 일반적으로 CO의 전환율은 20% 미만이다10,11). 합성가스로부터 생산되는 메탄올 합성 촉매의 경우 전통적으로 CuO/ZnO/Al2O3가 사용되고 있으며 Haldor Topsoe, Johnson Matthey 및 Clariant 등 다수의 기업에서 상업적으로 제공하고 있다.
2.2 분석 방법
반응기의 공정 모사는 공정 열역학을 바탕으로 수학적으로 모델링하여 PRO/II (AVEVA, Cambridge, UK) Aspen plus (AspenTech, Bedford, MA, USA) 공정 시뮬레이터를 이용하여 수행하였다. 공정 모사에서 열역학식은 vapor-liquid equilibrium 상태에 대한 해석이 가능한 Soave-Redlich-Kwong 방정식을 사용하였으며 반응기 모사에는 conversion 반응기와 equilibrium 반응기를 사용하였다.
개질 반응과 메탄올 합성 반응을 공정 모사한 결과로부터 엑서지(exergy)라는 개념을 이용하여 각 반응 조건에서의 에너지 효율을 분석하였다. 엑서지는 고온이나 저온의 에너지원 상태로부터 우리가 생활하고 있는 환경까지 실질적으로 이용할 수 있는 일 형태의 유효 에너지량을 의미한다.
원료인 CO2와 CH4의 유입부터 메탄올 합성까지에 대한 반응 공정의 각 피드에서 변화되는 엔트로피와 엔탈피를 통해 엑서지 값을 구하고 공정 내 온도 및 압력, 화학적 조성 변화에 따른 에너지 손실 값을 얻었다. 이를 통해 공정별 에너지 효율에 대해 분석을 수행하였으며 에너지 손실량 대비 메탄올 생산량의 값을 통해 메탄올 생산의 최적 조건을 찾고자하였다.
2.3 공정 모사 조건
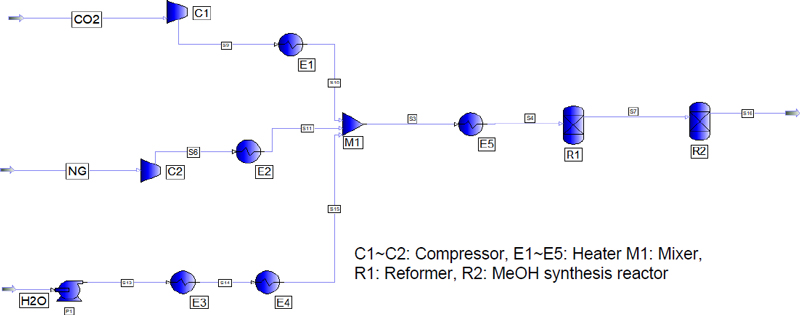
천연가스를 개질하는 스팀 개질 공정에 포집된 CO2를 추가하여 SCR 반응을 통해 합성가스를 생산하고 합성가스로부터 메탄올 합성을 Fig. 2과 같이 모사하였다. 개질 반응기 850℃, 20 bar의 조건에서 포집된 CO2 50 ton/day, 천연가스 30 ton/day, 스팀 32 ton/day를 반응시키고 합성가스로부터 메탄올 합성에 적합한 합성가스 비를 얻고자 Table 1와 같이 메탄과 스팀의 비(steam/CH4)를 0.47-1.65로 조절하여 최적화를 위한 시뮬레이션을 수행하였다. 메탄올 합성 반응기는 20 bar에서 메탄올 생산의 최적 조건을 찾기 위해 150-300℃의 온도 범위에서 시뮬레이션을 수행하였다.
3. 연구 결과
3.1 합성가스 제조
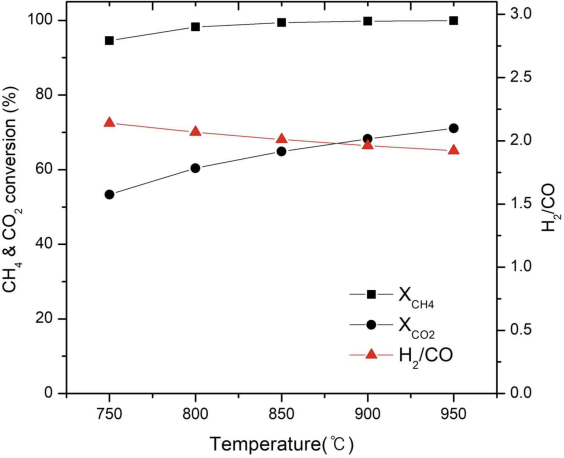
포집된 CO2 50 ton/day와 CH4 30 ton/day와 H2O 32 ton/day (CH4/CO2/H2O 비는 1/0.61/0.95)의 SCR반응에 대해 20 bar의 조건에서 반응 온도를 700-950℃의 범위에서 공정 모사한 결과를 Fig. 3에 나타냈다. 온도가 높아질수록 CH4/CO2 전환율은 증가하였으며 CH4 전환율은 850℃ 이상에서 100%에 수렴한다. SCR 반응에서 주요 반응 중 CH4의 수증기 개질반응과 CH4의 CO2 개질 반응은 흡열 반응으로 온도가 높아질수록 정반응으로 평형 이동에 유리하다12). 850℃ 이상의 온도가 100%에 가까운 CH4/CO2 전환율을 얻을 수 있어서 반응에 적합함을 확인하였다. 반응 온도에 따른 합성가스 비(H2/CO)의 경우 온도가 높을수록 감소하였으나 합성가스 비에는 거의 영향을 미치지 않았다. Boudouard 반응인 carbon 침적이 활발히 일어나는 700℃에서는 SCR 반응에 적절하지 않다13,14). CH4/CO2 전환율이 높으면서 합성가스(H2/CO) 비가 화학양론적 비 2.0 이상으로 생산되는 850℃가 메탄올을 합성하는 데 적합한 온도로 사료된다. 850℃, 20 bar 조건에서 수행한 공정 모사로부터 합성가스의 비(H2/CO)가 1.75로 나타났기 때문에 합성가스 비가 2.0 부근으로 나오게 하기 위해서는 개질 공정 시 스팀을 추가하여 합성가스를 생산해야 한다.
3.2 메탄올 합성 시 반응 온도의 영향
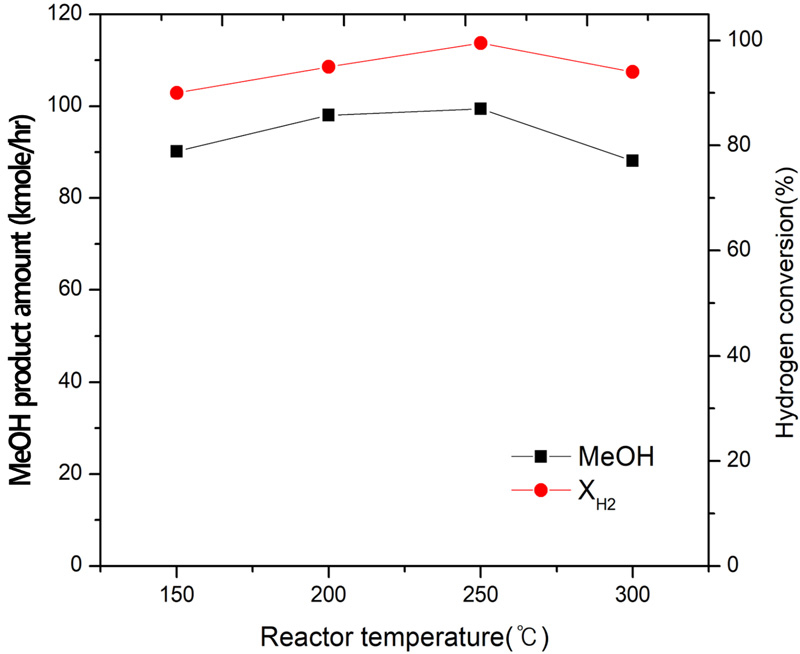
CO2 50 ton/day, CH4 30 ton/day, H2O 32 ton/day의 SCR 반응으로부터 얻은 합성가스의 비(H2/CO) 1.75일 때 반응 온도 150, 200, 250, 300℃에서 메탄올 합성에 대한 공정 모사한 결과를 Fig. 4에 나타냈다. 반응 온도가 증가하면서 H2의 전환율과 메탄올 생산량이 증가하다가 300℃ 이상에서 감소하는 경향이 나타나서 메탄올 합성 온도는 250℃가 적합한 것으로 사료된다15,16). 250℃의 온도에서 수소의 전환율은 100%에 가까운 값을 나타내며 메탄올의 생산량은 94.4 kmol/h인 것으로 분석되었다.
3.3 합성가스 비(H2/CO)에 따른 메탄올 합성
앞서 언급한 것처럼 현재의 조건에서는 화학양론적인 합성가스 비가 2.0보다 낮게 생산되기 때문에 합성가스 비 증가를 위해 물의 양에 따른 합성가스의 비와 메탄올 생산에 대한 영향을 분석하였다. 메탄올 합성 시 반응 조건을 250℃, 20 bar로 설정하고 CH4/CO2/H2O 비를 0.47-1.6로 변화시키며 공정 모사를 수행하였다. 물 양의 변화에 따른 합성가스의 비는 Table 2에 나타냈으며 물의 양이 증가함에 따라 수소의 양이 증가하여 합성가스의 비는 증가하였다.
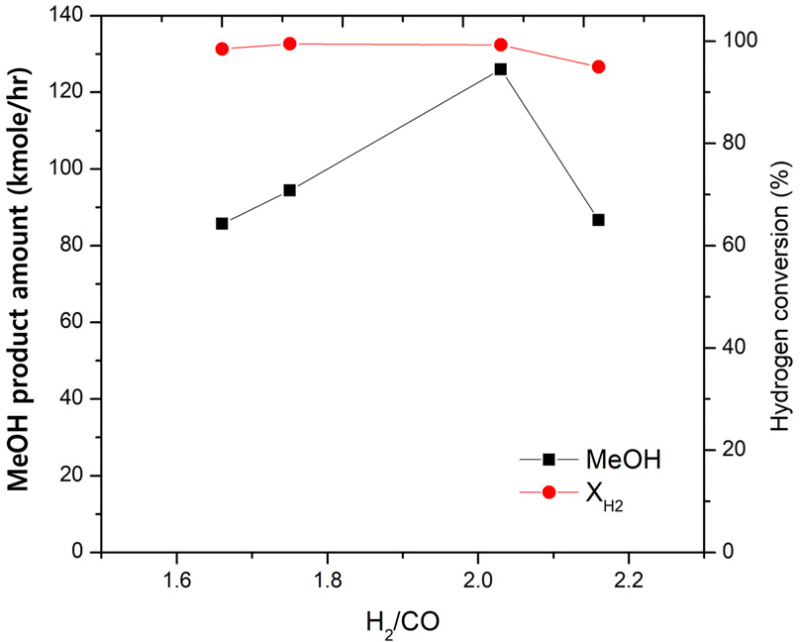
물 양의 변화에 의한 합성가스 비에 따른 메탄올 생산량과 수소 전환율을 Fig. 5에 나타냈다. 그림에서 보는 바와 같이 H2/CO 비가 증가함에 따라 메탄올 생산량이 증가하다 H2/CO 비가 2.03 이상이 되면 급격히 감소하였으며 메탄올 생산량은 H2/CO 비가 2.03에서 126 kmol/hr로 가장 많이 생산되었다. 수소 전환율의 경우 합성가스 비 증가에도 큰 차이가 나지 않았으나 2.03 이후 감소하는 경향을 나타냈다. 메탄올 합성을 위한 합성가스의 화학양론적 비인 2.0보다 높은 조건은 수소 양 대비 합성에 필요한 CO의 양이 감소함에 따라 평형 전환율이 낮아지고 수소 전환율과 메탄올 생산량이 감소하는 것으로 사료된다. 따라서 물의 양을 증가시킨 CH4/H2O의 비 1.4 (합성가스의 비, 2.03)에서 메탄올을 생산하는 것이 적합한 조건으로 판단된다.
3.4 엑서지 관점에서의 반응 분석
합성가스 생산 시 엑서지 손실 값과 메탄올 합성 시의 엑서지 손실 값을 각각 구하고 엑서지 손실량 대비 수소와 메탄올 생산량으로부터 가장 좋은 생산조건을 찾았다. CH4 100 kmol 기준으로 Table 2에서 볼 수 있듯이 가장 좋은 생산 조건으로 판단되는 CH4/CO2/H2O의 비율을 1/0.65/0.95과 1/0.65/1.4에서 공정 모사한 결과와 이로부터 구한 합성가스 비 1.75와 2.03 조건에서의 공정 모사한 결과를 Table 3에 각각 나타냈다.
엑서지 관점에서는 반응기에 투입되는 물의 양이 증가하면 엑서지 손실률이 커질 수 있지만 수소의 생산량이 높고 CH4/CO2/H2O=1/0.65/1.4의 조건에서 낮은 엑서지 손실률을 나타났다. 또한 얻고자 하는 수소의 양이 수증기 1.4의 비율에서 높으므로 엑서지 손실률 역시 작아졌다. 따라서 엑서지 손실률로부터 앞에서의 최적 조건과 같이 2.03의 H2/CO를 얻을 수 있는 CH4/CO2/H2O=1/0.65/1.4의 조건이 엑서지 손실률이 작아 최적 조건으로 사료된다.
4. 결 론
배출되는 CO2의 저탄소연료 전환을 위한 메탄올 생산 공정에 대한 시뮬레이션 및 엑서지 분석으로부터 얻은 결론은 다음과 같다.
1) 포집된 CO2를 활용하여 합성가스 생산 시 CH4전환율과 CO2 전환율이 높으면서 합성가스(H2/CO) 비가 2.0 이상인 850℃가 최적 조건으로 사료되며 CO2를 활용한 개질 반응의 경우 탄소의 수가 증가로 인해 합성가스의 비가 낮아지기 때문에 물의 양을 증가시켜 수소의 양을 증가시키는 것이 필요하다.
2) 합성가스로부터 메탄올 합성 반응에서 250℃의 온도에서 H2 전환율은 거의 100%로 나타났으며 메탄올의 생산량은 94.4 kmol/h였다. 250℃ 이상에서는 평형 전환율이 낮아지기 때문에 250℃가 최적 온도로 사료된다.
3) 메탄올 합성 반응에서는 CH4와 H2O 비가 1:0.95보다 1:1.4에서 높은 메탄올 생산량을 나타냈으며 이는 합성가스 비율이 화학양론적 비 2.0 부근이기 때문인 것으로 판단된다.
4) 엑서지 관점에서 CH4/CO2/H2O=1/0.65/1.4의 조건에서 합성가스 반응 시 엑서지 손실은 11,524 kJ/kmol이며 메탄올 반응 시 엑서지 손실은 5,484 kJ/kmol로 각각의 수소 생산량과 메탄올 생산량 당 엑서지 손실률은 각각 0.45와 0.43로 나타났다. 또한 CH4/CO2/H2O=1/0.65/0.95의 조건에 비해 수소 생산량과 메탄올 생산량이 많기 때문에 CO2 개질로부터 메탄올 합성까지 가장 적합한 공정 조건으로 사료된다.
Acknowledgments
본 연구는 산업통상자원부 신산업진출 사업재편 핵심기술개발사업(P0020504)과 산업통상자원부 에너지수요관리 핵심기술개발사업(20212010200100)의 일환으로 수행되었습니다.
References
- S. Jeong, “The cement industry will also contribute to ‘2050 net-zero’”, Technology & Innovation, Vol. 448, 2021, pp. 50-53. Retrieved from http://203.234.181.180/webzine/202107.pdf, .
- A. Buljan, “Danish consortium accelerates offshore wind-powered clean fuel project, eyes green jet fuel production by 2025”, OffshoreWIND.biz, 2022. Retrieved from https://www.offshorewind.biz/2022/02/04/danish-consortium-accelerates-offshore-wind-powered-clean-fuel-project-eyes-green-jet-fuel-production-by-2025/, .
-
M. Prasanna, N. Logeshwaran, S. Ramakrishnan, and D. J. Yoo, “Metallic 1T-N-WS2/WO3 heterojunctions featuring interface-engineered Cu-S configuration for selective electr ochemical CO2 reduction reaction”, Nano Micro Small, Vol. 20, No. 4, 2024, pp. 2306165.
[https://doi.org/10.1002/smll.202306165]

-
J. Kim, Y. Yoo, M. Seo, J. Baek, and S. Kim, “Performance analysis of adiabatic reactor in thermochemical carbon dioxide methanation process for carbon neutral methane production”, Journal of Hydrogen and New Energy, Vol. 34, No. 3, 2023, pp. 316-326.
[https://doi.org/10.7316/JHNE.2023.34.3.316]

-
A. Nemmour, A. Inayat, I. Janajreh, and C. Ghenai, “Green hydrogen-based E-fuels (E-methane, E-methanol, E-ammonia) to support clean energy transition: a literature review”, International Journal of Hydrogen Energy, Vol. 48, No. 75, 2023, pp. 29011-29033.
[https://doi.org/10.1016/j.ijhydene.2023.03.240]

-
A. Ullah, N. A. Hashim, M. F. Rabuni, and M. U. M. Junaidi, “A review on methanol as a clean energy carrier: roles of zeolite in improving production efficiency”, Energies, Vol. 16, No. 3, 2023, pp. 1482.
[https://doi.org/10.3390/en16031482]

-
M. Minutillo and A. Perna, “A novel approach for treatment of CO2 from fossil fired power plants, part A: the integrated systems ITRPP”, International Journal of Hydrogen Energy, Vol. 34, No. 9, 2009, pp. 4014-4020.
[https://doi.org/10.1016/j.ijhydene.2009.02.069]

-
W. Cho, T. Song, A. Mitsos, J. T. McKinnon, G. H. Ko, J. E. Tolsma, D. Denholm, and T. Park, “Optimal design and operation of a natural gas tri-reforming reactor for DME synthesis”, Catalysis Today, Vol. 139, No. 4, 2009, pp. 261-267.
[https://doi.org/10.1016/j.cattod.2008.04.051]

-
Y. Zhang, J. Cruz, S. Zhang, H. H. Lou, and T. J. Benson, “Process simulation and optimization of methanol production coupled to tri-reforming process”, International Journal of Hydrogen Energy, Vol. 38, No. 31, 2013, pp. 13617-13630.
[https://doi.org/10.1016/j.ijhydene.2013.08.009]

-
L. Yang and X. Ge, “Chapter three - biogas and syngas upgrading”, Advances in Bioenergy, Vol. 1, 2016, pp. 125-188.
[https://doi.org/10.1016/bs.aibe.2016.09.003]

-
G. Liu, H. Hagelin-Weaver, and B. Welt, “A concise review of catalytic synthesis of methanol from synthesis gas”, Waste, Vol. 1, No. 1, 2023, pp. 228-248.
[https://doi.org/10.3390/waste1010015]

-
A. Arman, F. Y. Hagos, A. A. Abdullah, R. Mamat, A. R. A. Aziz, and C. K. Cheng, “Syngas production through steam and CO2 reforming of methane over Ni-based catalyst-a review”, IOP Conference Series: Materials Science and Engineering, Vol. 736, 2020, pp. 042032.
[https://doi.org/10.1088/1757-899X/736/4/042032]

-
A. Di Giuliano and K. Gallucci, “Sorption enhanced steam methane reforming based on nickel and calcium looping: a review”, Chemical Engineering and Processing - Process Intensification, Vol. 130, 2018, pp. 240-252.
[https://doi.org/10.1016/j.cep.2018.06.021]

-
Y. Sun, T. Ritchie, S. S. Hla, S. McEvoy, W. Stein, and J. H. Edwards, “Thermodynamic analysis of mixed and dry reforming of methane for solar thermal applications”, Journal of Natural Gas Chemistry, Vol. 20, No. 6, 2011, pp. 568-576.
[https://doi.org/10.1016/S1003-9953(10)60235-6]

-
S. C. Marie-Rose, A. L. Perinet, and J. M. Lavoie, “Conversion of non-homogeneous biomass to ultraclean syngas and catalytic conversion to ethanol”, Biofuel's Engineering Process Technology, 2011.
[https://doi.org/10.5772/20032]

-
J. Q. Zeng, N. Tsubaki, and K. Fujimoto, “The promoting effect of alcohols in a new process of low-temperature synthesis of methanol from CO/CO2/H2”, Fuel, Vol. 81, No. 1, 2002, pp. 125-127.
[https://doi.org/10.1016/S0016-2361(01)00123-5]