46-3Q 촉매 상에서 폐플라스틱의 열분해 오일로부터 수소 제조
2023 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
Pyrolysis oil (C5-C20) produced using plastic non-oxidative pyrolysis technology produces naphtha oil (C5-C10) through a separation process, and naphtha oil produces hydrogen through a reforming reaction to secure economic efficiency and social and environmental benefits. In this study, waste plastic pyrolysis oil was subjected to a steam reforming reaction on a commercialized catalyst of 46-3Q And it was found that the 46-3Q catalyst reformed the pyrolysis oil to produce hydrogen. Therefore, an experiment was performed to increase hydrogen yield and minimize the byproduct of ethylene. The reaction experiment was performed using actual waste plastic oil (C8-C11) with temperature, steam/carbon ratio (S/C) ratio, and space velocity as variables. We studied reaction conditions that can maximize hydrogen yield and minimize ethylene byproducts.
Keywords:
Waste plastic, Pyrolysis oil, Hydrogen, Steam reforming, 46-3Q catalyst키워드:
폐플라스틱, 열분해 오일, 수소, 수증기 개질, 46-3Q 촉매1. 서 론
전 세계적으로 버려지는 플라스틱 폐기물은 2000년 1억 5,600만 톤에서 2019년 3억 5,300만 톤으로 두 배 이상 증가되었다. 버려진 폐플라스틱 물질들은 미세 플라스틱으로 나눠져 대기, 식품 등으로 이동하여 생물의 몸속에 잔류하고, 이는 새로운 문제로 대두되고 있다. 또한 플라스틱은 상당한 탄소 발자국을 가지고 있어 플라스틱이 분해되기까지 수명 주기 전체에 걸쳐 전 세계 온실가스 배출량의 3.4%를 차지하고 있다. 2019년 기준 플라스틱은 18억 톤의 온실가스를 배출했으며, 그중 90%는 화석연료를 통한 생산 과정에서 발생하였다1). 2022년 대한민국의 이산화탄소 농도는 현재 425 ppm을 기록했으며 2021년 대비 1.9 ppm 증가한 수치를 보이고 있다2). 전 세계의 평균 이산화탄소 농도도 417.1 ppm을 기록하면서 전년도보다 2.2 ppm 증가하였다. 이산화탄소를 포함한 온실가스는 주로 에너지 산업에서 주로 배출되며 제조업, 발전, 수송 부문을 중심으로 생산량 및 연료 소비의 증가로 2020년보다 3.6%가 상승하여 전체 온실가스 배출량의 86.9% 비율을 차지하고 있다3).
이런 상황에서 국내에서는 2021년에만 총 1,193만 2천 톤의 플라스틱 폐기물이 발생한 것으로 보고되어 있고, 이는 2017년 기준 약 400만 톤 증가한 수준이다4). 따라서 정부는 증가하는 온실가스의 양을 감축하기 위해 2050 탄소중립을 선언하였고 그와 함께 신에너지인 수소에너지에 대한 관심이 증가하면서 폐자원으로부터 수소를 추출하는 기술이 주목을 받고 있다. 폐플라스틱을 저산소 혹은 무산소 분위기에서 500-1,000℃의 고온에서 가열하여 열분해 오일을 얻는 열분해 기술을 통해 탄소 수 C5-C20의 열분해 오일을 얻게 되면 분리 공정을 통해 C5-C10의 납사유를 생산할 수 있다. 이렇게 생산된 납사유를 촉매 개질 반응으로 수소를 생산해 낼 수 있다. 이렇게 버려지는 폐자원을 이용하여 에너지를 생산함으로써 새로운 경제성을 확보할 수 있고 대기 중으로 배출되는 온실가스를 저감하여 2050 탄소중립에 기여할 수 있다.
현재는 플라즈마를 이용하여 폐플라스틱을 열분해하고 개질하는 방안도 연구되고 있다. 해외의 연구에서는 플라스마-촉매 반응기를 이용하여 생성된 플라즈마로 촉매의 표면에서 반응시켜 강한 플라즈마-촉매 상호작용을 유도함으로써 열분해 탄화수소와 촉매 사이의 반응을 향상시키며 폐플라스틱의 탄화수소를 250℃ 이하의 저온에서 개질하여 수소를 얻는 기술이 연구되고 있다. 이는 800℃ 이하 온도에서 작동하는 기존의 열촉매 탄화수소 개질에 비해 낮은 에너지를 투입으로 수소를 개질하는 방법으로 에너지 투입량이 적다는 장점을 가지고 있다5,6).
개질 반응을 위한 귀금속 촉매(Ru, Rh, Pd 등)는 활성화 및 탄소 침적에 대한 저항성이 높지만 그에 따라 비용도 높아진다. Ni을 활성화 물질로 사용하는 촉매는 귀금속 촉매와 유사한 활성을 나타내며, 탄소로 인한 비활성화가 일부 나타날 수 있지만7) 탄화수소의 steam reforming 반응에 적합한 금속이며8,9), 귀금속에 비해 저렴하기에 개질 반응에 많이 사용된다10,11). 그리고 조촉매인 MgO 성분으로 촉매의 분산도와 Ni 근처의 산성도를 향상시키므로 촉매 표면의 탄소 침착 방지로 인해 촉매 비활성을 억제할 수 있다12,13).
본 연구는 46-3Q 촉매(Johnson Matthey, London, UK) 상에서 폐플라스틱 열분해 오일을 개질 반응할 때 반응 조건인 온도, steam to carbon (S/C) 비율, 공간속도를 변화시키며 반응 시험을 하여 수소 수율의 최적 조건을 찾고, 이러한 최적 조건에서의 촉매 내구성 시험을 실시하였다. 또한 다양한 조건에서의 반응으로부터 얻은 촉매의 물리화학적 특성 분석도 병행하여 실시하였다.
2. 개질 반응 장치 및 방법
2.1 실험 장치
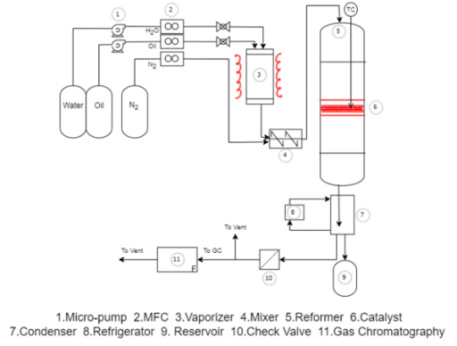
실험 장치는 Fig. 1과 같이 구성되어 있으며, refomer로 들어가기 전 물과 오일의 양을 미세하게 조절하기 위한 micro-pump와 유량을 제어하기 위한 mass flow controller (MFC), 혼합물을 기화시켜 주는 vaporizer와 기화된 기체들을 섞어주는 mixer로 이루어져 있다. 이후 혼합물을 원하는 온도에서 반응시키기 위한 reformer와 온도센서(thermocouple), 반응 촉매가 반응기 내부에 포함되며, 촉매와 반응한 후 반응가스에 포함된 수분을 제거하기 위한 condenser와 refrigerator, 제거된 수분을 저장하는 reservoir, 반응가스의 역류를 방지하는 check valve, 반응가스를 분석하는 gas chromatography (GC)로 구성된다.
Steam reforming 반응 장치에서 촉매 반응 실험을 진행하기 위해 히터를 통해 반응기를 원하는 온도까지 가열시킨다. 오일과 물을 마이크로 펌프로 원하는 유량을 혼합기 내로 주입하여 기화시킨 후 반응기 내 촉매와 반응하여 생성된 가스는 냉각 장치에서 수분을 제거한 후 분석기인 gas chromatography로 분석한다. 촉매 반응기 내 하단에 메시(mesh) 망과 석영 wool을 깔아준 후 약 1 g 촉매를 채운 후 촉매 층 내에 k-type 센서를 설치하여 온도를 측정하였다. 액체 오일과 물의 반응물은 마이크로 펌프에 의해 정량적으로 vaporizer에 공급되고, 기화되어 혼합된 반응물을 반응기에 주입하였다. 반응 후 나온 반응가스에서 미반응물과 물을 cold trap (약 2℃)에 의해 제거한 후 가스분석기에서 분석한다. 반응의 생성물들은 분석 기기인 YL Instrument 6500 (YoungIn Chromass, Anyang, Korea) system으로 분석하였으며, 분석에 사용된 칼럼은 반응가스 분석에 metal packed GC column (13052-U; Sigma-Aldrich, St. Louis, MO, USA)과 molecular sieve adsorbent (matrix Molecular Sieve 13X; Sigma-Aldrich)를 사용하여 수소, 메탄, 일산화탄소는 thermal conductivity detector (TCD)로 분석하였으며, 이산화탄소는 flame ionization detector (FID)로 분석하였다. GC oven의 온도는 35℃에서 0-6분간 유지한 후 15℃/min의 승온 속도로 약 170℃까지 올리면서 분석했다. FID는 수소 35 mL/min, 산소 300 mL/min을 주입하여 온도 250℃에서 분석하였으며, TCD는 수소 35 mL/min, Ar 20 mL/min을 주입하여 150℃에서 분석하였다. 액체 오일의 미반응물은 GS-CarbonPLOT의 capillary column (30 m; Agilent, Santa Clara, CA, USA)을 사용하여 분석하였다.
2.2 실험에 사용된 열분해 오일
실험에 사용된 반응 오일은 플라스틱의 열분해하여 120-160℃에서 증류한 오일을 사용하였으며, 성분은 Table 1에 정리한 바와 같이 C8-C11이다.
3. 촉매 특성
3.1 촉매의 물리화학적 특성
촉매의 물리화학적 특성을 분석하기 위하여 Brunauer-Emmett-Teller (BET)와 scanning electron microscope (SEM)-energy dispersive spectrometer (EDS), thermogravimetric analysis (TGA), X-ray diffraction (XRD)을 활용하였고, 결과를 Fig. 2와 Table 3에 정리하였다. BET 분석 결과 spent 촉매는 fresh 촉매보다 비표면적이 약 50% 감소하였음을 확인하였다.
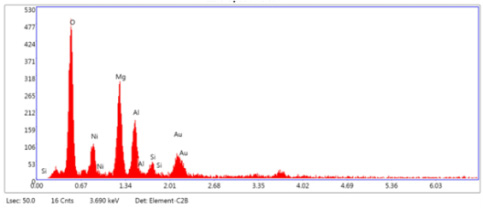
촉매의 표면 미세구조 및 화학 성분을 파악하기 위해 SEM-EDS로 분석한 결과를 Fig. 3과 Table 4에 나타내었으며 O, Ni, Mg, Al, K, Ca의 물질로 구성되어 있음을 확인하였다.
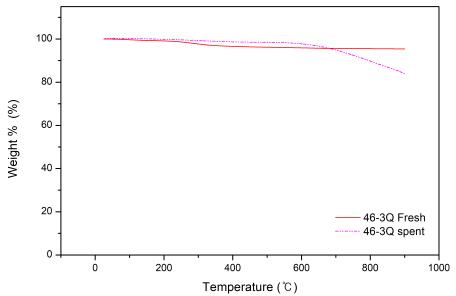
카본 형성으로 인한 촉매의 비표면적 감소를 확인하기 위하여 TGA 열분석 기기를 이용하여 촉매의 반응 전후 질량 변화의 결과를 Fig. 4에 나타냈다. 촉매의 경우 fresh 촉매 상태에서는 온도가 상승함에 따라 완만한 질량의 감소를 보였으나 spent 촉매의 경우 600℃ 부근에서 비교적 큰 질량 감소가 일어났다. Spent 촉매는 200시간의 실험 동안 침적된 탄소가 산화 분위기에서 휘발되어 질량 감소가 일어난 것으로 보인다14).
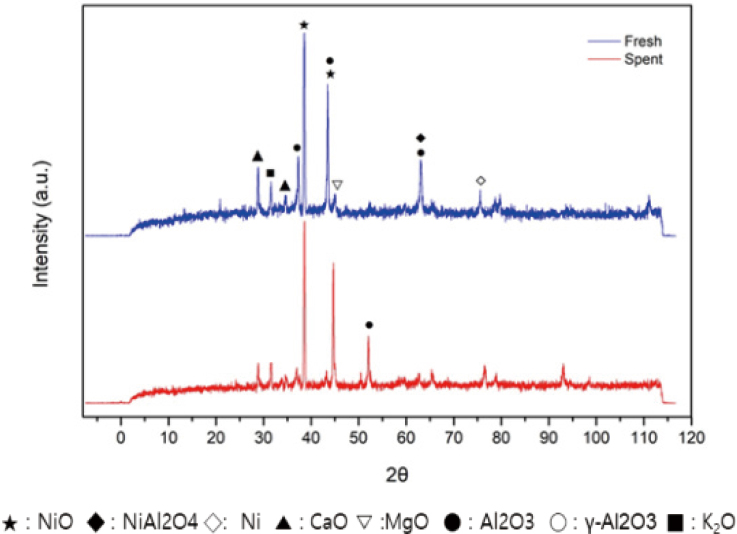
촉매의 결정구조를 파악하기 위해 XRD 분석 기기로 촉매의 전후 화학적 조성을 분석한 결과를 Fig. 5와 같이 나타내었다. Spent 촉매는 사용 전 fresh 촉매에서 분석되었던 CaO와 K2O의 피크 값이 감소하였고 MgO와 Al2O3 피크 값도 감소하였다. 반면에 2θ의 값이 약 53°일 때 Al2O3의 피크가 크게 검출 되었다. 반응 전후의 변화는 크게 나타나지 않아 200시간의 장기간 촉매 사용 후에도 원자의 구조 및 요소가 균일하게 유지되는 것을 확인할 수 있었다.
4. 결과 및 분석
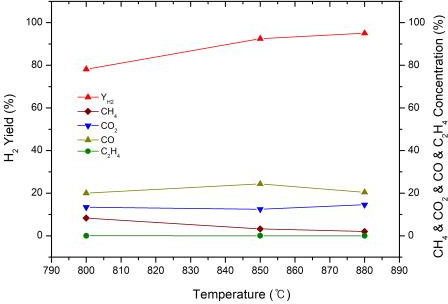
4.1 온도의 영향
반응 온도에 따라 수소 수율에 미치는 영향을 확인하기 위해서 공간속도 7,000/hr, S/C 비율 3.5의 조건으로 온도를 800℃, 850℃, 880℃에서 반응하여 그 결과를 Fig. 6에 나타냈다. 그림에서 보는 바와 같이 온도가 증가함에 따라 수소 수율이 증가하였다. 이는 탄화수소의 개질 반응은 높은 흡열 반응으로 온도가 높을수록 활성이 높아지고 H2O와 CO2로부터 탄화수소의 분해가 더 유리하기 때문으로 사료된다15). 또한 온도가 800℃에서 850℃까지 상승한 수소 수율이 850℃에서 880℃로 상승한 수소 수율보다 상승폭이 더욱 크다. 따라서 850℃ 이상의 반응 온도가 필요하다.
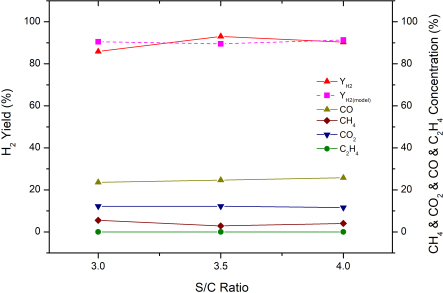
4.2 S/C 비율의 영향
S/C 비율에 따라 수소 수율에 미치는 영향을 확인하기 위하여 공간속도 7,000/hr, 온도 850℃의 조건에서 S/C 비율을 3.0, 3.5, 4.0으로 하여 나타난 결과를 Fig. 7에 나타냈다. 개질 반응 결과, S/C 비율 3.5에서 가장 높은 수소 수율을 나타냈으며, S/C 비율이 4.0일 때 수소 수율은 소폭 감소하였다. 이는 촉매의 표면에서 스팀의 흡착 포화로 인해 촉매의 활성화를 감소시켰을 수 있고16) 과도하게 스팀의 비율을 높이게 되면 수분이 열의 흡수를 유발하여 추가적인 에너지의 소비를 유발하였기 때문이라고 사료된다17-19).
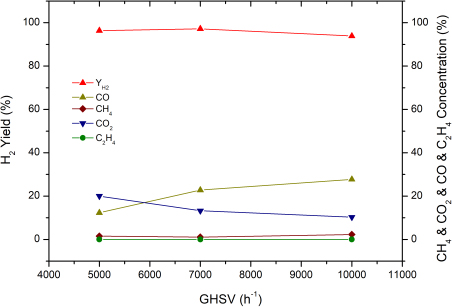
4.3 공간속도의 영향
공간속도의 변화가 수소 수율에 미치는 영향을 확인하기 위해 S/C 비율 3.5, 온도 850℃의 조건에서 공간속도가 5,000-10,000/hr 변화에 따른 수소 수율의 변화를 Fig. 8에 나타냈다. 그림에서 보듯이 공간속도 5,000/hr에 비해 7,000/hr일 때 수소 수율이 약 0.9%로 미세하게 증가하였다. 공간속도가 증가할수록 수소 수율이 감소하는 것은 촉매 단위 부피당 통과하는 반응물의 양이 증가함이 원인으로 일반적인 경향으로 나타나지만, 본 실험은 촉매와의 반응 속도에 비해 물질 전달 속도인 공간속도가 낮은 경우에는 공간속도가 증가함에 따라 전환율이 약간 증가하다가 감소하는 경향을 나타내는 변곡점으로 사료된다. 따라서 가장 최적의 반응 조건은 앞서 설명했던 S/C 비율 3.5, 온도 850℃ 이상, 공간속도 7,000/hr 조건이라고 할 수 있다.
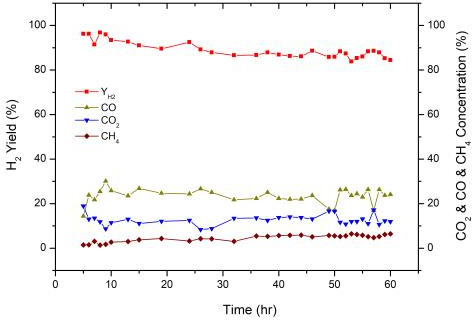
4.4 내구성 시험
촉매의 내구성 시험은 반응 조건 최적화 실험 결과에 따라 반응 온도 850℃, S/C 3.5, 공간속도 7,000/hr에서 약 60시간 동안 수행하여 Fig. 9에 나타냈다. 실제 열분해 오일의 경우 초기에는 95%의 수소 수율을 유지하였으나 점점 수율이 감소하여 30시간 이후로는 수소 수율이 84-88%로 일정한 활성을 유지하였다. 촉매의 활성이 감소한 원인은 TGA 분석 결과 spent 촉매에 침적된 탄소들로 인해 촉매의 활성이 저해되었기 때문으로 사료된다. 따라서 촉매는 내구성을 지니고 있으나 카본 생성으로 인한 활성도 저해를 방지할 수 있는 수단을 고려해야 한다.
5. 결 론
본 연구에서는 46-3Q 촉매를 이용하여 수소 수율을 가장 높일 수 있는 조건에서 실험하여 비교 분석한 결과로 다음과 같은 결론을 얻었다.
1) 실제 열분해 오일은 반응 온도가 800℃ 이상 증가할수록 수소 수율이 상승하는 것을 발견할 수 있으며, 이는 탄화수소의 개질 반응인 흡열 반응이 높은 온도에서 유리하기 때문으로 사료된다.
2) 실제 열분해 오일은 S/C 비율 3.5 이상의 조건에서 높은 수소 수율을 유지했으며, S/C 비율 4.0에서 수소 수율이 감소한 원인은 스팀의 흡착 포화로 인해 촉매의 활성화 감소하였기 때문으로 사료된다.
3) 실제 열분해 오일은 공간속도가 5,000/hr 이후 수소 수율이 감소하는 경향을 보였으며, 이는 촉매 단위 부피당 통과하는 반응물의 양이 증가하여 수소 수율이 감소하는 일반적인 경향으로 보인다. 그러나 공간속도 5,000-7000/hr에서의 수소 수율 차이가 크지 않다. 따라서 공간속도 7,000/hr이 좋은 조건으로 사료된다.
4) 실제 열분해 오일로 촉매의 내구성을 테스트한 결과 초기 95%의 수소 수율에서 84%로 수소 수율 감소를 확인하였고, TGA 분석 결과 spent 촉매에 침적된 탄소들로 인해 촉매의 활성이 저해되었다고 사료된다. 따라서 촉매는 내구성을 지니고 있으나 카본 생성으로 인한 활성도 저해를 방지할 수 있는 수단을 고려해야 한다.
5) 실제 열분해 오일을 촉매와 반응시켜 가장 높은 수소 수율을 얻는 최적 조건은 850℃ 이상의 온도, 공간속도 7,000/hr, S/C 비율 3.5로 사료된다.
Acknowledgments
본 연구는 산업통상자원부 산하 에너지기술평가원의 신재생에너지 핵심기술개발사업(1415174714)의 지원을 받아 수행되었습니다.
References
- J. Jo, D. Shin, and Y. Kim, “Pyrolysis of plastic waste: current status and policy tasks”, Korea Environment Institute, 2022. Retrieved from https://www.kei.re.kr/elibList.es?mid=a10101000000&elibName=researchreport&class_id=&act=view&c_id=741916, .
-
OECE, “Global plastic outlook”, OECD, 2022. Retrieved from
[https://doi.org/10.1787/de747aef-en]

- S. Y. Lee, “Last year, the concentration of carbon dioxide on the Korean Peninsula reached a record high”, Dong-A Science, 2023. Retrieved from https://m.dongascience.com/news.php?idx=60481, .
- Ministry of Environment Greenhouse Gas Inventory & Research Center of Korea, “2021 national greenhouse gas provisional emissions”, Data.go.kr, 2022. Retrived from https://www.data.go.kr/data/15049589/fileData.do, .
- Greenpeace, “Disposable plastic waste during COVID, largest increase ever”, Greenpeace, 2023. Retrieved from https://www.greenpeace.org/korea/press/25876/%EB%B3%B4%EB%8F%84%EC%9E%90%EB%A3%8C-%EC%BD%94%EB%A1%9C%EB%82%98-%EA%B8%B0%EA%B0%84-%EC%9D%BC%ED%9A%8C%EC%9A%A9-%ED%94%8C%EB%9D%BC%EC%8A%A4%ED%8B%B1-%ED%8F%90%EA%B8%B0%EB%AC%BC-presslease-plastic-repo/, .
-
K. Xiao, X. Li, J. Santoso, H. Wang, K. Zhang, J. Wu, and D. Zhang, “Synergistic effect of dielectric barrier discharge plasma and Mn catalyst on CO2 reforming of toluene”, Fuel, Vol. 285, 2021, pp. 119057.
[https://doi.org/10.1016/j.fuel.2020.119057]

-
I. Aminu, M. A. Nahil, and P. T. Williams, “Pyrolysis-plasma/catalytic reforming of post-consumer waste plastics for hydrogen production”, Catalysis Today, Vol. 420, 2023, pp. 114084.
[https://doi.org/10.1016/j.cattod.2023.114084]

-
J. R. Rostrupnielsen and J. H. B. Hansen, “CO2-reforming of methane over transition metals”, Journal of Catalysis, Vol. 144, No. 1, 1993, pp. 38-49.
[https://doi.org/10.1006/jcat.1993.1312]

-
S. Freni, S. Cavallaro, N. Mondello, L. Spadaro, and F. Frusteri, “Production of hydrogen for MC fuel cell by steam reforming of ethanol over MgO supported Ni and Co catalysts”, Catalysis Communications, Vol. 4, No. 6, 2003, pp. 259-268.
[https://doi.org/10.1016/S1566-7367(03)00051-7]

-
F. Frusteri, S. Freni, V. Chiodo, L. Spadaro, O. D. Blasi, G. Bonura, and S. Cavallaro, “Steam reforming of bio-ethanol on alkali-doped Ni/MgO catalysts: hydrogen production for MC fuel cell”, Applied Catalysis A: General, Vol. 270, No. 1-2, 2004, pp. 1-7.
[https://doi.org/10.1016/j.apcata.2004.03.052]

-
M. García-Diéguez, I. S. Pieta, M. C. Herrera, M. A. Larrubia, and L. J. Alemany, “Nanostructured Pt- and Ni-based catalysts for CO2-reforming of methane”, Journal of Catalysis, Vol. 270, No. 1, 2010, pp. 136-145.
[https://doi.org/10.1016/j.jcat.2009.12.010]

-
R. R. Davda, J. W. Shabaker, G. W. Huber, R. D. Cortright, and J. A. Dumesic, “A review of catalytic issues and process conditions for renewable hydrogen and alkanes by aqueous-phase reforming of oxygenated hydrocarbons over supported metal catalysts”, Applied Catalysis B: Environmental, Vol. 56, No. 1-2, 2005, pp. 171-186.
[https://doi.org/10.1016/j.apcatb.2004.04.027]

-
A. S. Al-Fatesh, Y. Arafat, H. Atia, A. A. Ibrahim, Q. L. M. Ha, M. Schneider, M. M-Pohl, and A. H. Fakeeha, “CO2-reforming of methane to produce syngas over Co-Ni/SBA-15 catalyst: effect of support modifiers (Mg, La and Sc) on catalytic stability”, Journal of CO2 Utilization, Vol. 21, 2017, pp. 395-404.
[https://doi.org/10.1016/j.jcou.2017.08.001]

-
X. Feng, J. Feng, and W. Li, “Insight into MgO promoter with low concentration for the carbon-deposition resistance of Ni-based catalysts in the CO2 reforming of CH4”, Chinese Journal of Catalysis, Vol. 39, No. 1, 2018, pp. 88-98.
[https://doi.org/10.1016/S1872-2067(17)62928-0]

-
F. M. B. Kontchouo, Z. Gao, X. Xianglin, Y. Wang, Y. Sun, S. Zhang, and X. Hu, “Steam reforming of n-hexane and toluene: understanding impacts of structural difference of aliphatic and aromatic hydrocarbons on their coking behaviours”, Journal of Environmental Chemical Engineering, Vol. 9, No. 6, 2021, pp. 106383.
[https://doi.org/10.1016/j.jece.2021.106383]

-
M. Kong, Q. Yang, J. Fei, and X. Zheng, “Experimental study of Ni/MgO catalyst in carbon dioxide reforming of toluene, a model compound of tar from biomass gasification”, International Journal of Hydrogen Energy, Vol. 37, No. 18, 2012, pp. 13355-13364.
[https://doi.org/10.1016/j.ijhydene.2012.06.108]

-
D. Świerczyński, S. Libs, C. Courson, and A. Kiennemann, “Steam reforming of tar from a biomass gasification process over Ni/olivine catalyst using toluene as a model compound”, Applied Catalysis B: Environmental, Vol. 74, No. 3-4, 2007, pp. 211-222.
[https://doi.org/10.1016/j.apcatb.2007.01.017]

-
N. Gao, S. Liu, Y. Han, C. Xing, and A. Li, “Steam reforming of biomass tar for hydrogen production over NiO/ceramic foam catalyst”, International Journal of Hydrogen Energy, Vol. 40, No. 25, 2015, pp. 7983-7990.
[https://doi.org/10.1016/j.ijhydene.2015.04.050]

-
N. Gao, X. Wang, A. Li, C. Wu, and Z. Yin, “Hydrogen production from catalytic steam reforming of benzene as tar model compound of biomass gasification”, Fuel Processing Technology, Vol. 148, 2016, pp. 380-387.
[https://doi.org/10.1016/j.fuproc.2016.03.019]