암모니아 반응기의 분해 효율 최적화를 통한 암모니아 분해 및 수소 정제 공정 모델 연구
2023 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
In this study, a process model and optimization design direction for a hydrogen production plant through ammonia decomposition are presented. If the reactor decomposition rate is designed to approach 100%, the amount of catalyst increases and the devices that make up the entire system also have a large design capacity. However, if the characteristics of the hydrogen regeneration process are reflected in the design of the reactor, it becomes possible to satisfy the total flow rate of fuel gas with the discharged tail gas flow rate. Analyzing the plant process simulation results, it was confirmed that when an appropriate decomposition rate is maintained in the reactor, the phenomenon of excess or shortage of fuel gas disappears. In addition, it became possible to reduce the amount of catalyst required and design the optimized capacity of the relevant processes.
Keywords:
Green hydrogen, NH3 decomposition, PSA, Plant process modeling, Ammonia cracking reactor키워드:
그린수소, 암모니아 분해, 압력 흡착 방식, 플랜트 공정 모사, 암모니아 분해 반응기1. 서 론
화석연료에서 발생하는 탄소의 지속적인 배출로 기후 변화 및 지구 온난화가 더욱 더 가속화되고 있는 문제로 인하여 탄소 배출이 없는 에너지원의 개발 및 소비에 관심이 많아지고 있는 것이 현실이다. 수많은 연구가 진행되고 있는 분야로는 수소 에너지 분야를 들 수 있으며, 정부는 수소 경제 로드맵을 계획 및 수립하면서 수소 사회로의 원활한 전환을 위한 준비를 하고 있다1).
수소는 우주에서 가장 가벼운 원소이다. 다른 원소들과 비교하여 무게 및 부피 대비 에너지 저장량이 높아 태양 에너지를 저장할 수 있는 미래 에너지 저장 매체 및 운반 물질로서 중요성이 점점 더 높아지고 있다. 일본, 유럽, 호주, 사우디아라비아 등 여러 나라에서 재생 에너지의 저장 매체로 수소를 이용한 세계 재생 에너지 교역 시스템을 구축하려고 노력하고 있다2).
에너지 운반체로 많은 관심을 받고 있는 암모니아는 분자 구조에 탄소를 포함하지 않아 연소 과정에서 이산화탄소가 발생하지 않으며, 상온에서 압축하면 10 bar 이하에서 액화되어 저장과 수송이 용이하다는 장점이 있다3). 그러나 현재는 암모니아를 이용한 비료 생산을 위하여 전 세계 수소 생산량의 약 50%를 사용하고 있다4).
에너지 캐리어로서 암모니아의 장점은 생산과 공급 측면에서도 기존 암모니아 플랜트와 인프라를 활용할 수 있다는 것이다5).
수소의 수급 문제를 해결하기 위하여 해외로부터 수소를 수입하기 위한 여러 가지 방법을 고려하고 있으며, 그 방법으로는 액체 상태의 암모니아(NH3) 운송, 액체 유기 수소 운반체, 액체 수소, 압축 수소 배관 등의 방법이 고려되고 있다. 그중 액체 상태의 암모니아는 기존의 운송 시스템 및 공급 인프라를 활용할 수 있다는 장점을 가지고 있다. 암모니아는 단위 부피당 수소 저장 용량으로 계산하는 경우에 1 m3당 120 kg의 수소를 저장할 수 있어 액체 수소(60 kg·H2/m3) 대비 약 2배의 수소를 저장할 수 있다. 또한 운송과 저장이 용이하다는 장점과 높은 수소 저장 밀도를 가지고 있고, 탄소 배출이 없다. 따라서 암모니아는 수소 에너지 운반체 및 친환경 연료로서 활용도가 더욱더 증가할 것이다6,7).
암모니아 분자는 수소 원자 3개와 질소 원자 1개로 구성되어 있다. 암모니아를 분해하게 되면, 수소와 질소 기체만이 생산된다. 액체 상태의 암모니아는 부피 대비 수소 저장 밀도가 108 kg·H2/m3으로 한 번 운송하는데 기체 수소보다 약 2.5배, 액체 수소보다 약 1.5배 정도 많은 수소를 국내로 들여올 수 있다. 또한 액체 상태의 암모니아는 대부분 비료나 화학물질을 제조하는데 필요한 원료로 연간 140만 톤 이상 국내에 수입하고 있기 때문에, 현존하는 운송 인프라를 그대로 사용할 수 있는 장점이 있다2).
본 연구에서는 암모니아 분해를 통한 수소 생산이라는 플랜트 공정 모델 및 최적화 설계 방향을 제시하고자 하였다. 암모니아가 수소와 질소로 분해되어 가지는 혼합 가스의 생성은 촉매를 활용한 암모니아 반응기 process로 모사하였으며, 반응기를 거치면서 생성된 혼합 가스로부터 수소를 분리 및 생산하는 과정은 pressure swing adsorption (PSA) process를 적용하는 process modeling을 연구 및 제시하였다. 분해 반응 공정과 정제 공정의 연계를 통한 시뮬레이션을 통하여, 촉매 반응기에서의 분해율과 수소 정제 공정의 상호간의 관계를 분석 평가함으로서, 에너지 효율 측면에서, 전체 수소 생산 공정 최적화 방향을 제시하고자 한다.
2. 플랜트 공정 요소
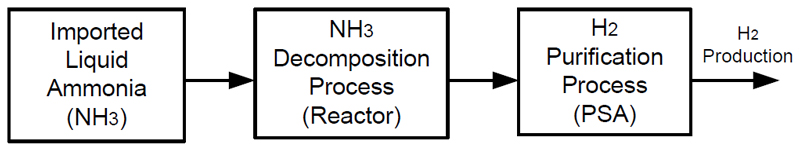
본 연구에서 제안하는 암모니아 분해 및 수소 정제 공정 모델을 block flow diagram으로 나타내면 Fig. 1과 같이 된다. 해외로부터 액체 상태로 운송된 액체 암모니아는 기체 상태로 상변화를 거친 후에 촉매가 충전된 고온의 열분해 반응기에서 수소와 질소로 분해되게 된다. 분해된 수소와 질소의 혼합 가스는 PSA 과정을 거치면서 질소 가스가 분리되면서 100% H2 production의 상태가 되어 수소 배관망(H2 pipeline)으로 공급하게 된다는 것이 플랜트 공정 흐름이 된다.
2.1 암모니아 분해 공정
암모니아 분해 반응은 반응식 (1)과 같이 수소와 질소로 분해되는 흡열 반응으로7), 반응을 위해서는 열이 공급되어야 한다.
| (1) |
암모니아 분해 반응은 외부로부터 열을 공급하여야 발생하는 흡열 반응으로, 2개의 암모니아 분자가 분해되어 하나의 질소 분자와 3개의 수소 분자를 형성하게 된다. 고온, 고압에서 진행되는 흡열 반응에서는 암모니아 분해 반응기를 가열 상태로 유지하기 위하여 많은 에너지를 공급하여야 한다. 아울러 고체 분말 형태의 촉매를 사용하여 반응 온도 및 속도를 조금이라도 향상시키려는 노력이 진행되고 있다2).
암모니아 분해 반응은 400℃에서 600℃의 온도 영역에서 열역학적 평형에 도달하면 99.0%에서 99.9%의 암모니아 전환율을 얻을 수 있다. 일반적으로 상용되는 루테늄(Ru) 금속 기반의 촉매는 555℃ 이상의 온도에서 99% 이상의 암모니아 전환율을 얻을 수 있다8).
그러나 일반적으로 이용되고 있는 루테늄 금속 기반의 촉매는 가격이 매우 고가이며, 촉매는 오랫동안 성능을 유지하는 것이 어렵기 때문에 정기적으로 재구매하여 사용해야 한다는 단점이 있다2).
2.2 수소 정제 공정
암모니아 분해 반응기에서 발생하는 혼합 가스에서 수소를 분리하기 위한 방법으로는 PSA process, temperature swing adsorption process, 극저온 분리 process, membrane 분리 process 등이 이용되고 있다. PSA process의 경우, 고압의 조건을 충족시키려면 압축이 요구되기 때문에 대용량 플랜트에 적합하다는 장점이 있다1,9).
운전 압력에 따라 PSA 시스템은 PSA, vacuum swing adsorption (VSA) 및 pressure vacuum swing adsorption (PVSA)의 세 가지 유형으로 구분할 수 있다10).
PSA 시스템에서 흡착은 고압이고 탈착은 저압인 상태에서 이루어진다. 이 시스템에서 수소는 질소와 암모니아로부터 분리된다. VSA 시스템에서 원료 가스의 가압은 터보 블로어를 이용하고, 이후에, 가스 압력은 흡착제를 재생하기 위해 진공 펌프에 의해 낮춰지게 된다. VSA 시스템에서는 운전 압력이 대기압에 가깝기 때문에 전력 소비가 PSA 시스템에 비하여 적다. PVSA 시스템은 VPSA 시스템이라고도 하며, 원료 가스의 압력은 흡착기로 분사하는 루츠 송풍기로 가압되고, 그 후 진공 펌프를 사용하여 탈착 및 재생을 진행한다10).
각 시스템에 채워진 흡착제의 양은 PSA, PVSA, VSA 순서로 증가하며, 시스템에 사용되는 장비의 크기는 각 시스템에 채워진 흡착제의 양에 비례하게 된다. 완벽한 흡착제는 흡착하고자 하는 물질에 대한 높은 선택성과 흡착 능력뿐만 아니라 운전 조건에서 흡착, 탈착이 역학적으로 잘 이루어져야 한다. 또한 반복되는 고압에 견디기 위하여 높은 기계적 강도를 가져야 하고, 재질은 흡착, 탈착 주기 반복 후에도 고유 특성을 유지할 수 있어야 한다10).
PSA 공정의 또 하나의 중요한 운전 변수로 세정 가스(purge gas)의 양이 있다. PSA cycle time 중 세정 단계에서의 세정 가스는 정제된 수소로, 충분한 세정을 위해서는 적정량의 수소가 공급되어야 한다.
세정 가스로 공급되는 수소의 순도가 높으며, 시작과 끝의 압력차가 클수록 흡착 탑에서 생산되는 수소의 순도가 높게 생산될 수 있다. 하지만 공급되는 수소의 순도가 낮으면 흡착 탑을 오염시켜 생산되는 정제 수소의 순도가 더 낮아지게 되는 결점이 발생하게 된다.
압력차를 높이기 위해 탑의 압력을 지나치게 낮추면 탑에 흡착된 불순물들이 탈착되어 세정 가스의 순도가 낮아지게 때문에 탑을 오염시킬 수 있다. 따라서 목표 순도를 유지하며 회수율을 극대화하기 위해서는 적절한 압력차를 적용하는 것이 매우 중요하다10).
3. 플랜트 공정 설계
본 연구에서 제안하는, 암모니아 분해를 통한 수소 생산 공정 설계를 위한 공정 모사에 사용한 가정들은 다음과 같다11).
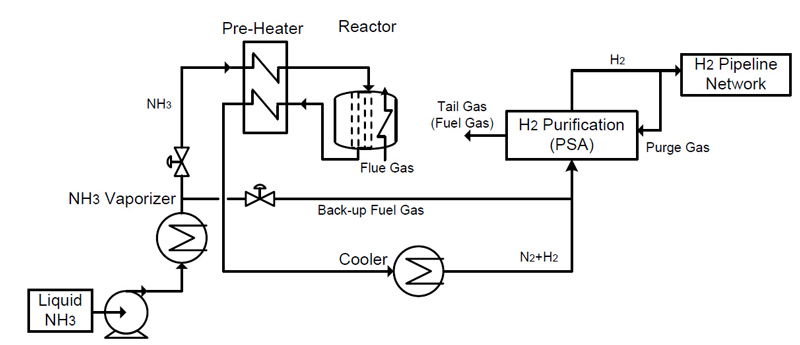
암모니아 분해 시뮬레이션은 공정 모사 프로그램으로 널리 알려진 Aspen HYSYS V14 (Aspen Tech, Bedford, MA, USA)를 이용하였다. 그리고 고온 및 고압 상태에서 일어나는 암모니아 분해 반응을 시뮬레이션하기 위하여 Soave-Redlich-Kwong 상태 반응식을 이용하였다12). 원료는 액체 상태의 암모니아로 펌프를 이용하여 이송하였으며, NH3 vaporizer에서 기체 상태로 상변화를 시킨 다음에 반응기로 공급된다. 반응기에서 분리된 고온의 분해 기체는 반응기로 주입되는 저온의 암모니아 가스와 열 교환을 하여, 반응기에서의 에너지 효율이 상승하는 효과를 발휘하게 된다.
암모니아 분해 및 반응기의 가열에 필요한 열량 은 600℃ 기준으로 583 W로 가정하였다8). 암모니아 열분해 반응기로 전달되는 PSA tail gas에 의한 열에너지 효율은 40%로 가정하였고, PSA 전단 온도는 40℃로 가정하였다12). 마지막으로 PSA의 수소 회수율(recovery)은 80%로 가정하였고, product 내의 수소 순도는 100%로 가정하였다10,12).
3.1 플랜트 공정 모사
Fig. 2에 반응기와 PSA를 포함하는 전체 공정을 나타내었다. 전체 공정은 암모니아를 질소와 수소로 분해하는 분해 반응을 처리하는 반응기 공정과 분해된 혼합 가스에서 수소를 분리하는 PSA 수소 정제 공정의 2가지 공정으로 이루어져 있다. 원료인 암모니아는 액체 상태로 저장되어 있던 것을 암모니아 증발기(NH3 vaporizer)로 보내어 가스 상태로 상변화를 시키게 되며, 반응기 출구 가스와의 열 교환을 하는 예열 과정을 거치게 된다. 이 과정에서 600℃에 가까운 상태로 가스 온도가 올라가게 된다.
고온 상태의 암모니아 가스는 촉매로 충전되어 있는 반응기로 공급되는데, 암모니아 분해 반응은 반응식 (1)에서 나타낸 바와 같이 흡열 반응으로 이루어지게 된다. 이를 위하여 외부로부터의 추가적으로 열에너지를 공급하면 암모니아 분해 반응이 촉진된다.
본 연구에서는 반응기에서의 암모니아 분해율을 60%, 70%, 80%, 90% 그리고 100%의 5가지로 가정하여 연구를 진행하였는데, 이는 분해율, purge gas, tail gas 및 필요 에너지와의 상관관계를 살펴보기 위함이다.
반응기에서 분해된 혼합 가스는 암모니아 가스와 열 교환을 거치면서 냉각된다. 냉각된 혼합 가스는 수소 정제 공정에 해당하는 PSA process를 거치면서 수소와 질소 가스로 분리하게 된다. Product gas에 해당하는 100% H2중 일부분은 PSA의 재생 공정을 위하여 사용된다. PSA의 재생 공정을 거친 수소와 질소의 혼합 가스는 암모니아 분해 반응기에 열에너지를 제공하기 위한 원료로 사용된다.
PSA에는 대부분 두 종류 이상의 흡착제를 사용하는 poly bed 형태가 일반적이다. 특별한 경우가 아니면 상업용 poly bed PSA의 경우 경제성 등을 고려하여 일반적으로 80% 이상의 회수율을 목표로 한다10). 본 연구에서도 PSA process에서는 80% 이상의 수소 회수율을 가정하였다10,12).
반응기와 PSA를 포함하는 전체 공정 모사의 결과는 Table 1과 같이 요약할 수 있다. Table 1은 반응기에 공급되는 100% 암모니아 가스가 반응기를 통과할 때 발생할 수 있는 여러 가지 분해율을 공정 모사에 적용한 결괏값을 나타낸 것이다.
수소 가스 생산을 위한 원료 가스에 해당하는 암모니아 가스의 유량은 계산 결과의 원활한 비교 분석을 위하여 10,000 kg/h를 기준으로 하여 공정 모사를 실시하였으며, 다음에 해당하는 공정 변수들을 살펴보았다.
공정 모사에서의 공정 변수로는, 원료 암모니아, 반응기를 거치면서 분해된 수소 및 질소 가스, 반응에 필요한 열에너지, PSA에서의 H2 production rate, PSA의 재생 공정에 필요한 수소 가스, PSA 재생 공정의 출구 혼합 가스에 해당하는 수소 및 질소 가스, 열분해 반응기에 열에너지를 공급하는 데 필요한 원료로 사용되는 PSA tail gas (수소, 질소) 등을 열거할 수 있다.
여러 가지 공정 변수 중에서 중요한 것은 분해율과 원료 가스에 해당하는 PSA tail gas이다. 재생 공정에서 발생하는 PSA tail gas는 부산물 가스에 해당하는 것으로 다른 목적으로의 사용이 어려우므로 원료 가스로 사용된다. PSA tail gas의 발생량이 원료 가스 소요량보다 많은 경우에는 남게 되는 여분의 가스는 플레어 스택으로 보내서 연소시키는 방법 외에는 없다. 원료 가스 소요량보다 PSA tail gas의 유량이 적게 되는 경우, 원료 소요량을 충족시키기 위하여 100% 암모니아 가스를 추가 원료 가스로 공급하여야 하는데, 이 경우에는 열분해에 소요되어야 하는 원료 가스를 에너지 공급을 위한 가스로 사용하여야 한다는 비효율성이 발생하게 된다.
3.2 결과 분석
암모니아 반응기에서의 암모니아 분해에 따른 생성 가스의 변화 그래프를 Fig. 3에 나타내었다. 중요한 것은 암모니아 분해에 공급되어야 하는 필요 에너지와 수소 정제 공정에서 부수적으로 발생하게 되는 PSA tail gas를 연료로 하여 얻을 수 있는 에너지의 양이 같아진다면 최적의 에너지 효율을 이끌어 낼 수 있다는 것이다.
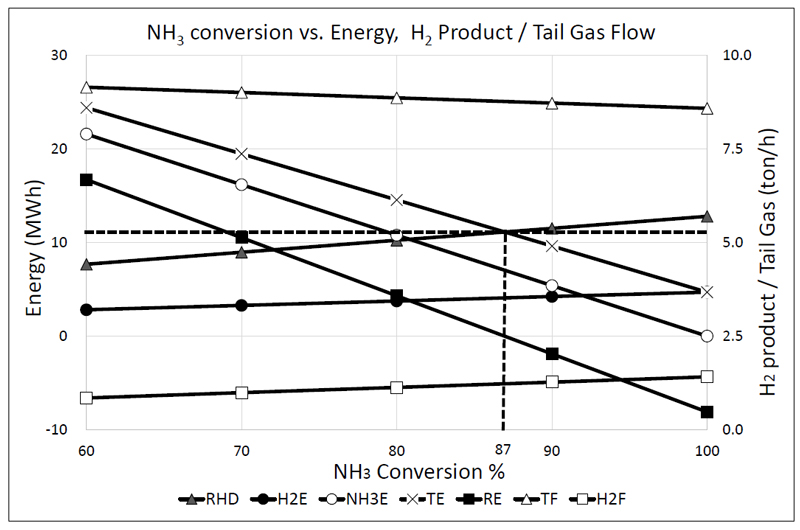
Calculated major process variables of NH3 decomposition and pressure swing adsorption process. RHD: energy required in reactor depending on the ammonia decomposition rate, MWh. H2E: energy transferred to reactor by burning H2 component contained in tail gas, MWh. NH3E: energy transferred to reactor by burning NH3 component contained in tail gas, MWh. TF: tail gas flow rate from PSA (NH3+N2+H2), ton/h. H2F: H2 production rate to pipeline network, ton/h. TE: total energy (H2E+N3E), MWh. RE: remain energy (TE-RHD), MWh
공정 모사 결과에 의하면 Fig. 3에 나타낸 것과 같이 분해율, 분해 반응으로 인하여 생성되는 가스 성분, 그리고 분해에 필요한 소요 열에너지의 관계는 1차원적인 정비례 관계를 형성한다. 주요한 공정 변수로 작용하는 것은 분해율에 따른 PSA tail gas의 발생량과 열에너지 공급을 위한 소요 가스의 양의 관계가 된다.
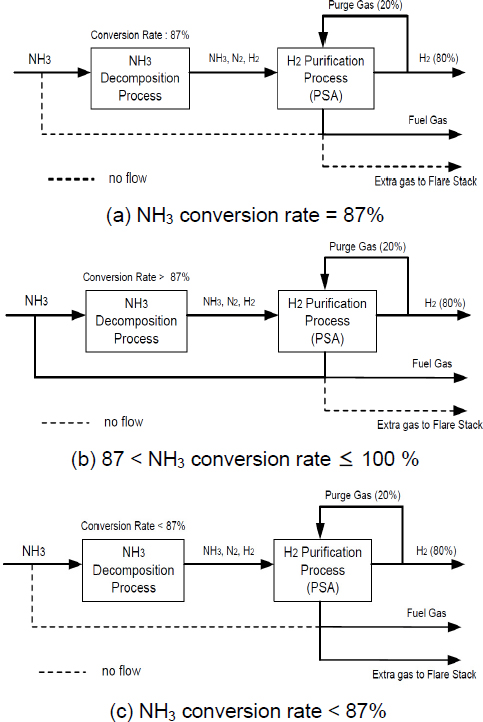
암모니아 열분해 반응기의 분해율에 따라서 변화하게 되는 PSA tail gas 및 fuel gas가 부족하게 되는 경우에 사용되는 100% 암모니아 가스의 흐름을 Fig. 4에 나타내었다.
(a)에서는 반응기에서의 분해율이 87%가 되는 경우의 유체 흐름을 나타낸 것이다. 공정 모사 결과에 의하면 반응기를 떠나는 혼합 가스의 성분 중에는 13% 이상의 미분해 암모니아가 포함되어 있다. 혼합 가스(수소, 질소, 미분해 암모니아)는 PSA process를 거치면서 100% 수소가 생산되고, 나머지 질소와 미분해 암모니아는 PSA에 충진되어 있는 catalyst에 축적되게 된다. 100% 수소 성분으로 이루어진 가스 흐름 중에서 20% 정도를 PSA 재생을 위한 purge gas로 사용하게 된다12). Purge gas의 사용으로 인해 PSA catalyst에 축적되어 있는 질소와 미분해 암모니아는 purge gas와 함께 PSA에서 배출되어 fuel gas로서 이용된다. 분해율 87%에서는 tail gas의 유량이 필요로 하는 fuel gas 유량과 같아지는 현상이 발생한다. 즉, 추가적인 암모니아 가스의 보충이 없어도 되고, 플레어 스택으로 보내서 연소시켜야 하는 여분의 가스도 존재하지 않게 된다. 이 경우의 효율이 가장 좋다.
(b)에서는 반응기에서의 분해율이 87% 이상이 되는 경우의 유체 흐름을 나타내었다. 분해율 87% 이상에서는 tail gas의 유량이 필요로 하는 fuel gas 유량보다 적어지는 상황이 발생하게 된다. 즉, 열에너지의 원료로 사용할 추가 가스를 필요로 한다는 것이다. 추가 가스는 100% 암모니아 가스를 이용하게 되므로, 수소 생산을 위하여 사용하여야 할 암모니아 가스를 fuel gas로 사용한다는 점에서 비효율이 발생하게 된다.
(c)에서는 분해율이 87% 이하가 되는 경우의 유체 흐름을 나타낸 것이다. 분해율 87% 이하에서는 tail gas의 유량이 필요로 하는 fuel gas 유량보다 커지는 상황이 발생하게 된다. 여분의 가스는 사용 용도가 없으므로, 플레어 스택으로 보내서 연소시키는 방법 외에는 다른 방법이 없는 비효율이 발생하게 된다.
해외로부터 수입된 암모니아를 열분해하여 발생하게 되는 혼합 가스에서 수소를 정제하여 수소 배관망에 공급하는 전체 플랜트 공정 흐름에서 주요한 부분은 분해 공정과 정제 공정에 해당한다. 일반적으로는 분해 공정에 초점을 맞추어서 분해율을 높이는 방향으로 설계를 진행하기 때문에, 반응기 촉매량 및 분해 공정 시스템의 구성 기기들의 용량을 크게 가져가도록 설계에 반영하는 것이 현실적인 상황이라고 할 수 있다. 또한 하류 공정에 해당하는 PSA 정제 공정의 경우, 정제된 100% 수소 가스 중에 20% 정도를 PSA 재생을 위하여 사용하여야 한다는 한계점을 가지고 있다10).
본 연구에서는 관점을 바꿔 암모니아 분해 반응기에서 PSA 정제 공정으로 변화시키면 어떤 현상들이 발생하는지에 대하여 연구하고자 한다. 즉, PSA 재생 공정의 특성을 분해 반응기의 설계로 반영하여 배출되는 tail gas 유량으로 fuel gas의 총 유량을 만족하도록 암모니아 분해 반응기(분해율)를 설계하고, 추가로 암모니아 가스를 fuel gas로 공급하는 것도, 과잉 배출로 인한 여분의 가스를 플레어 스택으로 보내서 연소시킬 필요도 없도록 하는 것이 목적이다. 플랜트 공정 모사 결과는 적정 분해율(본 연구에서는 87%)을 유지하는 경우, fuel gas의 과잉 또는 부족의 현상이 사라지는 것이 확인되었다.
4. 결 론
본 논문에서는 암모니아 분해를 통한 수소 생산 플랜트의 공정 모델과 최적화 설계 방향을 제시하였다. 반응기에서의 분해율을 100%에 근접하도록 설계를 진행하는 경우, 촉매 사용량을 증가시키고 전체 분해 공정 시스템의 구성 기기들도 큰 설계 용량을 가지게 된다. 그러나 수소 재생 공정의 특성을 반응기의 설계에 반영하게 된다면, 배출되는 tail gas 유량으로 fuel gas의 총 유량을 만족하게 되는 것이 가능해진다. 즉 암모니아 가스를 fuel gas로 공급하는 것도, 과잉 배출로 인한 여분의 가스를 플레어 스택으로 보내서 연소시키는 상황도 발생하지 않게 된다는 것이다. 플랜트 공정 모사 결과를 분석해 보면, 반응기에서 적정 분해율을 유지하는 경우 fuel gas의 과잉 또는 부족 현상이 사라지는 것이 확인되었다. 아울러 소요되는 촉매의 양 절감 및 해당 공정들의 최적화 용량 설계가 가능하게 되었다.
References
-
D. Kim, T. Kim, D. Lee, Y. Kim, K. Ahn, Y. Bae, J. Park, and Y. Kim, “Study on electrochemical hydrogen separation of hydrogen and nitrogen mixture gas”, Journal of Hydrogen and New Energy, Vol. 34, No. 2, 2023, pp. 149-154.
[https://doi.org/10.7316/JHNE.2023.34.2.149]

- H. Sohn, “Introduction to hydrogen production technologies from ammonia decomposition and natural gas reforming (blue hydrogen)”, Proceedings of the KFMA Annual Meeting, 2022, pp. 33-34. Retrieved from https://www.dbpia.co.kr/journal/articleDetail?nodeId=NODE11102455, .
-
H. Lesmana, Z. Zhang, X. Li, M. Zhu, W. Xu, and D. Zhang, “NH3 as a transport fuel in internal combustion engines: a technical review”, Journal of Energy Resources Technology, Vol. 141, No. 7, 2019, pp. 070703.
[https://doi.org/10.1115/1.4042915]

-
R. Lan, J. T. S. Irvine, and S. Tao, “Ammonia and related chemicals as potential indirect hydrogen storage materials”, International Journal of Hydrogen Energy, Vol. 37, No. 2, 2012, pp. 1482-1494.
[https://doi.org/10.1016/j.ijhydene.2011.10.004]

- Commonwealth Scientific and Industrial Research Organisation (CSIRO), “National hydrogen roadmap: an economically sustainable hydrogen industry in Australia”, CSIRO, 2018. Retrieved from https://www.csiro.au/en/work-with-us/services/consultancy-strategic-advice-services/CSIRO-futures/Energy-and-Resources/National-Hydrogen-Roadmap, .
-
T. Q. Quach, V. T. Giap, D. K. Lee, S. Lee, Y. Bae, K. Y. Ahn, and Y. S. Kim, “Performance analysis of ammonia-fed solid oxide fuel cell using alternating flow”, Journal of Hydrogen and New Energy, Vol. 33, No. 5, 2022, pp. 557-565.
[https://doi.org/10.7316/KHNES.2022.33.5.557]

-
K. Koo, H. B. Im, D. Song, and U. H. Jung, “Status of COx-free hydrogen production technology development using ammonia”, Journal of Energy & Climate Change, Vol. 14, No. 1, 2019, pp. 34-42.
[https://doi.org/10.22728/jecc.2019.14.1.034]

-
S. Lee, Y. Choi, C. Park, H. Kim, Y. D. Lee, and Y. S. Kim, “A study on ammonia reforming catalyst and reactor design for 10 kW class ammonia-hydrogen dual-fuel engine”, Journal of Hydrogen and New Energy, Vol. 31, No. 4, 2020, pp. 372-379.
[https://doi.org/10.7316/KHNES.2020.31.4.372]

- S. T. Kim, “Hydrogen refining technology using catalytic reaction”, News & Information for Chemical Engineers, Vol. 40, No. 3, 2022, pp. 315-320. Retrieved from https://kiss.kstudy.com/Detail/Ar?key=3949665, .
- C. H. Chung, “The purification characteristics of by-product hydrogen gas in petrochemical NCC process using [Doctoral dissertation]”, Gwangju: Chonnam National University; 2021, pp. 89-100.
-
S. Sircar and T. C. Golden, “Purification of hydrogen by pressure swing adsorption”, Separation Science and Technology, Vol. 35, No. 5, 2000, pp. 667-687.
[https://doi.org/10.1081/SS-100100183]

-
S. Son, “Preliminary thermodynamic evaluation of a very high temperature reactor (VHTR) integrated blue hydrogen production process”, Journal of Hydrogen and New Energy, Vol. 34 No. 3, 2023, pp. 267-273.
[https://doi.org/10.7316/JHNE.2023.34.3.267]