홀뮴 도핑된 TiO2를 이용한 광전기화학 수소 제조
2023 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
Holmium-doped TiO2 nanotubes (Ho-TNTs) were manufactured through anodization treatment and electrochemical deposition, and optimization experiments were conducted using various Holmium doping concentrations and time as variables. Surface as well as electrochemical characteristics were analyzed to study the prepared photocatalysts. Ho-TNTs were found to exist only in anatase phase through X-ray diffraction analysis. Ho-TNTs with 0.01 wt% 100 seconds shows a photocurrent density of 3.788 mA/cm2 and an effective photo-conversion efficiency (PCE) of 4.30%, which is more efficient than pure TiO2 nanotubes (pure-TNTs) (at bias potential 1.5 V vs. Hg/HgO). The photocatalytic activity of the aforementioned Ho-TNTs for hydrogen production was evaluated with the result of -29.20 µmol/h·cm2.
Keywords:
Photoelectrochemical water splitting, Hydrogen, Holmium, photocatalyst키워드:
광전기화학적 물분해, 수소, 홀뮴, 광촉매1. 연구 배경 및 이론
석탄, 석유 및 천연가스와 같은 화석연료의 남용은 지구온난화와 환경오염의 주요 원인이며, 대부분의 연구자들은 재생 불가능한 에너지의 부족, 환경오염, 지속적으로 증가하는 에너지 수요 문제를 극복하기 위해 빠른 친환경 재생에너지 기술 개발을 강조하고 있다1,2). 물분해 수소 생산 방법 중 광전기화학 시스템은 태양에너지를 원천으로 전기화학 반응을 통해 수소를 생산하는 공정이며, 이산화탄소 배출이 없는 친환경적 기술이다3). 광전기화학 물분해 시스템의 경우, 광양극(photoanode)의 밴드갭보다 높은 에너지를 갖는 빛이 조사되면 촉매가 반응하여 가전자대(valance band, VB)의 전자(electron, e-)가 전도대(conduction band, CB)로 여기된다. 이때 분리된 전자는 외부 회로를 통해 음극으로 이동하여 수소 분자를 생성시키고 표면에 존재하는 수소 이온의 수를 줄인다. 반대로 광양극에서는 생성된 정공이 물을 산화시켜 산소가 생성된다4). 광촉매 반응에 미치는 요인의 경우 크게 4가지로, (1) 광자의 흡수, (2) 전자/정공 쌍의 재결합 속도, (3) 자유 전하 캐리어의 이동, (4) 표면전하, 가공성, 화학적, 열적, 환경적, 안정성을 포함한 표면 특성이 있다5-7).
광전기화학 시스템의 수소 생성 반응에서 광양극으로 사용되는 대표적인 물질은 TiO2이다. TiO2의 경우 타 재료에 비해 독성이 낮으며, 화학적, 물리적, 열적으로 안정적이다. 그리고 자원도 풍부하고 환경 친화적이며 광부식성 또한 낮기 때문에 다양한 분야에서 사용되고 있다. 하지만 TiO2는 구조적 한계와 문제로 인해 지면에 도달하는 태양스펙트럼 중 자외선 범위(3-4%)에서만 광에너지를 흡수할 수 있기 때문에, 전자/정공 쌍은 TiO2의 상대적으로 높은 에너지에서만 생성된다8,9). 더 많은 태양빛을 활용하기 위해서는 광촉매의 광흡수 파장대를 높이고 전기/정공 쌍의 빠른 재결합을 줄여야 한다. 따라서 TiO2 광촉매 성능을 향상시키는 방법 중 도핑으로 전자 포획을 통한 재결합을 방지할 수 있다10).
이후 양극의 활성, 자유전자 증대 방법으로 도핑이 있다. 도핑 물질로 흡수 파장대가 가시광선인 란타나이드 금속을 도핑하면 크게 3가지 효과가 있는 것으로 알려져 있다2,11,12). 첫 번째, 란타나이드 이온의 f-오비탈은 다양한 루이스 염기와의 상호작용에 의해 조정되며, 란타나이드 원소가 도핑된 TiO2의 표면 흡착 특성과 유기 오염물질의 착물화로 광활성을 향상 시킬 수 있다. 두 번째, 란타나이드 이온을 이용한 도핑은 전하 포획을 강화하고 전자/정공 재결합 과정을 방지한다. 세 번째, TiO2의 CB와 VB 사이에 위치한 란타나이드 이온의 f-오비탈을 통해 밴드갭 에너지를 감소시킬 수 있다.
최근 연구에서 란타나이드 금속을 TiO2에 도핑한 뒤 광전기화학 실험을 통해 수소 생성 실험을 진행한 바 있다1,2,4). 우선 0.01wt% erbium이 첨가된 전구체(erbium [III] nitrate pentahydrate, Er[NO3]3·5H2O) 용액을 제조하여 다양한 도핑 시간에 따라 실험을 진행하였다1). 이후 연속적인 연구로 다양한 란타나이드(Ho, Tb, Eu, Yb, Er) 금속을 전 연구에서 선정된 시간으로 도핑하였으며 그중 holmium TiO2 nanotubes (Ho-TNTs)의 수소 발생율이 90.13 μmol/cm2·h, 광변환 효율(photo-conversion efficiency, PCE) 2.68% (0 V vs. reversible hydrogen electrode [RHE])로 pure TiO2 nanotubes (TNTs) 대비 약 8.7배, 약 9.8배 증가하였다(Table 1)2).
본 연구에서는 란타나이드 금속 중 holmium을 이용하여, TNTs 전극에 도핑 시간, 농도 최적 조건을 확인하는 실험을 진행하였다.
2. 실험 과정
2.1 전처리
Ti foil (두께 0.25 mm, 순도 99.6%; Goodfellow, Cambridge, UK)을 2×5 cm2로 절단하고, 증류수(di water), ethanol (Duksan Pure Chemicals Co. Ansan, Korea) 순으로 초음파 장치를 통해 20분간 표면의 불순물을 제거하였다. 이후 희석된 hydrofluoric acid (HF; Duksan Pure Chemicals Co.)로 에칭하고 증류수를 이용해 충분히 세척한 후 실온(약 25℃)에서 24시간 건조시켰다.
2.2 양극산화
전처리된 Ti foil을 anode, 2×6 cm2 Fe foil을 cathode로 하고, 전해질은 0.5 M ammonium fluoride (NH4F, 순도 97% 이상; Junsei Chemical Co., Ltd., Tokyo, Japan), 2 vol% 증류수 및 ethylene glycol (C2H6O2, 순도 99.5% 이상; Duksan Pure Chemicals Co.) 혼합물을 사용하였으며, 2 전극 시스템으로 진행하였다.
두 전극 사이는 1.5 cm 간격으로 분리한 후 power supply에 연결하였다. 이후 0.1 A를 2시간 동안 가하고, 30분간 0.1 A 정전류에서 양극산화 처리하였다.
양극산화 후 제조된 비정질 TiO2 전극을 증류수로 여러 번 세척한 후 실온(약 25℃)에서 24시간 건조시켰다. 이후 산소분위기(400 mL/min) 450℃에서 2시간 동안 열처리하여 pure TNTs 전극을 제조하였다.
2.3 Holmium 도핑
양극산화 공정 후 제조된 무정형 TNTs 전극을 anode (working electrode), Pt mesh (5×5 cm2, 순도 99.9%; Goodfellow)를 cathode (counter electrode), holmium이 첨가된 전구체(Ho[NO3]3·5H2O, 순도 99.9% 이상; Merck Ltd. Korea, Seoul, Korea) 용액을 전해질로 하여 전기화학 공정을 통해 Ho-TNTs 전극을 제조하였다. 전극 도핑의 경우 -0.1 mA/cm2를 가하여 진행하였으며, 최적화를 위해 Table 2와 같은 변수로 하여 진행하였다.
제조된 샘플은 증류수로 세척한 후 실온(약 25℃) 및 데시게이터에서 48시간 건조하였다. 이후 산소분위기(400 mL/min) 450℃에서 2시간 동안 열처리하여 최종 Ho-TNTs 전극을 제조하였다.
2.4 물리적 분석
표면 분석 및 정성 정량 분석을 위해 에너지 분산형 X-선 분광계(energy-dispersive X-ray spectroscopy, EDS)가 장착된 전계 방출 주사 전자 현미경(field emission scanning electron microscope [FE-SEM], S-4800; Hitachi, Chiyoda City, Japan)을 사용하여 준비된 샘플의 형태 및 원소 조성을 연구하였다. 결정상은 60 kV, 300 mA 및 2θ 범위 20-80°에서 Cu Kα 방사선(λ=0.15418 nm)으로 X-선 회절(X-ray diffraction [XRD], D/MAX-2500pc; Rigaku, Tokyo, Japan)을 통하여 분석하였다.
2.5 전기화학적 분석
전기화학분석기(ZIVE; WonATech, Seoul, Korea)를 이용하여 3 전극 시스템에서 다양한 조건으로 전기화학 분석을 진행하였다. 우선 3 전극 시스템의 경우 양극산화 및 도핑을 통해 제조된 전극을 제단한 후 가장자리는 테프론 재질의 틀(내부면적, 1×1 cm2)로 세팅하여 working electrode로 사용하였고, Pt wire와 Hg/HgO reference electrode (1.0 M NaOH inner solution)를 이용하여 counter 및 reference electrode로 이용하였으며, 0.1 M Na2SO3를 전해질로 사용하였다.
전극에 조사되는 광원의 세기 조절은 휴대용 복사계(UM320; Minolta Co., Chiyoda City, Japan)를 사용하여 44 mW/cm2 (at 360 nm)로 조절하였다. 전극의 전기화학 분석은 open circuit potential, linear sweep voltammetry, chronoamperometry, photo-conversion efficiency 순으로 진행하였다. Working electrode 세팅 조건과, 광원 및 강도 조건은 PEC 물분해 실험에서 적용된 것과 동일하게 진행하였다.
2.6 PEC 수소 생성 실험
광전기화학 시스템을 통한 수소 생성은 2 전극 시스템, 실온에서 진행되었다. 이 시스템에서 사용된 working 및 counter electrode, electrolyte, 전극에 조사되는 광원의 경우 전기화학 분석과 같은 조건으로 진행되었다.
수소 생성 반응 시작 전 내부에 있는 산소, 질소 등을 제거하기 위해 아르곤으로 30분간 퍼징하였다. 이후 두 전극의 전압차를 1.5 V로 설정하고, 물분해 실험동안 생성된 H2는 열전도도 검출기(thermal conductivity detector, TCD)가 장착된 가스 크로마토그래피(7890A; Agilent Technologies, Santa Clara, CA, USA)로 의해 분석하였다. 위 장치에 사용된 컬럼은 Molecular sieve 5A (Supelco, Bellefonte, PA, USA), PorapakQ (Supeloco)로 구성되었다.
3. 결 과
3.1 XRD
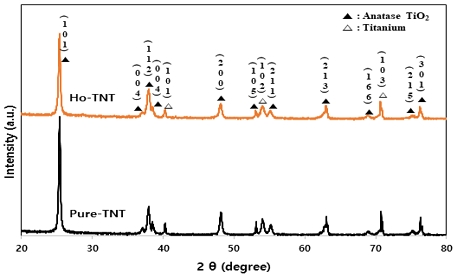
Holmium 도핑 유무를 확인하기 위해 기초 분석을 진행하였다. 우선 TNTs 분석으로 Fig. 1을 통해 피크 값을 확인하였을 때 JCPDS #00-021-1272에 따르면 25.28°, 36.94°, 37.8°, 38.57°, 48.04°, 53.89°, 55.06°, 62.68°, 68.76°, 75.02° 및 76.01°의 2θ 값에서 (101), (103), (004), (112), (200), (105), (211), (213), (116), (215) 및 (301) 결정면의 정방형 아나타제 구조로 확인되었다.
전기화학적으로 holmium을 TNTs에 도핑한 경우 결정상 변화는 없었다. 순수한 Ho 또는 Ho2O3와 같은 이차상의 회절 피크는 미량의 도펀트(dopant)가 고도로 분산되어 있거나 홀뮴 이온의 농도가 너무 낮아 XRD를 통해 검출할 수 없기 때문에 본 샘플에서는 검출되지 않았다2,13).
Ho-TNT의 결정 크기는 pure TNT 결정 크기보다 작다. 왜냐하면 Ho3+ (0.104 nm)의 이온 반경은 Ti4+ (0.068 nm)보다 더 크지만, TiO2 격자에서 특정 Ti 이온이 Ho 이온으로 대체되어 Ho-O-Ti 결합 형성을 통해 결정격자의 왜곡 및 팽창이 발생하여 결정 성장을 방해하기 때문이다14,15).
3.2 FE-SEM과 EDS
Fig. 2는 pure TNTs와 Ho-TNTs의 표면 형태를 보여준다. SEM 이미지를 통해 알 수 있듯이 모든 샘플은 수직 및 튜브 구조로 상부가 열려 있어 빛이 원활하게 튜브 내로 전달될 수 있는 균일한 형태를 갖고 있다.
Pure TNTs 및 Ho-TNTs의 내경과 벽의 두께는 각각 86.2-86.4, 22.3-24.4 nm로 확인되었다. 이를 통해 holmium 도핑을 위한 전기화학 공정이 Ho-TNTs의 구조를 손상시키지 않았음을 확인하였다.
Ho-TNTs의 EDS에서는 불순물이 존재하지 않으며, Ti, O, Ho 원소가 검출되었다(Table 3). 또한 Fig. 3을 통해, TNTs 내 holmium 원소는 넓은 영역에 균일하게 분포되어 있는 것을 확인되었다. 이를 통해 TNTs 내 holmium이 도핑된 것을 확인할 수 있다.
3.3 Ho-TNTs를 이용한 수소 생성 실험
Table 2의 조건에 따라 제조된 Ho-TNTs 전극을 이용하여 수소 생성 실험을 진행하였다.
Fig. 4는 도핑 시간에 따른 Ho-TNTs 샘플의 평균 수소 발생률(hydrogen evolution rate)과 전류밀도(average current density)를 나타내며, 100초 샘플 전후로 증가 및 유지되는 경향을 확인하였다. 100초 샘플의 수소 발생률과 평균 전류밀도는 각각 27.34 μmol/hr·cm2, 3.17 mA/cm2이며, pure (0초) 샘플은 각각 17.68 μmol/hr·cm2, 2.68 mA/cm2로 약 1.54배, 1.18배 증가하였다.
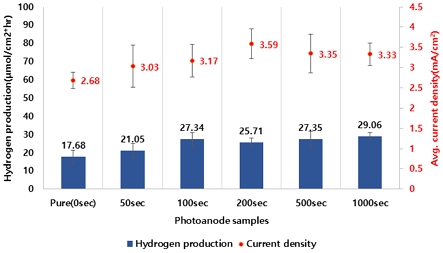
Photocatalytic efficiency of Ho-TNTs: hydrogen evolution and average current density (condition: doping time, concentration: 0.01 wt%)
따라서 100초 이상의 도핑 시간에서 평균 전류밀도와 수소 발생률에 큰 차이가 없다고 판단되어 100초를 최적 시간으로 결정하였다.
Fig. 5는 선정된 도핑 시간을 기준으로 다양한 도핑 농도에 따른 수소 발생률과 평균 전류밀도를 나타내며, 0.01 wt% 샘플 전후로 증감하는 경향을 확인하였다. 0.01 wt%의 수소 발생률과 평균 전류밀도는 각각 27.34 μmol/hr·cm2, 3.17 mA/cm2이며, pure (0 wt%)는 각각 19.99 μmol/hr·cm2, 2.87 mA/cm2로 약 1.37배, 1.10배 증가하였다.
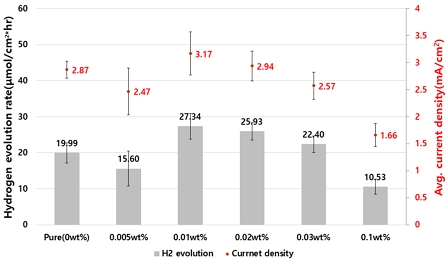
Photocatalytic efficiency of Ho-TNTs: hydrogen evolution and average current density (condition: doping concentration, doping time: 100 sec)
따라서 두 실험을 통해 pure TNTs 전극 대비 100초, 0.01 wt% Ho-TNTs 전극은 더 높은 광촉매 활성을 나타내는 것을 확인하였으며, 이를 최적 도핑 조건으로 선정하였다.
3.4 전기화학 분석
전기화학 분석에서 광양극은 Table 2에서 도핑 시간 조건으로 제조된 전극을 이용하였으며, Fig. 6의 경우 전기화학 분석을 나타낸 그래프이다.
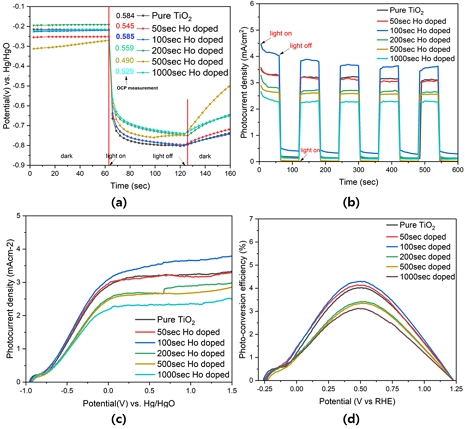
Photoelectrochemical characterization of as-prepared samples. (a) Open-circuit voltage (OCV), (b) chronoamperometry (CA), (c) linear sweep voltammetry (LSV), and (d) photo-conversion efficiency (PCE)
개방회로전위(open circuit voltage, OCV)는 전류가 0일 때 광전극과 상대 전극 사이의 전위차이다. 이 정의에 따라 |OCVlight – OCVdark|를 이용하여 OCV 값을 계산하였다. OCV는 광원 조사 유무, 전자 전달 관점에서 3단계로 나눌 수 있으며 빛 조사 시 광양극에서 발생하는 밴드 굽힘, 광생성 전자의 이동 방향, 란타나이드 원소의 최대 전위차에 미치는 영향 등을 파악할 수 있다16,17). 따라서 OCV는 광촉매의 광생성 전하 캐리어 밀도를 반영한다18). Fig. 6(a)의 경우 종류 상관없이 pure TNTs보다 더 높은 OCV 값을 생성하는 것을 보여주며, 그중 100초 도핑의 경우 0.585 V (vs. Hg/HgO)로 전체 전극 중 가장 크다.
Fig. 6(b)는 동일한 전기화학 분석에서 광생성된 전자의 이동과 정공에 의한 산화환원 작용을 나타낸다. 이는 물질의 고유한 특성이기 때문에 OCV와 시간대전류법(chronoamperometry, CA)은 유사한 경향을 나타낸다. 1.5 V (vs. Hg/HgO)에서 60초 간격으로 광원을 조사할 때 각 촉매에 측정된 광전류밀도를 확인 할 수 있다. 준비한 전극은 빠른 광반응과 안정적인 재현성을 나타내었다.
Fig. 6(c)는 제조된 전극의 선형 주사 전위법(linear sweep voltametry, LSV) 분석 결과를 나타내었다. LSV 분석은 전극의 광반응 특성을 반영하며, 그래프 내 1.5 V (vs. Hg/HgO)에서 광전극의 전류밀도의 경우 holmium 100초 도핑 시 3.788 mA/cm2로 가장 높았으며, pure TNTs 대비 약 1.13배 증가하였다. 광전류밀도는 광촉매를 통한 및 흡수와 전자/정공 쌍의 생성, 분리, 이동을 나타내므로 PEC 시스템의 각 반응 단계의 효율을 종합적으로 예측하는 데 사용할 수 있다. 촉매의 높은 광흡수와 낮은 저항은 광반응 효율을 향상시키며, LSV 분석을 이용하여 PCE로 나타낼 수 있다(Fig. 7)19).
여기서 η, jp, E0rev, |Eapp|, I0는 각각 PEC (%), 광전류밀도(A/cm2), 표준가역준위(1.23 V vs. RHE), 광원 하에서 광전류를 측정한 작업 전극의 전위(vs. RHE), 광원의 전력밀도(W/cm2)를 나타낸다. Table 4와 Fig. 6(d)에서 최대 광변환 효율은 4.30% (0.50 V vs. RHE)로 100초 holmium 도핑 샘플이며, pure TNTs 대비 약 1.07배 높게 측정되었다.
4. 결 론
본 논문에서는 광전기화학적 물분해 수소 제조 시스템에서 사용되는 광양극의 효율 증대 및 최적화를 위해 양극산화 공정으로 제조된 pure TNTs 기반으로 lanthanide metal인 holmium을 도핑 시간, 도핑 농도를 변수로 제조하였다. Holmium ion은 TNTs의 아나타제 결정 구조를 변형시키지 않고 촉매의 활성을 향상시키는 것을 확인하였다. 다양한 변수 중에서 0.01 wt% 100초 Ho-TNTs의 경우 높은 전하 캐리어 분리 및 이동, 높은 촉매 활성 등을 통해 광촉매 활성 향상을 확인하였다. 따라서 holmium이 도핑된 광촉매는 에너지 분야뿐만 아니라 CO2 conversion, 환경 처리 등 다양한 분야에서 적용이 가능할 것으로 판단되며, 추가 연구로 전기전도도 향상을 위한 그래핀 코팅, holmium 이외 추가 물질 도핑, 전극 scale up 등을 통해 광변환 효율 및 광촉매 효율이 향상될 것으로 기대된다.
Acknowledgments
본 연구는 국토교통부/국토교통과학기술진흥원의 지원을 받아 수행되었으며 이에 감사드립니다(과제번호 RS-2021-KA163280).
References
-
H. Cho, H. Joo, H. Kim, J. E. Kim, K. S. Kang, and J. Yoon. “Enhanced photocatalytic activity of TiO2 nanotubes decorated with erbium and reduced graphene oxide”, Applied Surface Science, Vol. 565, 2021, pp. 150459.
[https://doi.org/10.1016/j.apsusc.2021.150459]

-
H. Cho, H. Joo, H. Kim, J. E. Kim, K. S. Kang, H. Jung, and J. Yoon, “Enhanced photoelectrochemical activity of TiO2 nanotubes decorated with lanthanide ions for hydrogen production”, Catalysts, Vol. 12, No. 8, 2022, pp. 866.
[https://doi.org/10.3390/catal12080866]

-
A. Z. Khan, T. A. Kandiel, S. Abdel-Azeim, T. N. Jahangir, and K. Alhooshani, “Phosphate ions interfacial drift layer to improve the performance of CoFe-Prussian blue hematite photoanode toward water splitting”, Applied Catalysis B: Environmental, Vol. 304, 2022, pp. 121014.
[https://doi.org/10.1016/j.apcatb.2021.121014]

-
H. Cho, H. Jung, J. Yoon, K. Yi, H. Kim, and H. Joo, “Hydrog-enase enzyme for photoelectrochemical hydrogen producti-on from water splitting”, Journal of Hydrogen and New Energy, Vol. 33, No. 5, 2022, pp. 507-514.
[https://doi.org/10.7316/KHNES.2022.33.5.507]

-
H. Cho, H. Joo, H. Kim, J. E. Kim, K. S. Kang, and J. Yoon, “Improved photoelectrochemical properties of TiO2 nanotubes doped with Er and effects on hydrogen production from water splitting”, Chemosphere, Vol. 267, 2021, pp. 129289.
[https://doi.org/10.1016/j.chemosphere.2020.129289]

-
A. Fujishima, X. Zhang, and D. A. Tryk, “TiO2 photocatalysis and related surface phenomena”, Surface Science Reports, Vol. 63, No. 12, 2008, pp. 515-582.
[https://doi.org/10.1016/j.surfrep.2008.10.001]

-
K. R. Reddy, M. Hassan, and V. G. Gomes, “Hybrid nanostructures based on titanium dioxide for enhanced photocatalysis”, Applied Catalysis A: General, Vol. 489, 2015, pp. 1-16.
[https://doi.org/10.1016/j.apcata.2014.10.001]

-
J. He, A. Kumar, M. Khan, and I. M. C. Lo, “Critical review of photocatalytic disinfection of bacteria: from noble metals- and carbon nanomaterials-TiO2 composites to challenges of water characteristics and strategic solutions”, Science of The Total Environment, Vol. 758, 2021, pp. 143953.
[https://doi.org/10.1016/j.scitotenv.2020.143953]

-
M. Wang, J. Ioccozia, L. Sun, C. Lin, and Z. Lin, “Inorganic-modified semiconductor TiO2 nanotube arrays for photocatalysis”, Energy & Environmental Science, Vol. 7, 2014, pp. 2182-2202.
[https://doi.org/10.1039/C4EE00147H]

-
J. Zhang, K. Tse, M. Wong, Y. Zhang, and J. Zhu, “A brief review of co-doping”, Frontiers of Physics, Vol. 11, 2016, pp. 117405.
[https://doi.org/10.1007/s11467-016-0577-2]

-
P. Mazierski, W. Lisowski, T. Grzyb, M. J. Winiarski, T. Klimczuk, A. Mikołajczyk, J. Flisikowski, A. Hirsch, A. Kołakowska, T. Puzyn, A. Zaleska-Medynska, and J. Nadolna, “Enhanced photocatalytic properties of lanthanide-TiO2 nanotubes: an experimental and theoretical study”, Applied Catalysis B: Environmental, Vol. 205, 2017, pp. 376-385.
[https://doi.org/10.1016/j.apcatb.2016.12.044]

-
R. Khoshnavazi, H. Sohrabi, L. Bahrami, and M. Amiri, “Photocatalytic activity inhancement of TiO2 nanoparticles with lanthanide ions and sandwich-type polyoxometalates”, Journal of Sol-Gel Science and Technology, Vol. 83, 2017, pp. 332-341.
[https://doi.org/10.1007/s10971-017-4422-z]

-
D. Y. Lee, J. T. Kim, J. H. Park, Y. H. Kim, I. K. Lee, M. H. Lee, and B. Y. Kim, “Effect of Er doping on optical band gap energy of TiO2 thin films prepared by spin coating”, Current Applied Physics, Vol. 13, No. 7, 2013, pp. 1301-1305.
[https://doi.org/10.1016/j.cap.2013.03.025]

-
J. Reszczyńska, T. Grzyb, J. W. Sobczak, W. Lisowski, M. Gazda, B. Ohtani, and A. Zaleska, “Lanthanide co-doped TiO2: the effect of metal type and amount on surface properties and photocatalytic activity”, Applied Surface Science, Vol. 307, 2014, pp. 333-345.
[https://doi.org/10.1016/j.apsusc.2014.03.199]

-
W. Zhou and Y. He, “Ho/TiO2 nanowires heterogeneous catalyst with enhanced photocatalytic properties by hydrothermal synthesis method”, Chemical Engineering Journal, Vol. 179, 2012, pp. 412-416.
[https://doi.org/10.1016/j.cej.2011.10.094]

-
G. Xu, Z. Xu, Z. Shi, L. Pei, S. Yan, Z. Gu, and Z. Zou, “Silicon photoanodes partially covered by Ni@Ni(OH)2 core-shell particles for photoelectrochemical water oxidation”, ChemSus-Chem, Vol. 10, No. 14, 2017, pp. 2897-2903.
[https://doi.org/10.1002/cssc.201700825]

-
H. Zhang, M. Ebaid, J. W. Min, T. K. Ng, and B. S. Ooi, “Enhanced photoelectrochemical performance of InGaN-based nanowire photoanodes by optimizing the ionized dopant concentration”, Journal of Applied Physics, Vol. 124, No. 8, 2018, pp. 083105.
[https://doi.org/10.1063/1.5031067]

-
L. F. Marchesi, R. G. Freitas, E. R. Spada, F. R. Paula, M. S. Góes, and J. R. Garcia, “Photoelectrochemical characterization of ITO/TiO2 electrodes obtained by cathodic electrodeposition from aqueous solution”, Journal of Solid State Electrochemistry, Vol. 19, 2015, pp. 2205-2211.
[https://doi.org/10.1007/s10008-015-2848-1]

-
N. A. A. Samad, C. W. Lai, K. S. Lau, and S. B. A. Hamid, “Efficient solar-induced photoelectrochemical response using coupling semiconductor TiO2-ZnO nanorod film”, Materials, Vol. 9, No. 11, 2016, pp. 937.
[https://doi.org/10.3390/ma9110937]