폐플라스틱 가스화에 의한 가스로부터 상용 촉매 펠릿을 이용한 수성가스 전환 반응
2023 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
The water gas shift reaction was carried out using the commercial catalyst pellet and the simulated gases expected to occur from waste plastic gasification. In the water gas shift reaction, the high temperature shift reaction and the low temperature shift reaction were continuously performed with CO:H2O ratio of 1:2, 1:2.5, and 1:3, and the CO conversion and H2 increase rate were evaluated. The H2 increase rate increased in order to CO:H2O ratio of 1:3 > CO:H2O ratio of 1:2.5 > CO:H2O ratio of 1:2. The CO conversion showed a high value of more than 97% at each CO:H2O ratio. The water gas shift reaction at a CO:H2O ratio of 1:3 showed the highest H2 increase rate and CO conversion.
Keywords:
Waste plastic gasification, Water gas shift reaction, Hydrogen production, Catalyst, Catalyst pellet키워드:
폐플라스틱 가스화, 수성가스 전환 반응, 수소 제조, 촉매, 촉매 펠릿1. 서 론
플라스틱은 낮은 생산 비용, 내구성 및 내부식성과 같은 다양한 특성, 유연성과 가벼운 무게 때문에 다양한 용도로 사용되고 있다. 미국, 일본, 유럽에서는 연간 약 5,500만 톤의 플라스틱이 생산되고 폐기되고 있으며1), 국내에서도 2019년 기준 연간 822만 톤의 플라스틱이 생산되고 폐기되고 있다2). 폐플라스틱은 매립지에 매립되거나 재활용되고 있지만, 이러한 방법은 수질오염과 노동 집약적인 특성으로 인해 비환경적이고 비용이 많이 든다3). 또한 소각에 의한 폐플라스틱의 처리는 환경오염 물질인 이산화탄소를 배출한다는 단점이 있다4). 그리고 플라스틱의 낮은 분해성은 심각한 해양환경 문제를 일으키고 있다5,6). 따라서 폐플라스틱의 관리는 시급히 해결해야 할 과제로 대두되고 있다.
최근에는 폐플라스틱을 다른 제품으로 전환하는 기술이 많은 관심을 받고 있으며7-9), 특히 폐플라스틱을 에너지 운반체로 전환하는 열분해와 가스화 기술이 관심을 받고 있다4). 폐플라스틱의 열분해는 플라스틱 폐기물을 300-650℃의 온도로 가열함으로써 화학 물질과 연료를 생산하는 효율적인 방법으로 왁스10,11), 경질 올레핀12,13) 및 단량체14) 등을 선택적으로 생산하는 공정이 개발되었다15). 하지만 폐플라스틱의 열분해 공정의 상용화는 아직 진행되고 있지 않다15,16). 폐플라스틱의 가스화는 플라스틱 폐기물을 약 500-1,300℃의 고온에서 증기, 산소 및 공기와 반응시켜 H2, CO, CO2, CH4 가스 등을 생산한다. 폐플라스틱의 가스화 공정은 생성된 합성 가스(syngas, CO+H2)로부터 합성 석유, dimethyl ether (DME), 메탄올 등과 같은 연료, 수소와 같은 에너지 운반체를 생산하는 데 초점이 맞추어져 있다15).
합성 가스로부터 고순도의 수소를 생산하기 위해서는 CO를 CO2로 전환하면서 수소를 추가로 생산하는 수성가스 전환(water gas shift, WGS) 반응이 필수적이다.
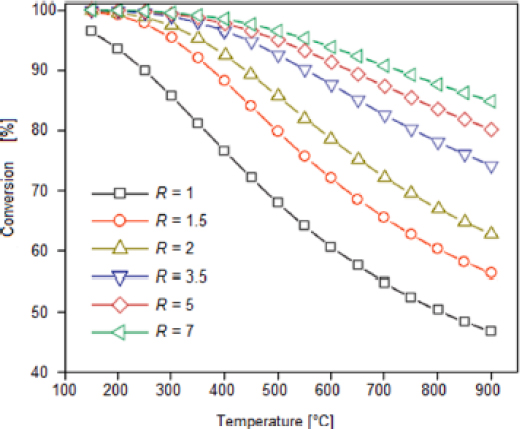
WGS 반응은 발열 반응이며, 다음과 같이 진행된다. WGS 반응의 H2O/CO (R) 비율에 따른 열역학적 이론에 따른 CO 평형 전환율은 Fig. 1과 같다17).
| (1) |
Fig. 1을 보면, WGS 반응은 발열 반응이므로 온도가 증가함에 따라 CO 평형 전환율도 감소한다는 것을 알 수 있다. 또한 CO 평형 전환율은 R값이 증가함에 따라 증가하는 것을 알 수 있다.
WGS 반응은 열역학적 평형을 고려하여 높은 온도에서 빠른 반응 속도로 수소를 생산하고, 낮은 온도에서 추가로 반응시켜 최대의 수소를 생산하고자 한다. 따라서 WGS 반응은 350-550℃의 고온 전환(high temperature shift, HTS) 반응과 200-300℃의 저온 전환(low temperature shift, LTS) 반응의 두 단계 공정으로 이루어진다18,19).
현재 국내에서 열가소성 폐플라스틱과 열경화성 폐플라스틱을 혼합한 폐기물 플라스틱의 가스화에 관한 연구가 진행되고 있으며, 그 과정에서 발생한 가스를 이용하여 수소를 생산하는 연구가 진행되고 있다.
본 연구에서는 폐플라스틱 가스화 공정에서 발생할 것으로 예상되는 가스를 모사하여 사용하고 상업용 촉매를 활용하여 수성가스 전환 반응을 진행하였다. HTS 반응용으로 Fe-Cr 계열의 상용 촉매를, LTS 반응용으로 Cu-Zn-Al 계열의 상용 촉매를 사용하였으며, CO:H2O의 비율에 따른 H2 증가율과 CO 가스 전환율에 대해 평가하였다.
2. 실 험
HTS 반응용으로는 A 촉매 펠릿(C사)을, LTS 반응용으로는 B 촉매 펠릿(C사)을 사용하였다. Table 1은 촉매 펠릿의 특성을 보여준다. 두 촉매 펠릿의 형태는 원기둥으로 직경 약 6 mm,길이 약 6 mm이다.
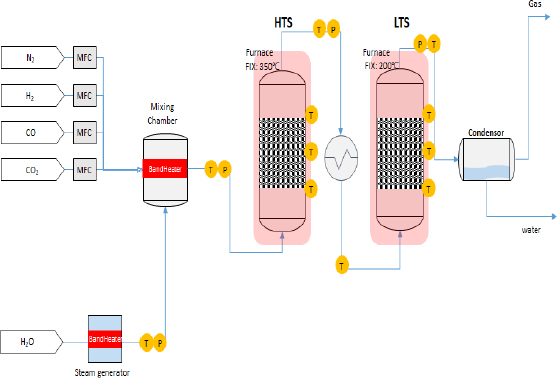
WGS 반응을 위해 Fig. 2와 같이 실험 장치를 구성하였다.
HTS와 LTS 반응관은 외경 약 60 mm, 길이 350 mm의 stainless steel (SUS)로 제작되었다.
물은 150-200℃의 스팀 발생기에 공급되어 수증기 형태로 혼합 체임버에 도입된다. 또한 CO, CO2, N2, H2, H2O 가스는 300-350℃의 혼합 체임버에서 혼합되어 HTS 반응관으로 도입되고, 다음 LTS 반응관에 도입된다. HTS와 LTS 반응 온도는 각각 350-400℃와 200-220℃를 유지하도록 하였다. WGS 반응이 끝난 가스는 응축기를 거쳐서 물과 가스로 분리하였고, 분리된 가스는 배출시켰다. 배출되는 가스는 15분, 30분, 60분 간격으로 가스 포집백으로 포집하고 gas chromatography (GC) (Chrozen; Youngin Chromass, Anyang, Korea)를 활용하여 가스 분석을 진행하였다. GC 분석은 포집된 가스 250 µL를 컬럼에 주입하여 진행하였으며, 시료별로 3회씩 분석하여 평균값을 취하였다.
CO 가스 전환율은 다음 식으로부터 계산하였다.
| (2) |
모든 반응은 상압(1 bar)에서 진행하였다.
공급되는 CO, CO2, N2, H2의 비율은 폐플라스틱 가스화에 의해 생성될 것으로 예상되는 가스 조성을 모사하여 각각 45%, 1%, 19%, 35%로 하였다. 또한 CO:H2O의 비율을 1:2, 1:2.5, 1:3으로 하여 WGS 반응을 진행하였다.
HTS와 LTS 촉매 펠릿은 반응관에 각각 190 mL를 충전하여 가스 시간 공간속도(gas hourly space velocity, GHSV)는 3,000 h-1가 되도록 하였다. 촉매 펠릿은 사용하기 전에 촉매의 활성을 높이기 위해 2%의 H2 가스가 함유된 Ar 가스를 이용하여 HTS 촉매 펠릿의 경우 400℃에서, LTS 촉매 펠릿의 경우 200℃에서 8시간 동안 전처리를 진행하였다.
3. 결과 및 고찰
3.1 WGS 반응의 CO:H2O 비율에 따른 생성 가스 변화
Table 2는 WGS 반응을 위한 공급 가스 유량을 나타낸다. 표를 보면 알 수 있듯이, 공급 가스인 CO, CO2, N2, H2의 조성은 각각 45%, 1%, 19%, 35%였으며, CO:H2O의 비율에 따라 유량이 약간씩 변하는 것을 알 수 있다. 또한 case 1, case 2, case 3의 CO:H2O의 비율은 각각 1:2, 1:2.5, 1:3이었다.
Fig. 3은 각 CO:H2O 비율에 따른 WGS 반응 시간과 각 생성 가스 조성과의 관계를 나타낸다.
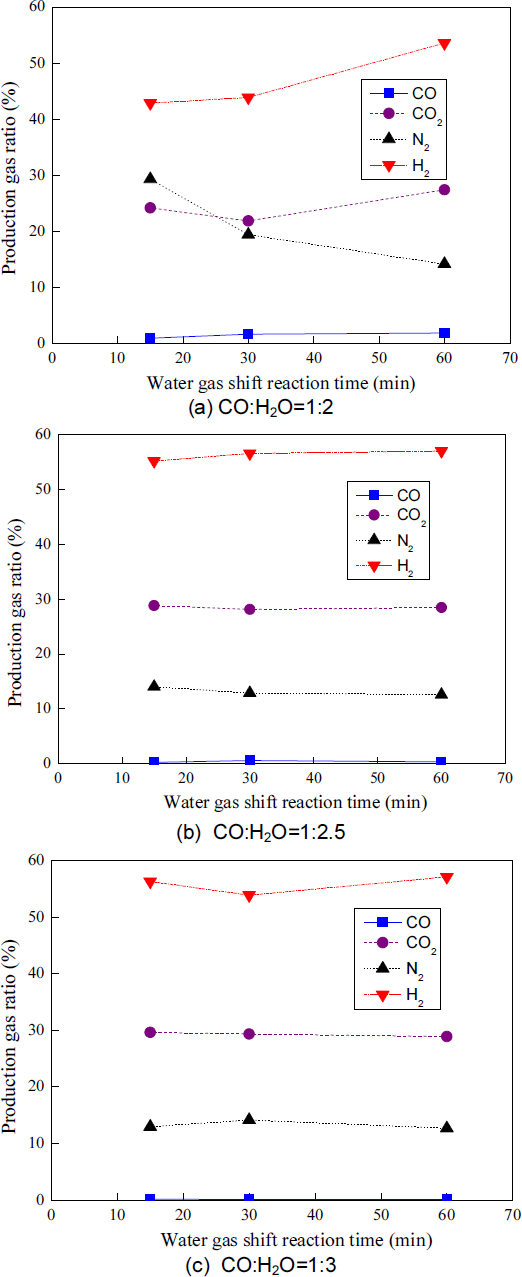
Relationship between the water gas shift reaction time and each production gas composition with each CO:H2O ratio
CO:H2O의 비율이 1:2인 경우, 생성 가스 중 CO의 조성은 WGS 반응 시간 15분 후 0.97%, 30분 후 1.69%, 60분 후 1.88%를 보였다. 생성 가스 중 CO2의 조성은 WGS 반응 시간 15분 후 24.19%, 30분 후 21.88%, 60분 후 27.42%를 보였다. 또한 생성 가스 중 H2의 조성은 WGS 반응 시간 15분 후 42.85%, 30분 후 43.9%, 60분 후 53.59%를 보였으며, N2의 조성은 WGS 반응 시간 15분 후 29.31%, 30분 후 19.41%, 60분 후 14.2%를 보였다.
H2와 CO2 가스 조성의 증가와 CO 가스 조성의 감소는 반응 가스인 CO는 반응의 진행과 함께 감소하고, 생성 가스인 H2와 CO2는 반응의 진행과 함께 증가하는 전형적인 WGS 반응을 보여주고 있다. N2 가스의 경우, 반응 15분 후에 높은 조성을 보이다가 반응 시간 경과와 함께 감소하는 이유는 초기에 미반응의 수증기에 의한 것으로 판단되며, WGS 반응 시간 경과와 함께 생성 가스가 증가하여 조성이 감소한 것으로 판단된다.
CO:H2O의 비율이 1:2.5인 경우, 생성 가스 중 CO의 조성은 WGS 반응 시간 15분 후 0.25%, 30분 후 0.61%, 60분 후 0.36%를 보였다. 생성 가스 중 CO2의 조성은 WGS 반응 시간 15분 후 28.86%, 30분 후 28.15%, 60분 후 28.5% 보였다. 또한 생성 가스 중 H2의 조성은 WGS 반응 시간 15분 후 55.22%, 30분 후 56.63%, 60분 후 57.05%를 보였으며, N2의 조성은 WGS 반응 시간 15분 후 14.03%, 30분 후 12.93%, 60분 후 12.6%를 보였다.
CO:H2O의 비율이 1:3인 경우, 생성 가스 중 CO의 조성은 WGS 반응 시간 15분 후 0.13%, 30분 후 0.07%, 60분 후 0.09%를 보였다. 생성 가스 중 CO2의 조성은 WGS 반응 시간 15분 후 29.62%, 30분 후 29.36%, 60분 후 28.88%를 보였다. 또한 생성 가스 중 H2의 조성은 WGS 반응 시간 15분 후 56.31%, 30분 후 53.88%, 60분 후 57.11%를 보였으며, N2의 조성은 WGS 반응 시간 15분 후 12.97%, 30분 후 14.16%, 60분 후 12.67%를 보였다.
Fig.3을 보면 CO:H2O의 비율이 1:2.5와 1:3인 경우, WGS 반응 시간이 경과해도 반응 가스인 CO와 생성 가스인 H2와 CO2의 조성은 거의 일정한 값을 보였다. 따라서 Fig. 3의 결과로부터 반응 시간이 경과해도 생성 가스의 조성이 크게 변하지 않는 면에서 WGS 반응은 CO:H2O의 비율 1:2.5와 1:3이 유리하다는 것을 알 수 있었다.
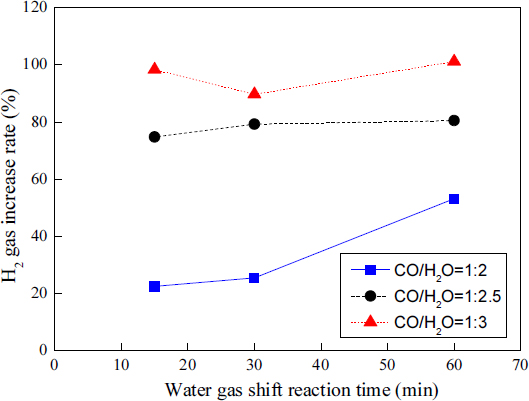
Fig. 4는 각 CO:H2O 비율에 따른 WGS 반응 시간과 H2 증가율 간의 관계를 나타낸다.
H2 증가율은 다음의 식으로부터 계산하였다.
| (3) |
CO:H2O의 비율이 1:2인 경우, H2 증가율은 WGS 반응 시간 15분 후 22.4%, 30분 후 25.4%, 60분 후 53.1%를 보였다. CO:H2O의 비율이 1:2.5인 경우, H2 증가율은 WGS 반응 시간 15분 후 74.7%, 30분 후 79.2%, 60분 후 80.5%를 보였다. CO:H2O의 비율이 1:3인 경우, H2 증가율은 WGS 반응 시간 15분 후 98.2%, 30분 후 89.7%, 60분 후 101.1%를 보였다.
Fig. 4를 보면 알 수 있듯이, 각 CO:H2O의 비율에서 WGS 반응 시간이 경과할수록 H2 증가율은 증가하는 경향을 보였다.
H2 증가율은 CO:H2O 비율 1:3에서 가장 높았으며, 1:2.5의 CO:H2O 비율, 1:2의 CO:H2O 비율 순서로 H2 증가율이 높았다. 이는 WGS 반응인 CO와 H2O 반응 비율 1:3에서 H2를 가장 많이 생산한다는 것을 의미한다. 따라서 수소 제조의 면에서 WGS 반응의 CO:H2O 비율은 1:3이 적절할 것으로 판단된다.
3.2 WGS 반응의 CO:H2O 비율에 따른 CO 전환율
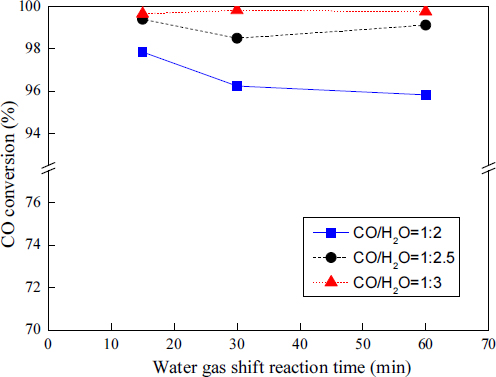
Fig. 5는 각 CO:H2O 비율에 따른 WGS 반응 시간과 CO 전환율 간의 관계를 나타낸다.
CO:H2O의 비율이 1:2인 경우, CO 전환율은 WGS 반응 시간 15분 후 97.8%, 30분 후 96.2%, 60분 후 95.8%를 보였다. CO:H2O의 비율이 1:2.5인 경우, CO 전환율은 WGS 반응 시간 15분 후 99.4%, 30분 후 98.5%, 60분 후 99.1%를 보였다. CO:H2O의 비율이 1:3인 경우, CO 전환율은 WGS 반응 시간 15분 후 99.6%, 30분 후 99.8%, 60분 후 99.8%를 보였다.
Fig. 5를 보면 CO:H2O의 비율이 1:2인 경우 WGS 반응 시간의 경과와 함께 CO 전환율은 약간 감소하는 경향을 보였고, CO:H2O의 비율이 1:2.5와 1:3인 경우 WGS 반응 시간이 경과해도 CO 전환율은 거의 일정한 값을 보였다.
Fig. 5의 결과로부터 각 CO:H2O 비율에 있어서 WGS 반응 시간이 15분 정도가 되면 97% 이상의 높은 CO 전환율을 보임을 알 수 있다. 따라서 CO:H2O의 비율이 1:2, 1:2.5, 1:3인 경우 WGS 반응 시간은 15분 정도가 적당할 것으로 판단된다.
일반적으로 WGS 반응에서는 CO:H2O 비율이 Fig. 1에 나타낸 바와 같이 매우 중요한 변수로 작용하며, CO:H2O 비율이 1:1 이하로 낮은 경우 HTS 반응용 촉매인 Fe 계열에서는 금속 철의 형성, 메탄화, 탄소 침착 및 Fisher-Tropsch 반응이 일어나는 것으로 알려져 있다19). 또한 Chen 등20)의 연구 결과에 의하면 CO:H2O 비율을 1:2, 1:4, 1:8로 하여 HTS 반응과 LTS 반응을 진행하였을 때, 각각의 반응에서 CO 전환율은 1:2의 비율보다 1:4의 비율에서 약 2배 이상 증가하는 경향을 보이고, 1:8의 경우 1:4보다 약간 증가하는 경향을 보인다고 보고하였다. 또한 400-500℃의 HTS 반응과, 200-300℃의 LTS 반응에서 생성되는 가스 중 H2 가스의 증가는 촉매에서의 물 분해 반응에 의한 것으로 보고하고 있다.
본 연구에서 CO:H2O의 비율이 1:2에서 1:3으로 증가함에 따라 CO 전환율이 증가하고 생성 가스 중 H2 가스의 비율이 증가하는 것은 Fig. 1에 나타낸 바와 같이 WGS 반응의 이론적 CO 평형 전환율이 CO:H2O 비율이 증가함에 따라 증가하는 경향을 그대로 보여주는 것으로 판단되며, 생성 가스 중 H2 가스 비율의 증가는 촉매에서의 물 분해 반응에 의한 것으로 판단된다.
이상의 결과로부터 WGS 반응을 HTS 반응과 LTS 반응을 연속적으로 진행함으로써 높은 CO 전환율에 도달할 수 있음을 확인할 수 있었다. 또한 본 논문에서 사용한 상용 촉매를 이용한 WGS 반응은 수소 제조와 CO 전환율 면에서 CO:H2O의 비율 1:3이 가장 적절하다는 것을 알 수 있다.
4. 결 론
본 연구에서는 폐플라스틱 가스화에서 발생할 것으로 예상되는 가스를 모사하고 상용 촉매를 활용하여 WGS 반응을 진행하였다. WGS 반응은 CO:H2O의 비율을 1:2, 1:2.5, 1:3으로 하여 HTS 반응과 LTS 반응을 연속적으로 진행하였고, CO:H2O 비율에 따른 H2 증가율과 CO 전환율을 평가하여 다음과 같은 결론을 얻었다.
1) WGS 반응 전체 시간 동안 반응 가스인 CO와 생성 가스인 H2와 CO2의 평균 조성은 1:2의 CO:H2O 비율에서 1.5%, 46.8%, 24.5%를, 1:2.5의 CO:H2O 비율에서 0.4%, 56.3%, 28.5%를, 1:3의 CO:H2O 비율에서 0.1%, 55.8%, 29.3%를 보였다.
2) H2 증가율은 CO:H2O의 비율 1:3에서 가장 높았으며, 다음으로 1:2.5의 CO:H2O 비율, 1:2의 CO:H2O 비율의 순서로 높았다.
3) CO 전환율은 각 CO:H2O 비율에서 15분 정도의 WGS 반응 시간에서 97% 이상의 높은 값을 보였다.
4) WGS 반응을 HTS 반응과 LTS 반응을 연속적으로 진행함으로써 97% 이상의 높은 CO 전환율에 도달할 수 있음을 확인할 수 있었다.
5) WGS 반응은 수소 제조와 CO 전환율 면에서 CO:H2O의 비율 1:3이 가장 적절하다는 것을 알 수 있었다.
Acknowledgments
본 연구는 환경부와 한국환경산업기술원의 “폐플라스틱 활용 원료‧연료화 기술개발 사업(No. 2022003490001)”으로 추진된 것으로 환경부와 한국환경산업기술원의 재정 지원에 감사드립니다.
References
-
Y. Sun, S. Liu, P. Wang, X. Jian, X. Liao, and W. Q. Chen, “China's roadmap to plastic waste management and associated economic costs”, Journal of Environmental Management, Vol. 309, 2022, pp.114686.
[https://doi.org/10.1016/j.jenvman.2022.114686]

- J. S. Choi, “Development of high purity styrene monomer production technology through continuous pyrolysis process using low energy of waste polystyrene”, In: 2022 Autumn Conference of Korea Society of Environmental & Energy Engineers; 2022 Dec 8-9; Jeju, Korea.
-
H. H. Shah, M. Amin, A. Iqbal, I. Nadeem, M. Kalin, A. M. Soomar, and A. M. Galal, “A review on gasification and pyrolysis of waste plastics”, Frontiers in Chemistry, Vol. 10, 2022, pp. 960894.
[https://doi.org/10.3389/fchem.2022.960894]

-
D. Saebea, P. Ruengrit, A. Arpornwichanop, and Y. Patcharavorachot, “Gasification of plastic waste for synthesis gas production”, Energy Reports, Vol. 6, Suppl 1, 2020, pp. 202-207.
[https://doi.org/10.1016/j.egyr.2019.08.043]

-
C. J. Moore, “Synthetic polymers in the marine environment: a rapidly increasing, long-term threat”, Environmental Research, Vol. 108, No. 2, 2008, pp. 131-139.
[https://doi.org/10.1016/j.envres.2008.07.025]

-
F. D. B. de Sousa, “Management of plastic waste: a bibliometric mapping and analysis”, Waste Management & Research, Vol. 39, No. 5, 2021, pp. 664-678.
[https://doi.org/10.1177/0734242X21992422]

-
C. Wu and P. T. Williams, “Hydrogen production by steam gasification of polypropylene with various nickel catalysts ”, Applied Catalysis B: Environmental, Vol. 87, No. 3-4, 2009, pp. 152-161.
[https://doi.org/10.1016/j.apcatb.2008.09.003]

-
M. He, B. Xiao, Z. Hu, S. Liu, X. Guo, and S. Luo, “Syngas production from catalytic gasification of waste polyethylene: influence of temperature on gas yield and composition”, International Journal of Hydrogen Energy, Vol. 34, No. 3, 2009, pp. 1342-1348.
[https://doi.org/10.1016/j.ijhydene.2008.12.023]

-
V. Wilk and H. Hofbauer, “Conversion of mixed plastic wastes in a dual fluidized bed steam gasifier”, Fuel, Vol. 107, 2013, pp. 787-799.
[https://doi.org/10.1016/j.fuel.2013.01.068]

-
C. Berrueco, F. J. Mastral, E. Esperanza, and J. Ceamanos, “Production of waxes and tars from the continuous pyrolysis of high density polyethylene. Influence of operation variables”, Energy & Fuels, Vol. 16, No. 5, 2002, pp. 1148-1153.
[https://doi.org/10.1021/ef020008p]

-
M. Arabiourrutia, G. Elordi, G. Lopez, E. Borsella, J. Bilbao, and M. Olazar, “Characterization of the waxes obtained by the pyrolysis of polyolefin plastics in a conical spouted bed reactor”, Journal of Analytical and Applied Pyrolysis, Vol. 94, 2012, pp. 230-237.
[https://doi.org/10.1016/j.jaap.2011.12.012]

-
M. del Remedio Hernández, A. Gómez, Á. N. García, J. Agulló, and A. Marcilla, “Effect of the temperature in the nature and extension of the primary and secondary reactions in the thermal and HZSM-5 catalytic pyrolysis of HDPE”, Applied Catalysis A: General, Vol. 317, No. 2, 2007, pp. 183-194.
[https://doi.org/10.1016/j.apcata.2006.10.017]

-
G. Elordi, M. Olazar, G. Lopez, M. Artetxe, and J. Bilbao, “Continuous polyolefin cracking on an HZSM-5 zeolite catalyst in a conical spouted bed reactor”, Industrial & Engineering Chemistry Research, Vol. 50, No. 10, 2011, pp. 6061-6070.
[https://doi.org/10.1021/ie2002999]

-
Y. Mo, L. Zhao, Z. Wang, C. L. Chen, G. Y. A. Tan, and J. Y. Wang, “Enhanced styrene recovery from waste polystyrene pyrolysis using response surface methodology coupled with Box-Behnken design”, Waste Management, Vol. 34, No. 4, 2014, pp. 763-769.
[https://doi.org/10.1016/j.wasman.2014.01.005]

-
G. Lopez, M. Artetxe, M. Amutio, J. Bilbao, and M. Olazar, “Thermochemical routes for the valorization of waste polyolefinic plastics to produce fuels and chemicals. A review”, Renewable and Sustainable Energy Reviews, Vol. 73, 2017, pp. 346-368.
[https://doi.org/10.1016/j.rser.2017.01.142]

-
G. Lopez, M. Artetxe, M. Amutio, J. Alvarez, J. Bilbao, and M. Olazar, “Recent advances in the gasification of waste plastics. A critical overview”, Renewable and Sustainable Energy Reviews, Vol. 82, Pt. 1, 2018, pp. 576-596.
[https://doi.org/10.1016/j.rser.2017.09.032]

-
E. Baraj, K. Ciahotný, and T. Hlinčík, “The water gas shift reaction: catalysts and reaction mechanism”, Fuel, Vol. 288, 2021, pp. 119817.
[https://doi.org/10.1016/j.fuel.2020.119817]

-
H. S. Na, D. W. Jeong, W. J. Jang, Y. L. Lee, and H. S. Roh, “A study on Cu based catalysts for water gas shift reaction to produce hydrogen from waste-derived synthesis gas”, Jornal of Hydrogen and New Energy, Vol. 25, No. 3, 2014, pp. 227-233.
[https://doi.org/10.7316/KHNES.2014.25.3.227]

-
R. J. B. Smith, M. Loganathan, and M. S. Shantha, “A review of the water gas shift reaction kinetics”, International Journal of Chemical Reactor Engineering, Vol. 8, No. 1, 2010, pp. 1-32.
[https://doi.org/10.2202/1542-6580.2238]

-
W. H. Chen, T. C. Hsieh, and T. L. Jiang, “An experimental study on carbon monoxide conversion and hydrogen generation from water gas shift reaction”, Energy Conversion and Management, Vol. 49, No. 10, 2008, pp. 2801-2808.
[https://doi.org/10.1016/j.enconman.2008.03.020]