탄소중립 메탄 생산을 위한 열화학적 이산화탄소 메탄화 공정의 단열 반응기 성능 분석
2023 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
Development of carbon-neutral fuel production technologies to solve climate change issues is progressing worldwide. Among them, methane can be produced through the synthesis of hydrogen produced by renewable energy and carbon dioxide captured through a CO2 methanation reaction, and the fuel produced in this way is called synthetic methane or e-methane. The CO2 methanation reaction can be conducted via biological or thermochemical methods. In this study, a 30 Nm3/h thermochemical CO2 methanation process consisting of an isothermal reactor and an adiabatic reactor was used. The CO2 conversion rate and methane concentration according to the temperature measurement results at the center and outside of the adiabatic reactor were analyzed. The gas flow into the adiabatic reactor was found to reach equilibrium after about 1.10 seconds or more by evaluating the residence time. Furthermore, experimental and analysis results were compared to evaluate performance of the reactor.
Keywords:
Carbon neutral methane, Thermochemical methanation, Adiabatic reactor, Process simulation, Performance analysis키워드:
탄소 중립 메탄, 열화학적 메탄화, 단열 반응기, 공정 시뮬레이션, 성능 분석1. 서 론
현재 인류가 직면한 기후 변화에 대응하기 위해 carbon capture, utilization and storage (CCUS) 기술 적용 및 재생에너지 보급 확대에 대한 요구가 증가하고 있다. CCUS 기술은 재생에너지 발전과 함께 탄소중립을 위해 반드시 필요한 기술이지만, CCUS 기술의 적용을 통한 탄소중립 달성은 전 세계적인 협력과 정책의 급격한 변화 없이는 불가능하다1). 또한 CCUS 기술 확산 및 투자를 위해서는 기술 혁신과 기존 기술 개선을 통해 프로젝트 비용을 절감하는 것이 필요하다. 그 방법으로 포집된 CO2를 고부가가치 물질로 활용하게 되면 CO2 포집 비용을 상쇄할 수 있다2). CO2를 고부가가치 물질로 활용하기 위한 방법으로는 CH4, CH3OH 등의 연료로 활용하는 방법이 있는데3), 여기에 필요한 H2는 태양광, 풍력 등 재생에너지로 생산한 전기를 통해 물을 전기분해하여 얻을 수 있다.
재생에너지원을 이용한 수소 생산은 재생에너지의 간헐성 및 불확실성을 보완할 수 있는 에너지 저장 기술로 주목받고 있다. 하지만 H2 기체의 낮은 에너지 밀도로 인해 해외에서 그린수소를 수입해야 하는 경우, 저장 및 수송 측면에서 액화 H2나 liquid organic hydrogen carrier, 액화 NH3, CH4, CH3OH 등으로 전환이 필요하다4). 그중 CO2 메탄화 공정을 통해 생산할 수 있는 CH4는 천연가스의 주성분이며, 그렇기 때문에 기존의 천연가스 공급망과 활용 방법을 사용할 수 있다는 장점을 가진다. 또한 2030년까지 CO2 메탄화 시장은 CH4 생산량 기준 연간 4,000,000,000-65,000,000,000 m3 사이로 성장할 것으로 예상된다5). H2가 향후 CH4가 담당하는 에너지 수요를 충족할 가능성이 있지만 CO2 메탄화 공정에서 생산된 메탄은 현재 사용 중인 천연가스를 직접 대체할 수 있고, CO2 포집 과정을 포함하고 있어 탄소중립적인 측면에서는 무시할 수 없다.
탄소중립 CH4를 생산할 수 있는 CO2 메탄화 기술은 크게 니켈 기반 촉매를 활용하는 열화학적 메탄화(technology readiness level [TRL] 6-7)와 미생물을 생체촉매로 활용하는 생물학적 메탄화(TRL 3-6), 태양광 또는 인공 조명과 광촉매를 활용하는 광촉매 메탄화(TRL 3-5)로 구분할 수 있다. 이 중 기술적으로 가장 성숙한 열화학적 메탄화를 본 연구의 대상으로 하였다.
열화학적 메탄화 기술의 핵심은 촉매 반응을 통해 CO2를 CH4로 환원시키는 것이다. 이때 공정의 효율을 결정하는 반응 속도와 선택도를 향상시키기 위해서는 높은 활성도를 지닌 촉매가 필요하다6). 또한 Table 17)의 반응 엔탈피(ΔHR298K)에서 확인할 수 있듯이 촉매 반응은 열역학적으로 저온에서 유리하고, 고온(350℃ 이상)에서는 역수성 가스 전환 반응이 진행될 수 있다8). 따라서 CO2 메탄화 공정은 촉매와 더불어 반응 온도를 유지, 제어할 수 있는 반응기 설계가 중요하다. 이를 위해 외부와의 열 교환이 차단된 단열 반응기 및 반응 온도를 유지시킬 수 있는 등온 반응기 등 특수한 형태의 반응기 설계가 요구되고, 따라서 다양한 반응기를 설계하고 성능을 분석하는 연구들이 수행되었다.
Schildhauer와 Biollaz9)는 저온 조건의 단열 고정층 반응기와 유동층 반응기, 금속 모노리스 반응기를 시뮬레이션했으며, 유동층 반응기 내부의 촉매 입자를 이동시키면 불포화 탄화수소의 반응이 일어날 수 있음을 확인하였다.
Hwang과 Smith10)는 메탄화 공정의 불균일 촉매 반응기를 설계하기 위한 연구를 수행하였으며, 반응기 내에 별도의 불균일 촉매 구역을 설치하면 균일한 촉매를 사용하는 반응기보다 더 높은 촉매 성능을 달성할 수 있음을 확인하였다.
Redondo 등11)은 반응기 설계의 성능을 시뮬레이션 및 실험을 통해 평가하였으며, 단열 반응기에 비해 반응기를 냉각시킬 수 있는 shell and tube 방식의 반응기 수율이 공간 속도에 따라 각각 평균 36%, 27% 향상되었음을 확인하였다.
선행연구 결과를 통해 반응기 설계에 따라 촉매 및 공정 성능이 달라질 수 있음을 확인하였다. 본 연구에서는 등온 반응기와 단열 반응기로 구성된 30 Nm3/h급 CO2 메탄화 플랜트를 대상으로 단열 반응기 내부 촉매층의 온도 분포에 따른 CH4 농도를 측정하였고, 측정 결과와 평형 조건 해석 결과의 비교를 통해 단열 반응기의 성능을 분석하였다.
2. 실험 및 시뮬레이션 방법
2.1 30 Nm3/h급 CO2 메탄화 공정
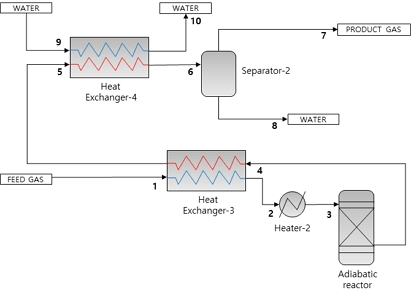
본 연구의 대상 설비인 30 Nm3/h급 CO2 메탄화 파일럿 플랜트 제작을 위한 공정 흐름도를 Fig. 1(a)에 도시하였고, 시뮬레이션을 위한 공정 흐름도를 Fig. 1(b)에 도시하였다. Fig. 1(b)의 스트림 정보들은 appendix의 Tables A1, A2에서 확인할 수 있다. 일반적으로 CO2 메탄화 공정은 H2와 CO2를 단열 혹은 등온 반응기에 공급하여 촉매 반응을 통해 Table 1의 반응식과 같이 메탄과 물로 전환시킨다. CO2 메탄화는 강한 발열 반응이므로 열이 발생하게 되고, 반응기 종류에 따라 단열 반응기는 상대적으로 저온의 생산 가스를 재순환하여 온도를 제어하고, 등온 반응기는 포화수 혹은 포화증기를 통해 반응기에서 발생된 열을 흡수하여 온도를 제어한다12). 이와 같이 합성 과정에서 발생하는 열에너지를 효율적으로 회수하는 것이 전체 공정의 열효율을 증가시키는 방안이다. 본 연구의 대상 공정에 대한 설명은 다음과 같다. H2와 CO2는 Fig. 2에 나타낸 등온/단열 반응기의 작동 압력인 11 barg까지 압축되며, 등온 반응기에서 배출되는 생산 가스로부터 현열을 회수하기 위해서 열 교환기(heat exchanger-1)에 공급된다. 열 교환기에 의해 예열된 수소/이산화탄소 혼합 가스는 등온 반응기에 공급되며, 유입 가스의 온도 유지를 위해서 전기 히터(heater-1)가 설치되어 반응기에 공급되는 가스의 온도를 유지한다. 전기 히터가 물/수증기 혼합 열매체에 열에너지를 공급하고 공급 설비의 압력을 조절하여 반응기의 반응 온도를 유지시킨다. 등온 반응기 내부에서 수소와 이산화탄소의 강한 발열 반응으로 인해 생성된 열은 물/수증기 혼합물로 이루어진 열매체가 흡수한다. CO2 메탄화 과정에서는 수소와 이산화탄소가 반응하여 메탄과 수분으로 전환되며, 이러한 수분은 역수성 가스 전환 반응 혹은 메탄 순도 저하를 야기할 수 있기 때문에 사전에 제거되어야 한다. 이를 위하여 수분은 냉각수를 이용한 냉각용 열 교환기(heat exchanger-2)에서 냉각되어 응축기(separator-1)에서 응축된다. 등온 반응기에서 생성된 수분 제거를 위해서 냉각된 가스는 단열 반응기로 공급되기 위해서 단열 반응기에서 반응이 완료된 가스로부터 현열을 회수하여 단열 반응기로 공급되며, 잔여 수소와 이산화탄소가 반응하여 최종적으로 98% 농도를 가지는 메탄이 생성된다. 단열 반응기에서 반응된 가스의 수분을 제거하기 위해 heat exchanger-3에서 단열 반응기 반응열을 공정 가스 간 열 교환을 통해 회수하고, heat exchanger-4에서 상온의 냉각수를 사용하여 수분을 응축시킨다.
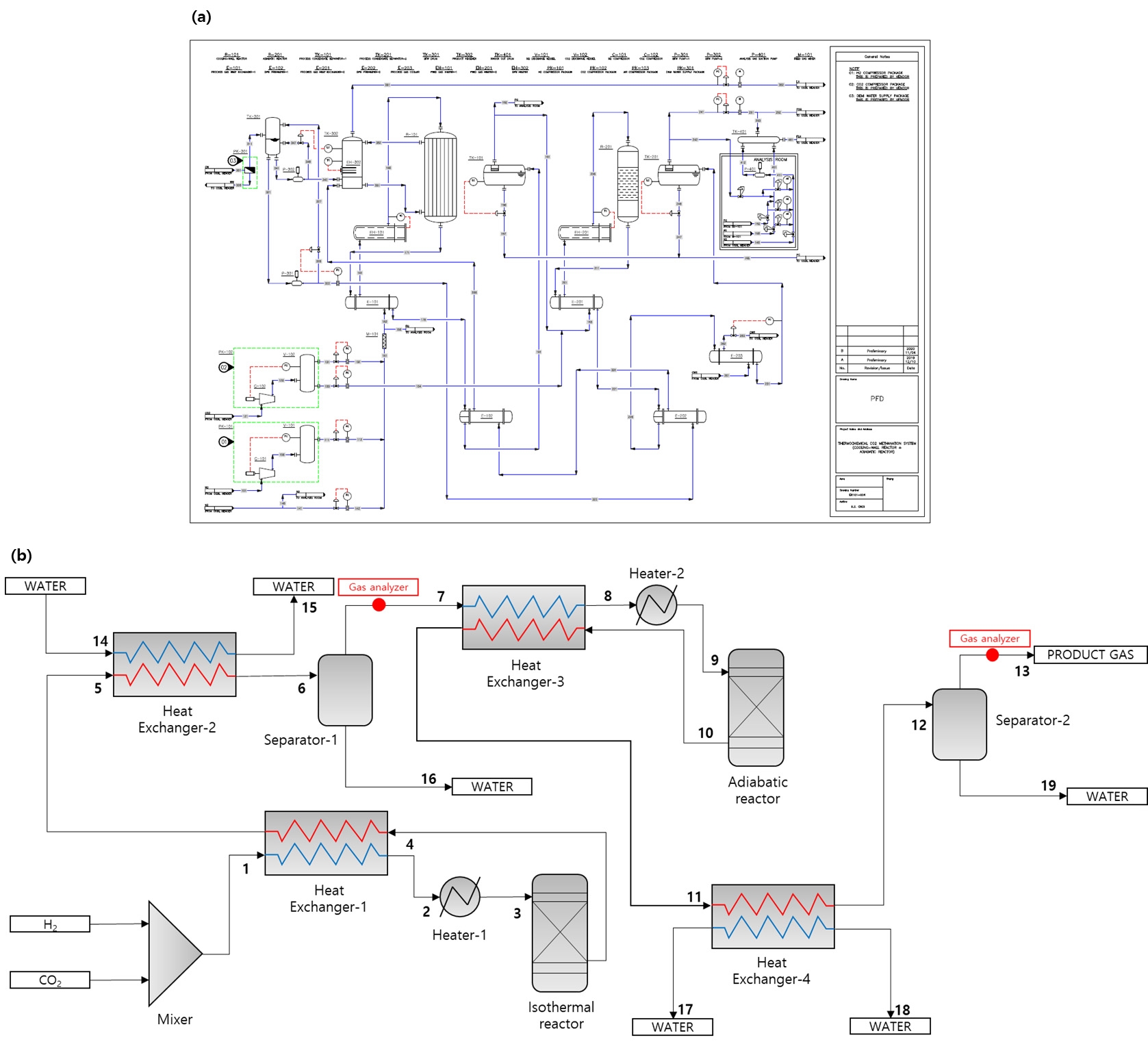
30 Nm3/h thermochemical CO2 methanation process. (a) Process flow diagram for building a pilot plant, (b) process flow diagram for simulation

Reactors of 30 Nm3/h thermochemical CO2 methanation process. (a) Isothermal reactor upper side, (b) isothermal reactor lower side, (c) adiabatic reactor upper side, (d) adiabatic reactor lower side
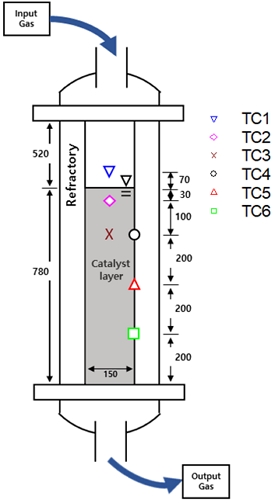
단열 반응기에 공급되는 합성 가스를 분석에 활용하기 위해 응축수가 분리된 separator-1 후단의 가스 조성과 최종 생산물인 separator-2 후단의 가스 조성을 가스 분석기를 사용하여 실시간으로 분석하였다. 또한 각 분석기 전단에는 오리피스 방식의 유량계가 설치되어 1차 반응기와 2차 반응기 후단에서 생성되는 가스의 유량을 측정하였다. 등온 반응기 및 단열 반응기에는 Table 2와 같이 펠릿 형태의 Ni 기반 촉매13)를 사용하였다. 단열 반응기에는 Fig. 3에 나타난 바와 같이 반응기 하단에서 780 mm 높이까지 촉매를 채웠으며, 촉매층 중심부 및 표면부의 온도를 측정할 수 있도록 열전대를 설치하였다.
2.2 실험 조건 및 방법
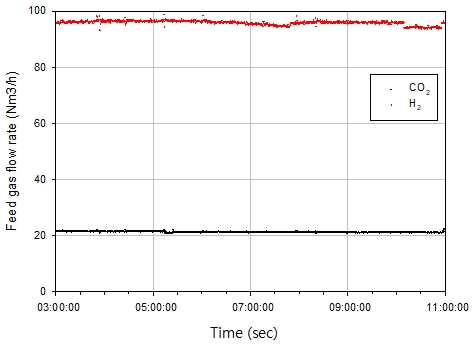
실험 조건으로 반응기 예열을 위해 불활성 기체인 N2를 공급하여 정상 운전 온도인 350℃까지 가열하였다. 이때 전체 공정 압력은 공정 후단의 압력 조절 밸브를 활용하여 11 barg까지 높였다. Fig. 3의 TC6 온도가 250℃에 도달하였을 때부터 H2를 1시간 30분 동안 N2:H2=4:1의 비율로 공급하여 촉매 환원을 진행하였다. 촉매 환원 종료 이후 CO2 메탄화 반응 몰비인 H2:CO2=4:1 이상의 비율로 가스를 공급하였다. Fig. 4에서 확인할 수 있듯이 정상 운전 조건에서 공급 가스의 유량은 8시간 평균 H2 96 Nm3/h, CO2 22 Nm3/h이다. 이후 1차 반응기에서 배출된 합성 가스를 heater-2를 통해 250℃로 단열 반응기에 공급하였다. 단열 반응기 공급 가스, 생산 가스, 단열 반응기 열전대의 온도는 1초 간격으로 8시간 동안 측정하였으며, 분석에 활용한 데이터 간격은 300초이다.
2.3 시뮬레이션 조건 및 방법
Fig. 5와 같이 단열 반응기의 시뮬레이션을 위해 상용 프로그램14)을 이용하여 공정 모사를 수행하였다. Fig. 5의 stream-1에 모사된 단열 반응기 공급 공정 가스 조건은 8시간 동안 진행한 실험 결과의 평균값인 CH4 농도 58%, H2 농도 32%, CO2 농도 10%, 36 Nm3/h의 유량을 갖는 가스를 적용하였다. 그리고 합성 가스를 40℃로 냉각하여 응축기를 통해 응축수를 분리한다고 가정하였다. 단열 반응기는 평형 상태에서 깁스 자유에너지(Gibbs free energy) 변화가 없는 상태의 평형 조성을 반응 후 생성물로 계산하는 깁스 반응기(Gibbs reactor)를 적용하였다. 깁스 반응기는 실제 반응이 개시되기 위한 활성화에너지를 고려하지 않기 때문에 실제 실험에 사용한 촉매의 활성 온도인 180℃ 이상에서 시뮬레이션을 수행하였다. 반응기 공급 가스의 온도, 유량, 조성, 압력을 적용하여 평형 반응 이후 합성 가스의 온도 변화를 확인하였다. 지배 방정식으로 Peng-Robinson 상태 방정식15)을 시뮬레이션에 적용하였다. Fig. 5의 stream-3의 온도를 변수로 설정해 180-600℃ 범위에서 시뮬레이션하였고, stream-7의 압력을 변수로 설정해 10-30 barg 범위에서 시뮬레이션하였다. 이를 통해 열화학적 평형 상태에서 CO2 메탄화 공정의 반응기 입구(stream-3) 및 반응기 출구(stream-4)의 온도에 따른 생산 가스(stream-7) 조성의 상관관계를 도출하였고, 이를 실험 결과와 비교 분석하였다.
3. 결과 및 고찰
3.1 시뮬레이션 결과 분석
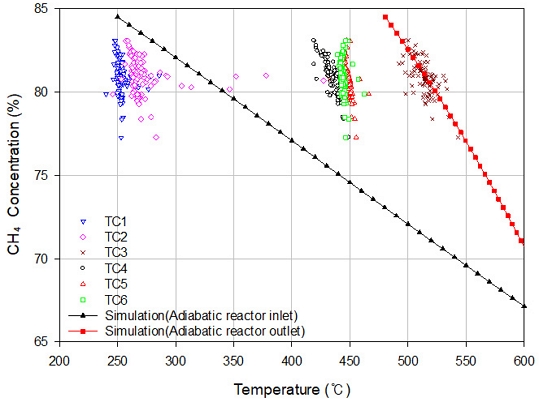
CO2 메탄화 반응은 촉매 활성 온도 이상의 저온 반응 조건에서 유리하고, 반응 압력이 높을수록 메탄화 반응에 유리하다고 선행연구를 통해 알려져 있다13). Fig. 6은 단열 반응기의 온도 및 압력에 따른 생성물 CH4 농도를 도시한 그림이다. 시뮬레이션 결과에서 CH4 농도는 30 barg, 180℃에서 90.7%로 최댓값임을 확인하였고, 10 barg, 600℃ 조건에서 67.1%로 최솟값임을 확인하였다. 실험 조건인 공정 압력 11 barg의 시뮬레이션 결과를 3.3장의 실험 및 시뮬레이션 결과 비교에 활용하였다.
3.2 실험 결과 분석
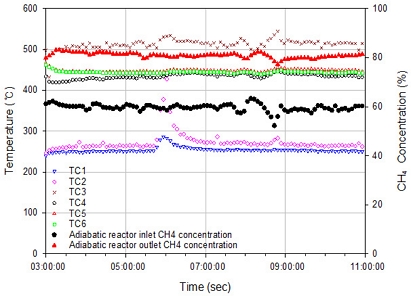
Fig. 6에는 8시간 동안 측정한 단열 반응기 온도의 변화와 해당 시점의 단열 반응기 전후단 가스의 CH4 농도를 도시하였다. 촉매와 공급 가스가 가장 먼저 만나는 지점에서 수직으로 130 mm 떨어져 있는 TC3의 온도가 상대적으로 가장 높았고, 이는 온도가 가장 낮은 TC1과 평균 약 250℃의 차이를 보였다. TC2는 평균 약 265℃에서 상대적으로 일정한 온도를 보였다. 실험 시작 3시간 후 온도가 430℃까지 올라갔지만 이후 1시간에 걸쳐 기존 온도 수준까지 떨어졌다. 촉매와 내화재 경계에 설치된 열전대(TC4, TC5, TC6)는 상대적으로 수직 방향 깊이에 따라 온도 변화가 크지 않았다. 반응기 가장 아래쪽에 위치한 TC6의 온도가 TC3보다 낮은 경향성을 보였다. 이를 통해 본 실험 조건에서 TC3 부근의 촉매층 상단에서 메탄화 반응이 상대적으로 활발하게 일어남을 알 수 있었다.
단열 반응기에 공급되는 합성 가스의 CH4 농도가 낮아지면 단열 반응기에 부착된 열전대의 온도가 상승하는 경향을 확인할 수 있다. 이를 통해 공급 가스의 CH4 농도가 낮아지면 메탄화 반응이 더 활발하게 일어난다고 분석할 수 있다. 이러한 분석 결과는 TC3의 온도 변화와 공급 가스의 CH4 농도 변화를 비교해 보았을 때 명확하게 알 수 있다. 또한 TC3의 온도가 증가할수록 단열 반응기 후단의 CH4 농도는 낮아졌다. 이는 반응 온도가 낮을수록 열화학적 CO2 메탄화 반응의 열화학적 평형 상태에 가까워지고, 반응기 온도 제어가 열화학적 메탄화 공정 생성물의 CH4 농도에 영향을 미치는 주요 변수임을 의미한다. 반응기 공급 가스의 CH4 농도가 감소하면 후단 생산 가스의 CH4 농도 또한 감소하는 경향을 보였다. 이는 단열 반응기의 성능만큼 CO2 메탄화 반응이 이루어졌음을 의미한다. 이렇듯 반응기 온도와 CH4 농도, 반응기 전후단 합성 가스 농도의 상대적 비교를 통해 단열 반응기의 성능을 평가하였다.
3.3 실험 및 시뮬레이션 결과 비교 분석
Fig. 7에 단열 반응기 온도와 CH4 농도의 상관관계를 도시하였다. 이때 단열 반응기 온도와 CH4 농도는 촉매층과 내화재에 부착된 열전대, 분석기를 통해 측정하였다. 세모 선은 실험 결과와 동일한 온도, 압력, 조성의 공급 가스 조건을 Fig. 5의 stream-1에 적용하여 시뮬레이션했을 때 단열 반응기 입구 온도(steam-3)와 생산물 CH4 농도(stream-7)의 상관관계이다. 네모 선은 세모 선과 같은 시뮬레이션 조건에서 반응기 출구 온도(stream-4)와 생산물 CH4 농도(stream-7)의 상관관계이다. 반응기 온도와 CH4 농도 사이의 상관관계를 통해 유사한 반응기 온도 조건에서도 CH4 농도가 약 15%까지 차이가 날 수 있음을 확인하였다. TC3은 열화학적 평형 상태 온도 조건의 동일한 CH4 농도에서 ±25℃ 범위의 분포를 보여준다. 수직 방향으로 같은 깊이에서 수평 방향으로 75 mm 떨어진 TC3과 TC4의 온도 분포를 비교하였을 때 촉매층 중심과 내화재 사이의 온도 차이는 약 80℃임을 알 수 있다. 시뮬레이션 결과에서 반응기 입구 및 출구의 온도 차이는 반응기 입구의 CH4 농도가 감소함에 따라 줄어들었다. 그리고 TC3의 온도-CH4 농도 분포가 시뮬레이션 결과인 네모 선의 추세와 가장 유사함을 확인하였다. 네모 선은 CO2 메탄화 공정의 열화학적 평형 상태의 온도-CH4 농도를 의미한다. 이를 통해 반응기에 공급된 합성 가스는 촉매층의 TC3 위치까지 도달했을 때 CO2 메탄화 반응이 열화학적 평형 상태에 도달하였다고 평가할 수 있다. 이는 단열 반응기 유입 가스 유량과 단열 반응기의 기하학적 인자를 고려하여 체류 시간을 계산하였을 때 유입 가스가 약 1.10초 이상에서 평형 상태에 도달한 것을 의미한다. 또한 합성 가스가 평형 상태에 도달하였기 때문에 본 연구의 대상 설비인 30 Nm3/h급 CO2 메탄화 플랜트의 단열 반응기가 합리적으로 설계되었다고 평가할 수 있다.
4. 결 론
본 연구에서는 30 Nm3/h급 열화학적 메탄화 파일럿 플랜트의 단열 반응기 성능 평가를 위해 실험 결과와 상용 프로그램을 활용한 공정 시뮬레이션 결과를 비교 분석하였다. 비교 분석을 통해 본 연구에서 활용한 열화학적 CO2 메탄화 공정 단열 반응기의 특성을 확인할 수 있었고 다음과 같은 결과를 얻을 수 있었다.
1) 같은 단열 반응기 내에서도 촉매층 위치에 따라 최대 약 250℃의 온도 차이가 날 수 있음을 확인하였다.
2) 시뮬레이션에서 CH4 농도 58%, H2 농도 32%, CO2 농도 10%, 36 Nm3/h의 유량을 갖는 합성가스를 단열 반응기에 공급하였을 때 생성물의 CH4 농도는 67.1-90.7%의 범위를 보였다.
3) 본 연구의 실험 조건에서 단열 반응기에 평균 약 60%의 CH4 농도의 합성 가스를 공급했을 때 생산된 합성 가스의 CH4 농도는 평균 약 80%를 달성하였다.
4) 열화학적 CO2 메탄화 공정에서 단열 반응기 온도가 낮을수록 CO2 전환율과 CH4 선택도가 증가하였다.
5) 실험 결과 유사한 조건의 단열 반응기에서도 반응기 후단 생산 가스의 CH4 농도가 약 15%까지 차이가 날 수 있음을 확인하였다.
6) 단열 반응기 유입 가스 유량과 단열 반응기의 기하학적 인자를 고려하였을 때 유입 가스가 약 1.10초 이상의 체류 시간에서 평형 상태에 도달하였다.
7) 촉매와 반응기 설계 인자는 상호 영향을 받는다. 따라서 상업용 설비를 구축하기 전에 촉매 성능에 대한 랩 스케일의 실험 결과(반응 온도, 반응 시간 등)를 기반으로 사용자가 원하는 성능이 고려된 공정 시뮬레이션 결과를 통해 반응기 설계 인자(타입, 크기 등)를 도출해야 한다고 사료된다.
Acknowledgments
본 연구는 2019, 2021년도 산업통상자원부의 재원으로 한국에너지기술평가원(KETEP)의 지원을 받아 수행한 연구 과제임(No.2019281010007B, No.20218801010030).
References
-
E. Martin-Roberts, V. Scott, S. Flude, G. Johnson, R. S. Haszeldine, and S. Gilfillan, “Carbon capture and storage at the end of a lost decade”. One Earth, Vol. 4, No. 11, 2021, pp. 1569-1584.
[https://doi.org/10.1016/j.oneear.2021.10.002]

-
C. Hepburn, E. Adlen, J. Beddington, E. A. Carter, S. Fuss, N. M. Dowell, J. C. Minx, P. Smith, and C. K. Williams, “The technological and economic prospects for CO2 utilization and removal”, Nature, Vol. 575, 2019, pp. 87-97.
[https://doi.org/10.1038/s41586-019-1681-6]

- International Energy Agency (IEA), “World energy outlook 2022”, IEA, 2022. Retrieved from https://www.iea.org/reports/world-energy-outlook-2022, .
-
J. Kim, C. Huh, and Y. Seo, “End-to-end value chain analysis of isolated renewable energy using hydrogen and ammonia energy carrier”, Energy Conversion and Management, Vol. 254, 2022, pp. 115247.
[https://doi.org/10.1016/j.enconman.2022.115247]

- Global CO2 Initiative, “Global roadmap for implementing CO2 utilization”, Global CO2 Initiative, 2016. Retrieved from https://deepblue.lib.umich.edu/bitstream/handle/2027.42/150624/CO2U_Roadmap_FINAL_2016_12_07%28GCI%29.pdf?sequence=1&isAllowed=y, .
-
J. Ashok, S. Pati, P. Hongmanorom, Z. Tianxi, C. Junmei, and S. Kawi, “A review of recent catalyst advances in CO2 methanation processes”, Catalysis Today, Vol. 356, 2020, pp. 471-489.
[https://doi.org/10.1016/j.cattod.2020.07.023]

-
Y. Xing, Z. Ma, W. Su, Q. Wang, X. Wang, and H. Zhang, “Analysis of research status of CO2 conversion technology based on bibliometrics”, Catalysts, Vol. 10, No. 4, 2020, pp. 370.
[https://doi.org/10.3390/catal10040370]

-
D. Han and Y. Baek, “A study on the synthesis of CH4 from CO2 of biogas using 40 wt% Ni-Mg catalyst: characteristic comparison of commercial catalyst and 40 wt% Ni catalyt”, Journal of Hydrogen and New Energy, Vol. 32, No. 5, 2021, pp. 388-400.
[https://doi.org/10.7316/KHNES.2021.32.5.388]

-
J. Schildhauer and S. M. A. Biollaz, “Reactors for catalytic methanation in the conversion of biomass to synthetic natural gas (SNG)”, Chimia, Vol. 69, No. 10, 2015, pp. 603-607.
[https://doi.org/10.2533/chimia.2015.603]

-
S. Hwang and R. Smith, “Optimum reactor design in methanation processes with nonuniform catalysts”, Chemical Engineering Communications, Vol. 196, No. 5, 2008, pp. 616-642.
[https://doi.org/10.1080/00986440802484465]

-
B. Redondo, M. T. Shah, V. K. Pareek, R. P. Utikar, P. A. Webley, J. Patel, W. J. Lee, and T. Bhatelia, “Intensified isothermal reactor for methanol synthesis”, Chemical Engineering and Processing-Process Intensification, Vol. 143, 2019, pp. 107606.
[https://doi.org/10.1016/j.cep.2019.107606]

-
H. Lee, S. H. Kim, and Y. Yoo, “Design of cooling system for thermochemical CO2 methanation isothermal reactor”, Journal of Hydrogen and New Energy, Vol. 33, No. 4, 2022, pp. 451-461.
[https://doi.org/10.7316/KHNES.2022.33.4.451]

-
J. Deng, K. Bu, Y. Shen, X. Zhang, J. Zhang, K. Faungnawakij, and D. Zhang, “Cooperatively enhanced coking resistance via boron nitride coating over Ni-based catalysts for dry reforming of methane”, Applied Catalysis B: Environmental, Vol. 302, 2022, pp. 120859.
[https://doi.org/10.1016/j.apcatb.2021.120859]

- Aspen Tech, “AspenONE V11 getting started guide”, Aspen Tech, 2018. Retrieved from https://www.aspentech.com/en/getting-started-guides, .
-
D. Y. Peng and D. B. Robinson, “A new two-constant equation of state”, Industrial & Engineering Chemistry Fundamentals, Vol. 15, No. 1, 1976, pp. 59-64.
[https://doi.org/10.1021/i160057a011]