다양한 청록수소 생산 공정에 대한 경제성 분석
2023 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
Hydrogen production can be classified based on the energy source, primary reactor type, and whether or not it emits carbon dioxide. Utilizing color representation proves to be an effective means of expressing these distinctive characteristics. Among the various clean hydrogen production techniques, there has been a growing interest in turquoise hydrogen production, which involves the decomposition of methane or other fossil fuels. This method offers advantages in terms of large-scale production and cost reduction through the sale of solid-carbon byproduct. In this study, an extensive literature review was conducted to select and analyze several promising candidates for turquoise hydrogen production processes. The efficiency and economics of these processes were evaluated using stream data reported in the literature sources. The findings indicate that the levelized cost of hydrogen production (LCOH) is significantly influenced by the sales of byproducts, specifically the solid-carbon and carbon monoxide byproducts.
Keywords:
Hydrogen production, Methane decomposition, Turquoise hydrogen, LCOH, Economic analysis키워드:
수소 생산, 메탄 열분해, 청록수소, 균등화 수소 생산 비용, 경제성 분석1. 서 론
급격히 진행되는 지구온난화와 기후 변화를 억제하기 위해 세계 각국은 온실가스 배출을 줄이기 위한 정책 수립과 기술 개발을 활발히 진행하고 있으며1), 온실가스 중 가장 많은 비중을 차지하는 이산화탄소2) 배출 저감을 우선적으로 추진하고 있다. 우리나라를 비롯하여 전 세계 많은 국가에서는 다양한 저감 수단을 통해 연평균 3.5%의 이산화탄소 배출을 저감하고, 지구 온도 상승을 1.5℃ 이하로 제어하며, 2050년경에는 탄소 중립 에너지 체계를 구축하는 것을 목표로 하고 있다3). 화석연료 사용으로 인한 이산화탄소 배출은 전력 생산, 수송기기, 건물에너지와 더불어 철강, 석유화학, 시멘트 등 산업 분야에서 주로 발생하고 있는데, 이에 대한 대안으로 온실가스 배출이 적은 에너지원에 대한 기술 개발 및 보급이 증가하고 있다. 전력 생산 분야에서는 풍력, 태양광, 태양열 및 지열과 같은 재생에너지 발전의 보급이 확대되고 있고4), 수송, 건물에너지, 산업 분야에서는 무탄소(CO2-free) 연료/원료를 이용하는 대체기술의 개발이 활발하게 진행되고 있다. 그중 수소(hydrogen)는 무탄소 에너지원으로서 가장 유망한 대안으로 간주되고 있는데, 청정수소 생산이 규모와 경제성을 확보하면 미래 에너지 체계에서 큰 역할을 할 것으로 전망되고 있다5).
수소의 생산은 원료와 생산 기술, 그리고 이산화탄소 배출 여부에 따라 다양하게 구분되는데, 다양한 수소 생산 방식을 Table 1에 정리하여 나타내었다. 이러한 특징을 뚜렷이 구분하기 위해 색상(color)을 이용하기도 하는데, 지역과 국가별로 다양한 방식을 사용하고 있다. 가장 다양한 색상을 이용하는 구분으로 브라운, 그레이, 블루, 청록, 레드, 퍼플, 핑크, 옐로우, 그린 등의 색상을 이용하는 방법이 있다6).
현재 기반 시설과 경제성 측면에서는 천연가스(natural gas) 수증기 개질(steam reforming)을 이용하는 그레이수소가 가장 많은 비중을 차지하고 있고2) 향후 2050년경에는 그린수소가 그레이수소에 버금가는 경제성을 확보할 것으로 예상되고는 있으나5) 현재 생산량은 매우 적은 수준이다. 그레이수소는 기술 성숙도가 높고 경제성이 우수하지만 이산화탄소를 다량으로 배출한다는 점7)에서 환경적으로 지속가능하지 않다. 따라서 이산화탄소 포집 저장(carbon capture and storage)이 가능한 블루수소6)로의 전환이 필수적이라 할 수 있다. 그리고 그린수소, 블루수소와 더불어 원자력 발전을 기반으로 하는 수소 생산의 중요성도 점차 커지고 있다8).
최근 들어 청정수소 생산 방식의 하나로 청록수소(turquoise hydrogen)에 대한 관심이 증가하고 있다. 청록수소는 열분해 반응을 이용하여 화석연료(천연가스 등)를 직접 분해하여 수소를 생산하는 방식으로 메탄이 고온에서 고체 탄소(solid carbon)와 수소(hydrogen)로 분해되는 반응을 이용하기 때문에 이산화탄소가 생성되지 않으며, 따라서 이산화탄소 배출도 없다. 앞서 언급한 것처럼 청록수소는 고온의 열분해 반응을 기반으로 하는데, 이는 기존의 다양한 화학공정 및 석유화학 산업에서 확보한 기반 기술과 유사한 기술이 적용되기 때문에 스케일업(scale-up)이 용이하고 부산물로 생산되는 고체 탄소를 판매할 수 있어 경제성이 뛰어나다는 장점이 있다. 고체 탄소는 반응기 및 촉매의 종류에 따라 카본블랙(carbon black)에서부터 graphite, carbon nano-tube 등 다양한 형태의 고부가 부산물로 생산된다.
국내에서의 메탄 열분해 연구 결과는 2002년경부터 보고되었는데, 주로 소형 반응기 수준에서 실험적인 연구가 수행되었다. Lee 등9)은 탄소계 촉매를 이용하여 유동층 반응기와 충전층 반응기(packed-bed)의 특성을 실험적으로 비교하였는데, 충전층 반응기에서 더 높은 반응 시간의 확보가 가능하고, 이에 따라 메탄 전환율이 약 3배 정도 높게 확보됨을 보고하였다. Yoon 등10)은 메탄 열분해 반응의 부산물인 고체 탄소를 분석하는 연구를 수행하였는데, 투과전자현미경(transmission electron microscope, TEM) 분석을 통해 고부가가치 고체 탄소의 생산 가능성을 확인하였다. Lee 등11)은 촉매를 장착하지 않은 세라믹 튜브 반응기를 이용하여 1,200℃ 이상의 고온 조건에서 메탄 열분해 실험을 수행하였고, 생성물의 가스 조성과 메탄 전환율을 확인하였다. Hong 등12)은 촉매 및 반응기 연구 동향을 파악하였고 탄소 침적으로 인한 촉매 비활성화의 문제를 해결하기 위한 방법으로 용융염을 이용하여 탄소를 분리하는 방법을 제안하였다.
해외 청록수소 기술 개발은 주로 미국, 호주, 독일, 캐나다 등 여러 국가의 회사에서 진행되고 있는데, 소규모 실증 플랜트를 구축하고 상용화에 근접한 수준의 실증을 준비 중이며 전 세계 여러 대학에서도 기초연구가 활발히 진행되고 있다. Upham 등13)은 용융점이 낮은 금속을 용해시켜 액체 금속과 고체 탄소 사이의 밀도 차이를 이용하여 탄소를 분리하는 개념을 제시하였는데, Ni과 Bi를 혼합한 촉매에 대해 성능을 분석하였으며, 27% Ni-73% Bi일 때 1,065℃에서 95%의 높은 메탄 전환율 실험 결과를 보고하였다. Sikander 등14)은 고정층 반응기 내부에 촉매 위치를 달리하면서 700℃ 조건에서 실험 결과를 분석하였는데, 가스 출구로부터 반응기 내부 아래 25%에 위치한 촉매가 다른 위치와 비교하였을 때 높은 메탄 전환율을 유지하는 것을 확인하였으며, 실험은 5시간 이상 진행하였다. Keipi 등15)은 메탄 열분해, 수전해, 수증기 개질에 대한 공정 모사를 진행하였는데, CO2 배출 비용, 이자율 외 여러 가지 변수를 대상으로 민감도 분석을 수행하여 소형 및 중형 규모에서는 메탄 열분해 기술이 타 기술 대비 경제적으로 유리함을 보고하였다.
앞서 기술한 바와 같이 청록수소에 대한 관심과 연구개발이 활발히 진행되고는 있지만 대용량 플랜트급의 실증은 아직 진행되지 않았고, 연구 기관 및 개발 업체별로 각기 독창적인 시스템 구성, 반응 조건, 운전 결과를 보고하고 있다. 향후 기술 개발이 좀 더 진행되면 가장 효율이 우수하고 경제성이 확보된 시스템 몇몇이 시장을 주도할 것으로 예상되나, 아직은 다양한 개념에 대한 타당성 연구가 진행되는 상황이라 할 수 있다.
본 논문에서는 이러한 배경하에 문헌조사를 기반으로 다양한 청록수소 생산 공정을 조사하고, 문헌에서 제시하는 성능 데이터를 기준으로 효율과 경제성을 분석하였다. 문헌조사를 통해 다섯 가지의 청록수소 생산 공정을 선정하였고16-18), 초기 투자 비용(capital expenditure, CAPEX), 운전 비용(operating expenditure, OPEX)을 기준으로 균등화 수소 생산 비용(levelized cost of hydrogen production, LCOH)을 비교 분석하였다. 청록수소 기술에서는 고체 탄소가 부산물로 생산되는데, 이를 재판매하여 수소 생산 비용을 저감하는 방식으로 경제성 평가에 반영하였다. 그리고 다양한 변수가 수소 생산 비용의 변화에 미치는 영향을 변수별 민감도 분석을 통해 파악하였다.
2. 수소 생산 공정
2.1. Case 1 공정: thermal decomposition
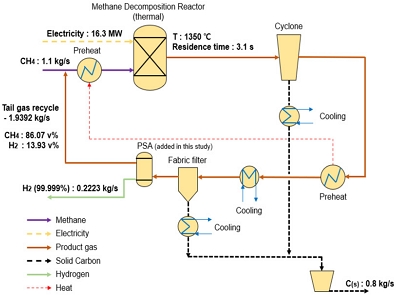
Fig. 1에 도시한 공정은 Keipi 등16)이 제안한 메탄의 열분해 공정을 기반으로 미반응 메탄과 불순물을 제거하기 위한 분리정제 장치를 추가하여 설계한 공정이다(case 1). 분리정제 공정으로는 pressure swing adsorption (PSA) 장치를 선정하였으며, 열분해 공정에서 생산된 합성가스 중에서 85%의 수소를 분리하여 순도 99.999% 이상의 수소를 생산하고, 나머지 미반응 메탄과 잔류 수소는 열분해 반응기 입구로 재순환시키는 구조를 채택하였다. 반응기에 필요한 열에너지는 전기로 공급하였으며, 촉매를 장착하지 않은 반응기를 채택하였기 때문에 반응기 온도는 1,350℃로 선정하였다. 고체 탄소는 사이클론(cyclone)과 필터(fabric filters)를 통해 분리되며, 외부로 배출되기 전에 발화를 억제하기 위해 냉각 루프를 채택하고 있다.
2.2 Case 2 공정: fluidized bed reactor
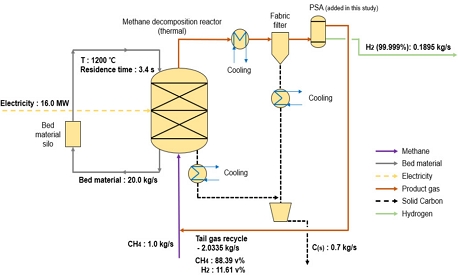
Fig. 2에 도시한 case 2 공정은 Keipi 등16)이 제안한 또 다른 공정에 수소 분리정제 공정을 추가하여 구성하였는데, 재열 열교환기가 장착된 것이 가장 큰 특징이다. Case 2 공정도 전기를 이용하여 열을 공급하며 메탄(하부에서 상부)과 bed material(상부에서 하부)이 서로 반대 방향으로 흐르면서 열이 전달된다. Case 2 공정에서도 열분해 반응기에 촉매는 설치하지 않고 있으며, 반응기 설정 온도는 1,200℃로 설정하였다. 생성된 고체 탄소는 case 1 공정과 마친가지로 사이클론과 필터를 이용하여 분리, 배출된다.
2.3 Case 3 공정: autothermal process
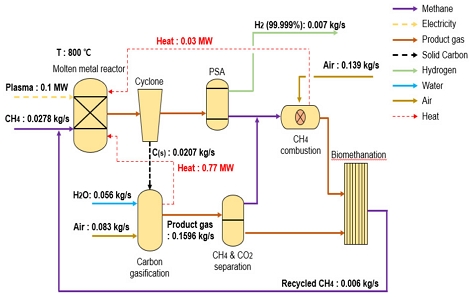
Fig. 3에 나타낸 case 3 공정은 Tabat 등17)이 제안한 공정인데, 문헌에서는 5톤 정도의 소규모 트럭에 직접 설치(on-board)가 가능한 규모로 설계하여 분석 결과를 제시하고 있다. 전체 공정은 크게 세 가지 공정으로 구성되며, 열분해 반응기, 가스화기, 생물학적 메탄화(bio-methanation)를 조합하였다. 타 청록수소 공정과는 다르게 고체 탄소를 부산물로 배출하지 않지만, 이산화탄소 또한 배출하지 않는다. 열분해반응기에서 생성된 고체 탄소는 가스화 공정을 거쳐 다시 CO2를 생산하며, 생성된 수소는 PSA를 거쳐 분리되며 반응하지 않고 배출된 메탄은 연소기에서 연소과정을 통해 다시 CO2로 전환된다. 최종적으로 생성된 CO2는 bio-methanation 과정을 통해 메탄을 생산하여 전체적으로 CO2-free 공정이 구성된다.
2.4 Case 4 공정: CO2 upcycling process
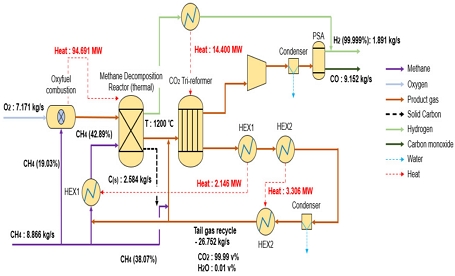
Fig. 4에 CO2 upcycling 청록수소 생산 공정을 나타내었다. 전체 공정은 크게 세 가지 공정(순산소 연소, 열분해 반응, CO2 전환)으로 구성되며, 각기 다른 기술을 연계 통합하여 청록수소를 생산하는 공정을 구성하였다. 공기 분리기(air separation unit, ASU)를 통해 생산된 순산소를 이용하여 메탄을 연소시키고, 연소 배가스에서 물을 응축하여 고순도 이산화탄소를 포집한다. 순산소 연소를 통해 초고온(1,800℃ 이상)의 연소가스를 열분해 반응기에 공급한다. 순산소 연소에서는 질소가 포함되지 않은 연소가스(H2O와 CO2로 구성)가 생성되므로, H2O의 응축 과정을 통해 CO2를 포집할 수 있다. 포집된 CO2는 carbon capture utilization (CCU) 기술의 하나인 전환 반응기를 통해 일산화탄소(CO)로 전환된다. 생산된 일산화탄소는 산업용 가스로 판매가 가능하기 때문에 수소 생산 비용을 저감할 수 있다. 공정 해석 결과, 메탄 8.87 kg/s를 통해 수소 1.89 kg/s, 일산화탄소 9.51 kg/s를 생산한다. 자세한 열물질수지 정보는 Table 2에 정리하여 나타내었다.
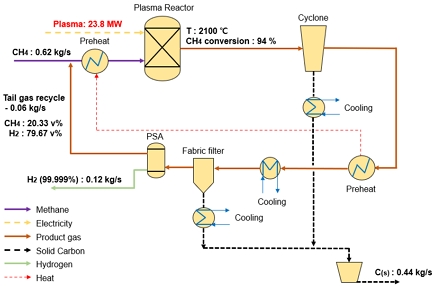
2.5 Case 5 공정: plasma sourced reactor
Fig. 5에 나타낸 case 5 공정은 플라즈마를 에너지원으로 사용하여 천연가스(메탄)를 열분해하는 공정으로 구성하였다. Schneider 등18)이 제안한 공정을 참고하여 상용급 운전이 가능한 규모로 스케일업하여 열물질수지를 분석하였다. 수소 생산량은 0.12 kg/s로 설정하였고, 이에 상응하는 플라즈마 전력 공급량 및 메탄 사용량을 결정하였다. Case 5 공정은 플라즈마를 에너지원으로 하여 초고온(2,100℃)의 반응 온도를 구현한다. 다른 공정에 비해 전력 소모가 크지만, 높은 온도에 의해 메탄 전환율이 94% 확보되기 때문에 상대적으로 적은 메탄 공급으로도 많은 수소를 생산할 수 있다.
3. 경제성 분석 방법
3.1 LCOH 계산
앞서 설명한 바와 같이 총 다섯 가지의 청록수소 생산 공정의 에너지-물질 수지 결과를 Table 2에 요약하였다. 또한 공정별 주요 특징을 Table 3에 정리하였다. CO2 upcycling 공정은 자체 계산 결과를 이용하였고, 나머지 공정은 문헌에서 제시된 결과를 요약하여 사용하였다.
LCOH19)는 식 (1)에 나타낸 바와 같이 수소 단위질량을 생산하기 위해 소요된 총 평균 비용을 의미한다. 비용은 총 수명 비용(total life cycle cost)을 계산해야 하는데, 계산 시 CAPEX, 장비 구입 비용(purchased equipment cost, PEC), 운영 및 유지 비용(operation and maintenance cost, O&M), 연료 비용(fuel cost, FC)을 추산하고, 자본금 투자에 대한 이자율(투자 수익률)과 물가 상승률을 고려하여야 한다. 기술에 대한 간략한 경제성 평가에 더하여 실제 사업 수익성을 확인하기 위해서는 토지 구입 비용, 법인세, 보험료, 인건비, 건설 기간 동안의 이자, 예비비(contingency) 등 추가적인 고려 사항이 LCOH 계산에 포함되어야 하는데, 본 논문에서는 공정 간의 기술적인 비교를 위해 단순화된 계산 방법을 적용하였고, PEC, O&M, FC만 계산에서 고려하였다20,21).
| (1) |
문헌에서 제시된 case 1, 2 공정의 PEC는 2016년 기준이므로 현재 시점의 비용으로 환산하기 위해 chemical engineering plant cost indices (CEPCI)를 적용하였으며, 구입 장비 비용률()과 유지보수 비용 투입률()은 식 (2)와 (3)을 이용하여 계산하였다. 균등화 비용 계산에 사용되는 자본회수계수(capital recovery factor)는 식 (4)에 나타낸 것과 같이 평균 유효이자율(ieff)과 플랜트 공정 수명(n)을 이용하여 계산하였다. 연간 물가 상승이 반영되는 유지보수 비용 추산에는 상승평준화계수(constant escalation leveling factor, CELF)가 필요한데, 식 (4)와 (5)를 이용하여 계산하고 이를 전체적인 계산에 반영하였다. 식 (4)와 (5)에서 k는 평준화계수, rn은 물가 상승률을 가리킨다. 또한 연료비 투입률()과 전력 생산비 투입률()은 식 (7)과 (8)을 이용하여 계산하였으며, 식 (4)와 (5)에서 계산된 CELF를 적용하여 계산하였다.
| (2) |
| (3) |
| (4) |
| (5) |
| (6) |
| (7) |
| (8) |
부산물로 생산되는 고체 탄소는 판매가 가능하고 판매 수익만큼 수소 생산 비용을 저감할 수 있다. 탄소 판매로 발생하는 수익 발생률()도 식 (9)와 같이 계산에 반영하였다. CO2 upcycling 공정(case 4)의 경우에는 부산물인 일산화탄소도 산업용으로 판매가 가능하므로 이로 인한 수익 발생률()도 식 (10)과 같이 계산 시 고려하였다.
| (9) |
| (10) |
이에 따라 총 수명 비용 ()은 식 (11)을 이용하여 계산하였고, 최종적으로 LCOH는 식 (12)와 같이 계산하였다.
| (11) |
| (12) |
3.2 투자 비용 분석
공정별 초기 투자 비용을 분석하기 위한 가정들은 Table 4에 정리하였고, 공정별 LCOH 계산 결과는 Table 5에 요약하였다. 탈탄소 생산 시설은 타 기술 대비 추가적인 재정 지원을 받으므로 투자 평균유효 이자율(effective interest rate)을 비교적 낮게 산정하였다. 연간 운영 시간(annual operating hours)은 문헌에서 제시된 가정16)을 반영하였는데 이는 반응기 내 고체 탄소 제거에 필요한 과정에 의한 결과로 판단된다. 또한 제시된 전기 비용 및 연료 비용은 International Energy Agency22) 자료를 참고하였고, 모든 공정의 생성물 중 고체 탄소는 카본블랙(carbon black)으로 생성된다고 가정하였다. 문헌에서 제안된 autothermal 공정(case 3)은 트럭에 설치하는 규모로 설계되었기 때문에 매우 작은 스케일로 계산이 되어 있는데, 타 공정과 비교를 위해 유사한 규모로 스케일업하여 경제성을 분석하였으며, 스케일에 따른 투자 비용 환산을 위해 0.6을 지수로 하여 변환하였다(six-tenths rule).
4. 계산 결과 및 토론
4.1 공정별 LCOH 비교
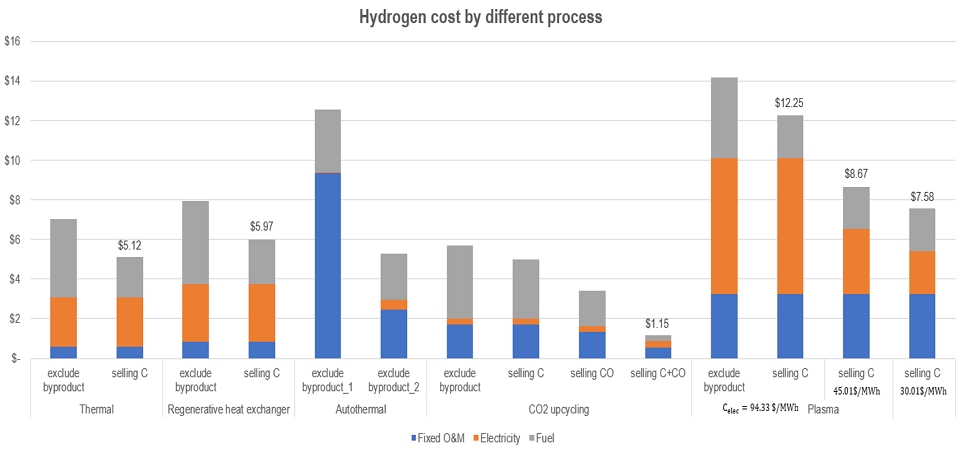
Fig. 6에 LCOH 계산 결과를 나타내었는데, 주요 인자의 민감도 분석과 부산물 판매 수익 포함 여부를 기준으로 구분하여 나타내었다. 계산 결과를 보면, thermal decomposition 공정(case 1)과 fluidized bed reactor 공정(case 2)은 부산물 판매 수익을 포함한 LCOH가 제외한 가격과 1.9 $/kgH2 차이가 나는 것을 확인하였다. Autothermal 공정(case 3)의 PEC 및 O&M은 다른 공정에 비해 3배 이상 차이가 나며 이는 용융 금속(Ni-Br) 촉매를 사용하기에 반응기 조건을 열응력에 강하며 탁월한 내식성을 가진 내열 합금강(inconel)를 사용한다고 가정한 결과이기 때문이다17). CO2-upcycling 공정(case 4)은 탄소 판매 이익뿐만 아니라 일산화탄소 판매 이익도 있기에 전반적인 LCOH가 1.15 $/kgH2로 낮게 추산되었으며 이는 타 공정에 비해 매우 낮다. Plasma reactor 공정(case 5)은 타 공정에 비해 LCOH가 크게 계산되었는데, 이는 초고온(2,100℃) 반응기 구비를 위해 CAPEX가 높게 추산되었기 때문으로 판단된다.
4.2 민감도 분석
경제성 분석에서 가정한 여러 인자에 대하여 초기 가정을 기준으로 값을 상승 및 하강시키면서 민감도 분석을 수행하였다. 탄소 판매 이익, 일산화탄소 판매 이익, 전기 비용과 같은 변수의 변화가 총 비용 및 LCOH 값에 어떤 영향을 끼치는지 분석하였고, 그 계산 결과를 Fig. 6에 나타냈다. CO2-upcycling 공정(case 4)의 부산물을 제외한 LCOH는 5.28 $/kgH2로 타 공정과 비교해도 경제성을 가지고 있다. 또한 부산물을 판매한 수입 발생률(, )이 4.55 $/kgH2이며, 이는 타 공정의 부산물 수입 발생률()과 비교해도 2.3-6.3배 높아 우수한 경제성을 가지고 있음을 확인하였다. Plasma reactor 공정(case 5)은 전력 사용량이 많기 때문에 전력 단가에 큰 영향을 받을 것으로 판단되며, 저가의 원자력 전력이나 재생 전력을 이용하면 LCOH를 현저하게 낮출 수 있을 것으로 예상된다. 원자력 전력은 평균적으로 27.76-45.01 $/MWh로 가격대가 형성되어 있는데23), 높은 가격대의 원자력 전력(45.01 $/MWh)을 사용한 경우 LCOH를 29% 낮출 수 있고 낮은 가격대의 원자력 전력(30.01 $/MWh)을 사용한 경우 38%까지 저감되는 것을 확인하였다.
5. 결 론
본 논문에서는 문헌조사를 기반으로 다섯 가지 청록수소 생산 공정을 선정하고, 이에 대한 경제성 분석을 수행하였다. 경제성 비교를 위해 단순화된 LCOH 계산 방법을 채택하였고, 주요 변수의 영향을 파악하고자 민감도 분석을 수행하였다. 주요 결과를 요약하면 다음과 같다.
1) 청록수소 생산 공정의 LCOH는 대략 1.15-12.55 $/kgH2로 추산하였고, 부산물 판매 이익을 고려하면 27-79% 정도로 낮아진다. 청록수소의 경제성은 수소 생산뿐 아니라 부산물의 판매 수익에 큰 영향을 받는 것을 확인할 수 있다.
2) 민감도 분석을 통해 CO2 upcycling 공정이 부산물의 수입 발생률이 2.3-6.3배 높아 타 공정보다 전반적으로 더 우수한 경제성을 확보하고 있음을 확인하였다.
3) Autothermal 공정을 타 공정과 유사한 규모로 스케일업한 결과 5.28 $/kgH2으로 LCOH가 58% 저감된다. 청록수소 생산 공정을 스케일업하면 경제성을 확보할 수 있음을 확인하였다.
4) LCOH는 초기 PEC의 기여가 크게 작용하지만, 열공급의 방식에 따라 전기 비용 또한 큰 요소로 작용하며 저가 전력을 사용하면 LCOH를 최대 38%까지 감축할 수 있다.
추후 연구에서는 균등한 경제성 분석을 하기 위해선 동일한 공정 시뮬레이션 소프트웨어를 사용하고 정밀한 계산에 필요한 가정(메탄 전환율, 메탄 투입량, 수소 생산량 등)을 면밀하게 정의해야 한다24). 또한 청록수소 생산 공정 중 반응기 및 촉매의 종류에 따라 카본블랙부터 graphite, carbon nano-tube 등 고부가가치 물질을 생성할 수 있다. 따라서 유의미한 민감도 분석을 위해 공정의 조건에 따른 탄소 가격 변동과 에너지원별 전기 비용을 유동적으로 조정해 LCOH에 가장 큰 영향을 주는 변수를 찾을 필요가 있다. 마지막으로 더욱 다양한 수소 생산 공정이 존재하며 이는 정기적으로 논문 자료를 분석해 청록수소 분야 외에 그레이수소, 블루수소, 핑크수소, 그린수소 등 다양한 수소 생산 분야에 대한 분석이 필요하다.
Acknowledgments
본 연구는 한국전력공사의 사외공모 기초연구(과제번호: R22XO02-12)와 산업통상자원부 한국에너지기술평가원(과제번호: 20213030020280)의 연구비 지원에 의해 수행되었습니다.
References
- United Nations (UN), “What is Kyoto protocool?” UN. Retrieved from https://unfccc.int/kyoto_protocol?gclid=, .
- R. Rapier, “Life cycle emissions of hydrogen”, Climate, 2020. Retrieved from https://4thgeneration.energy/life-cycles-emissions-of-hydrogen/, .
- Internationale Renewable Energy Agency (IRENA), “Global renewables outlook: energy transformation 2050”, IRENA, 2020. Retrieved from https://www.irena.org/publications/2020/Apr/Global-Renewables-Outlook-2020, .
-
D. Lee, T. P. Israel, Y. Bae, Y. Kim, K. Ahm, and S. Lee, “Analysis of levelized cost of electricity for type of stationary fuel-cells”, Journal of Hydrogen and New Energy, Vol. 33, No. 6, 2022, pp. 643-659.
[https://doi.org/10.7316/KHNES.2022.33.6.643]

- International Energy Agency (IEA), “The future of hydrogen”, IEA, 2019. Retrieved from https://www.iea.org/reports/the-future-of-hydrogen, .
- J. Castigliego and T. Stasio, “The "Colors" of Hydrogen”, Applied Economics Clinic, 2021. Retrieved from https://aeclinic.org/aec-blog/2021/6/24/the-colors-of-hydrogen, .
-
J. Diab, L. Fulcheri, V. Hessel, V. Rohani, and M. Frenklach, “Why turquoise hydrogen will be a game changer for the energy transition“, International Journal of Hydrogen Energy, Vol. 47, No. 61, 2022, pp. 25831-25848.
[https://doi.org/10.1016/j.ijhydene.2022.05.299]

- A. Frangoul, “There’s a buzz about green hydrogen. But pink, produced using nuclear, may have a huge role to play too”, CNBC, 2023. Retrieved from https://www.cnbc.com/2023/02/03/why-pink-hydrogen-produced-using-nuclear-may-have-a-big-role-to-play.html, .
- K. Lee, W. Nam, G. Han, K. J. Yoon, and B. G. Lee,“Production of hydrogen by the pyrolysis of methane over carbon in the fluidized bed”, Theories and Applications of Chemical Engineering, Vol. 8, No. 2, 2022, pp. 3881-3884. Retrieved from https://www.cheric.org/proceeding_disk/kiche2002f/DP022.PDF, .
- Y. H. Yoon, N. K. Park, J. D. Lee, T. J. Lee, W. C. Chang, B. G. Lee, and B. S. Ahn, “Hydrogen and carbon black production by pyrolysis of natural gas”, Journal of Hydrogen and New Energy, Vol. 14, No. 2, 2023, pp. 105-113. Retrieved from https://koreascience.kr/article/JAKO200330360540547.pdf, .
-
D. Lee, Y. Kim, and K. Ahn, “Analysis of methane conversion rate and selectivity of methane pyrolysis reaction in ceramic tube according to temperature and reaction time”, Journal of Hydrogen and New Energy, Vol. 33, No. 1, 2022, pp. 1-7.
[https://doi.org/10.7316/KHNES.2022.33.1.1]

- J. S. Hong, S. C. Kang, S. Y. Park, J. U. Lee, J. S. Im, Y. P. Jeon, J. Y. Hong, and C. W. Lee, “Trends in technology of hydrogen and carbon production by thermo-catalytic decomposition of methane”, Korean Industrial Chemistry News, Vol.23, No.4, 2020, pp. 37-47. Retrieved from https://www.cheric.org/research/tech/periodicals/view.php?seq=1818076, .
-
D. C. Upham, V. Agarwal, A. Khechfe, Z. R. Snodgrass, M, J. Gordon, H. Metiu, and E. W. McFarland, “Catalytic molten metals for the direct conversion of methane to hydrogen and separable carbon”, Science, Vol. 358, No. 6365, 2017, pp. 917-921.
[https://doi.org/10.1126/science.aao5023]

-
U. Sikander, S. Sufian, K. Z. KuShaari, and F. K. Chong, “Effects of catalytic bed position on hydrogen production by methane decomposition”, Journal of Mechanical Engineering and Sciences, Vol. 12, No. 1, 2018, pp. 3313-3320.
[https://doi.org/10.15282/jmes.12.1.2018.3.0297]

-
T. Keipi, H. Tolvanen, and J. Konttinen, “Economic analysis of hydrogen production by methane thermal decomposition: Comparison to competing technologies”, Energy Conversion and Management, Vol. 159, 2018, pp. 264-273.
[https://doi.org/10.1016/j.enconman.2017.12.063]

-
T. Keipi, V. Hankalin, J. Nummelin, and R. Raiko, “Techno-economic analysis of four concepts for thermal decomposition of methane: reduction of CO2 emissions in natural gas combustion”, Energy Conversion and Management, Vol. 110, 2016, pp. 1-12.
[https://doi.org/10.1016/j.enconman.2015.11.057]

-
M. E. Tabat, F. O. Omoarukhe, F. Güleç, D. E. Adeniyi, A. Mukherjee, P. U. Okoye, C. C. Ogbaga, E. I. Epelle, O. Akande, and J. A. Okolie, “Process design, exergy, and economic assessment of a conceptual mobile autothermal methane pyrolysis unit for onsite hydrogen production”, Energy Conversion and Management, Vol. 278, 2023, pp. 116707.
[https://doi.org/10.1016/j.enconman.2023.116707]

-
S. Schneider, S. Bajohr, F. Graf, and T. Kolb, “State of the art of hydrogen production via pyrolysis of natural gas”, ChemBioEng Reviews, Vol. 7, No. 5, 2020, pp. 150-158.
[https://doi.org/10.1002/cben.202000014]

-
T. Bui, Y. S. Kim, D. K. Lee, K. Y. Ahn, Y. Bae, and S. M. Lee, “Economic analysis and comparison between low-power and high-power SOEC systems”, Journal of Hydrogen and New Energy, Vol. 33, No. 6, 2022, pp. 707-714.
[https://doi.org/10.7316/KHNES.2022.33.6.707]

-
S. S. Aji, Y. S. Kim, K. Y. Ahn, and Y. D. Lee, “Life-cycle cost minimization of gas turbine power cycles for distributed power generation using sequential quadratic programming method”, Energies, Vol. 11, No. 12, 2018, pp. 3511.
[https://doi.org/10.3390/en11123511]

- A. Bejan, G. Tsatsaronis, and M. J. Moran, “Thermal design and optimization”, John Wiley & Sons, USA, 1995.
- IEA, “Key World Energy Statistics 2021”, IEA, 2021. Retrieved from https://www.iea.org/reports/key-world-energy-statistics-2021, .
- Korea Power Exchange, “Unit prices for different sources”, Electric Power Statistics Information System, 2023. Retrieved from https://epsis.kpx.or.kr/epsisnew/selectEkmaUpsBftChart.do?menuId=040701, .
-
H. M. Kvamsdal, K. Jordal, and O. Bolland, “A quantitative comparison of gas turbine cycles with CO2 capture”, Energy, Vol. 32, No. 1, 2007, pp. 10-24.
[https://doi.org/10.1016/j.energy.2006.02.006]