
가역적 수소 저장을 위한 마그네슘 알라네이트 (Mg(AlH4)2) 나노 입자 활용 : 밀도범함수이론 연구
1충북대학교 환경공학과2충남대학교 환경공학과
2Department of Environmental Engineering, Chungnam National University, 99 Daehak-ro, Yuseong-gu, Daejeon 34134, Korea
2023 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
Phase stability diagrams were constructed for magnesium alanate (Mg(AlH4)2) nanoparticles to investigate the reversible hydrogen storage reaction by using density functional theory. Our findings indicate that bulk Mg(AlH4)2 shows favorable hydrogen release, but unfavorable hydrogen uptake (adsorption) reactions. However, for Mg(AlH4)2 nanoparticles, it was observed that hydrogen release and recharge can be achieved by controlling the particle size and temperature. Furthermore, by predicting the decomposition phase diagram of Mg(AlH4)2 nanoparticles with varying hydrogen partial pressure, it was discovered that reversible dehydrogenation reactions can occur even in relatively large nanoparticles by controlling the hydrogen partial pressure.
Keywords:
Hydrogen storage, Mg(AlH4)2, Nanoparticle, Density functional theory, Cluster expansion키워드:
수소 저장, 마그네슘 알라네이트, 나노 입자, 밀도범함수이론, 클러스터 전개법1. 서 론
금속 수소화물(metal hydrides)은 최근 수소의 수송 응용 산업에 적용될 수 있는 수소 저장 물질로 주목받고 있다1,2). 특히 수소화마그네슘(MgH2)은 높은 중량 및 체적 저장 용량(7.6 wt.% H2, 111 kgH2/m3)으로 인해 많은 관심을 받고 있다1-3). 높은 생성열 때문에 MgH2가 H2를 방출하기 위해 고온이 필요하지만, 이런 단점은 실리콘(Si)을 첨가하여 Mg2Si가 생성되도록 함으로써 극복될 수 있다. 그러나 수소화 반응, 즉 H2를 방출하는 역반응은 최대 100 bar의 H2 압력과 150℃의 온도에서도 쉽게 일어나지 않는 것으로 나타났다4). 이것은 Mg2Si 표면에서 동역학적으로 불리한 H2 분해 반응에 부분적으로 기인한다고 알려져 있다5).
Mg 기반의 금속 수소화물 외에도 alanates ((AlH4)-)를 포함한 복합 수소화물이 최근 대체 수소 저장 물질로 주목받고 있다. 예로는 NaAlH4, LiAlH4, KAlH4, Mg(AlH4)2, Na3AlH6, Li3AlH6, and Na2LiAlH6 등이 있다6,7). 이들 물질 중 다수는 물과 반응하여 매우 비가역적인 가수분해 반응으로 인해 H2를 방출하며, 이 과정은 one-pass 수소 저장이라고 알려져 있다6,7). 즉, 수소를 방출하기는 쉬워도 수소를 다시 저장하기는 어려운 반응이다. 예를 들어, Mg(AlH4)2는 163℃에서 발열적으로 탈수소화될 수 있지만, 직접적인 수소화 반응은 열역학적으로 유리하지 않은 것으로 알려져 있다8). 또 다른 예로 LiAlH4도 재수소화될 때 동역학 및 열역학적 에너지벽이 존재하는 것으로 알려져 있다. LiAlH4의 첫 번째 탈수소화는 대략 -10 kJ/mol of H2의 반응 엔탈피(ΔH)를 갖는 발열 과정이지만9), 그 역과정은 9 kJ/mol of H2의 ΔH로 흡열적으로 진행되어 직접적인 수소화 반응이 발생되지 않는다.
또한, 수소화 반응의 가역성에 대한 동역학적 한계를 극복하기 위해 alanates에 티타늄(Ti)을 도핑할 수 있는데, 이로써 향상된 탈수소화 반응 향상뿐만 아니라 수소화 반응도 가능해지는 것으로 알려져 있다10). 예를 들어, LiNa2AlH6 복합 수소화물에 Ti를 도핑할 경우 LiNa2AlH6가 분해되어 LiH, 2NaH 및 Al로의 가역적 탈수소화 반응이 가능하다10). 복잡한 수소화물의 수소화 반응에서 동역학적 에너지 장벽을 극복하기 위한 또 다른 방법은 나노 구조화(nanostructuring)이다11). 예를 들어, 밀도범함수이론(density functional theory, DFT) 기반 이론 연구에 따르면 MgH2 클러스터 크기가 19 Mg 원자 크기 이하로 작아짐에 따라 MgH2가 더 불안정해져서 수소 탈착 에너지가 현저히 낮아진다12). 실험 연구에서도 NaAlH4, LiAlH4 및 LiBH4의 나노 입자의 크기를 제한함에 따라 탈수소화 반응이 현저히 향상될 수 있음이 발견되었다13).
복잡한 수소화물의 나노 입자에서, 나노 입자 크기에 따라 특정 상(phase)이 어떻게 안정되는지를 예측하는 것은 수소 저장을 위한 나노 구조 설계에 있어 수소 방출과 재저장을 위한 나노 입자 크기 및 온도 등의 특정 변수를 결정하는 데 있어 중요한 역할을 한다. 이에 본 연구에서는 복합 수소화물의 가역적 탈수소화 및 재수소화 과정을 이해하기 위한 기초 연구로서, 나노 입자 크기와 온도 변화에 따른 Mg(AlH4)2 나노 입자의 상 안정성 선도를 구축하였다. 이를 위해 다음 세 단계 연구가 수행되었다. 1) 일련의 금속 수소화물 나노 입자 구조들에 대한 제일원리(first-principles) 총 에너지(total energy) 계산, 2) 계산된 총 에너지에 의해 매개변수화된 클러스터 전개법(cluster expansion) 구축 및 상대적으로 큰 나노 입자들의 총 에너지 예측 그리고 3) 금속 수소화물의 탈수소화 및 수소화 반응 평형 상 경계 구축을 통한 나노 입자 및 온도에 따른 반응의 자발성을 평가하였다. 이로써, 가역적 탈수소화 반응이 가능한 금속 수소화물의 나노 입자의 크기 및 온도 조건을 도출하였다.
2. 계산 방법론
나노 입자 분해는 반응 생성물의 조성과 크기에 따라 달라진다. 반응 생성물의 나노 입자 크기에 따른 총 에너지를 계산하기 위해 DFT 방법론으로써 직경이 최대 2.3 nm인 나노 입자(Mg(AlH4)2, MgH2, Al) 구조들의 총 에너지를 계산하였다14,15). DFT 계산은 Vienna Ab initio Simulation Package (VASP)16-19)를 사용하여 projector-augmented wave (PAW)20,21) 방법으로써 수행되었다. 교환 상관 함수로서 Perdew and Wang (PW91)22) generalized gradient approximation (GGA)이 사용되었다. Plane-wave basis set의 kinetic energy cutoff는 250 eV가 사용되었으며, Brillouin 영역 적분은 폭(width)이 0.2 eV인 first-order Methfessel-Paxton smearing23)을 사용하여 Γ-point에서 수행되었다.
나노 입자 구조에 따른 DFT 총 에너지 관계를 기반으로 직경이 최대 100 nm인 나노 입자의 자유에너지(free energy)를 예측하기 위해 Mueller와 Ceder24)가 개발한 클러스터 전개법 코드를 사용했다. 이 방법에서 나노 입자의 구조는 정해진 격자 크기 내의 각 사이트(site) 변수값 +1 (occupied site) 또는 -1 (vacant site)로써 표현되는데(Fig. 1), occupied site 모양이 나노 입자 구조를 나타낸다. 나노 입자의 총 에너지는 식 (1)과 같이 cluster functions의 선형 조합으로 표현될 수 있다.
| (1) |
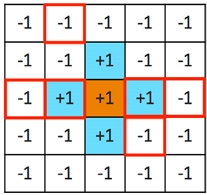
Schematic representation of a cluster expansion for a Mg(AlH4)2 nanoparticle in a 2-dimensional box. Orange, blue, and white sites are occupied by Mg, AlH4, and vacuum, respectively. The spin variables of Mg and AlH4- occupied sites are +1, and the variables of vacuum sites are -1. Clusters of a single site, a nearest-neighbor pair of sites, and a triplet of sites are represented in red
여기서 s는 모든 사이트 변수의 집합이며 si는 i 번째 사이트에 대한 사이트 변수값(+1 또는 –1)을 나타낸다. Vcluster는 effective cluster interactions (ECI)로 알려진 확장 계수로서, 나노 입자 구조에 따른 DFT 총 에너지의 관계에 기초한 훈련 세트(training set)들의 fitting을 통하여 결정된다. 이렇게 결정된 ECI를 통해 특정 나노 입자의 주어진 구조들의 DFT 총 에너지값을 예측할 수 있게 된다.
Mg(AlH4)2 나노 입자의 경우, Al-H 결합이 상대적으로 강하고 AlH4 음이온과 Mg의 원자 위치가 Fig. 2와 같이 구조 최적화 과정 중에 크게 왜곡되지 않기 때문에 Fig. 1에 표시된 것처럼 AlH4 음이온과 Mg 모두에 동일한 단일 사이트(+1)를 지정했다. 구조 최적화에 따라 결정된 DFT 총 에너지를 사용하여 클러스터 전개법을 구축하였다. 그리고 Mg2+, Al3+, H– 전하 상태를 기준으로 Mg(AlH4)2와 MgH2 나노 입자는 중성 상태를 가진다고 가정하였다. 클러스터 전개법 및 검증에 대한 자세한 내용은 sodium alanate (NaAlH4) 나노 입자에 대한 상평형 선도를 구축 위한 유사한 접근 방식이 사용된 기존 문헌24)에 설명되어 있다.
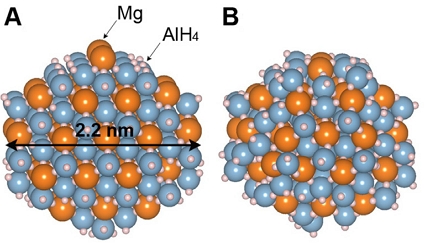
(A) Initial and (B) fully relaxed Mg50Al100H400 nanoparticle (50 formula units with a diameter of 0-2.2 nm) used for the cluster expansion training set. Orange, blue, and small white spheres represent Mg, Al, and H, respectively
Al-H-Mg 나노 입자의 입자 크기와 온도의 함수에 따른 Gibbs 자유에너지 G(n, T)는 식 (2)-(4)로 나타낼 수 있다.
| (2) |
| (3) |
| (4) |
여기서 Gbulk (T)는 원소의 벌크 구조 Gibbs 자유에너지를 나타내고, Eform (n)은 formula unit (FU)당 벌크 구조에 대한 나노 입자의 몰 형성에너지(molar formation energy)이다. n은 FU의 수, a~f, gi는 계수, i는 정수의 집합을 나타낸다. Eparticle과 Ebulk는 각각 나노 입자 및 벌크 구조 FU의 총 에너지를 나타낸다. Al-H-Mg 나노 입자의 Gbulk (T) 관계식은 Palumbo 등25)에 나타나 있다. 벌크 구조 Mg(AlH4)2, MgH2, Al의 FU는 각각 Mg1Al2H8, Mg2H4, Al1이다. 클러스터 전개법의 예측정확도를 나타내는 cross-validation (CV) 값은 식 (5)로 정의되며, 본 연구에서 도출된 Mg(AlH4)2, MgH2, Al의 CV 값은 각각 0.096, 0.299, 0.004 eV/FU이다.
| (5) |
여기서 N은 평가한 구조의 개수이고, Ei와 은 DFT로 계산된 구조 i의 총 에너지와 클러스터 전개법의 (N - 1)까지의 구조들로, 예측한 총 에너지를 각각 나타낸다.
3. 결과 및 고찰
3.1 나노 입자의 몰 형성에너지
Fig. 3은 각 나노 입자 Al (to 200 FU), Mg(AlH4)2 (to 50 FU) 및 MgH2 (to 80 FU)의 훈련 세트를 기반으로 예측된 각 나노 입자의 몰 형성에너지(Eform (n), 즉 벌크 구조 대비 나노 입자 몰당 형성에 필요한 에너지를 나타내며, 단위는 kJ/mol이다. 클러스터 전개법을 통해 Al, Mg(AlH4)2, MgH2 나노 입자의 최대 1,600, 450 및 500 FU의 몰 형성에너지를 각각 예측하였다.
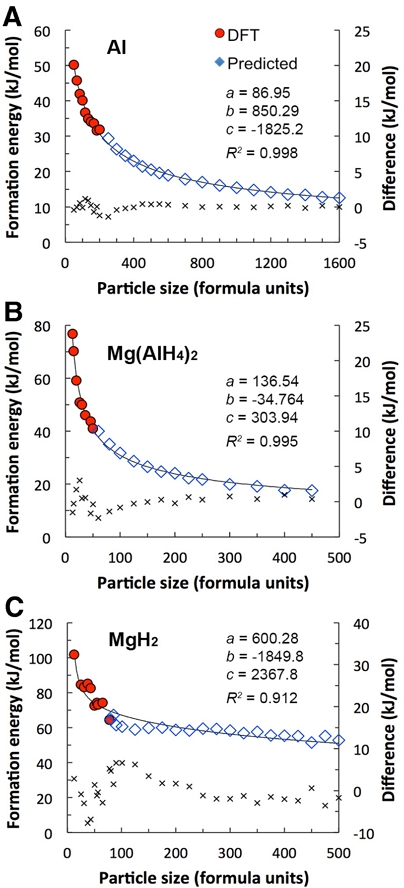
DFT-calculated (circles) and cluster expansion-predicted (diamonds) formation energies relative to bulk for (A) Al, (B) Mg(AlH4)2, and (c) MgH2 nanoparticles. The solid lines indicate fitted formation energies (left scale). a, b, and c values are constants of Eq. (6). The secondary y-axis represents difference (‘×’ markers with the right scale) between the fitted equation and the calculated or predicted data
나노 입자 크기가 커짐에 따라 Eform (n) 값은 점점 작아지게 되는데, 최종적으로 입자 크기가 벌크 구조까지 증가함에 따라 몰 형성에너지는 0에 수렴하게 된다. 식 (2), (3)은 직경 최대 100 nm의 나노 입자 몰 형성에너지 예측에 사용되었다. 결과적으로 Eform (n) 항은 다음의 식으로 나타낼 수 있다.
| (6) |
여기서 n은 입자 크기(in FU)이고 Al, Mg(AlH4)2, MgH2에 대한 a, b, c 상수 값은 Fig. 3에 나와 있다. 상대적으로 작은 나노 입자에서는 식 (6)과 DFT 계산값 또는 클러스터 전개법으로 예측된 값 사이의 오차는 다소 존재하지만, 나노 입자 크기가 증가함에 따라 그 오차는 0에 가깝게 수렴됨을 알 수 있다.
3.2 탈수소화 반응 Gibbs 자유에너지(ΔG)
Mg(AlH4)2 화합물은 식 (7), (8)과 같이 두 단계로 분해된다25-27). 식 (8)은 Al3Mg2 생성 유무에 따라 식 (9) 또는 (10)과 같이 두 개의 순차적인 반응으로 진행될 수도 있다26). 또한, Mg(AlH4)2의 분해 과정에서 과도하게 활성화된 MgH2로 인해 준안정적 중간 생성물인 MgAlH5 화합물이 형성될 수 있다28). 본 연구에서는 Mg(AlH4)2 벌크 구조와 나노 입자 구조 사이의(식 [7])의 상 안정성을 이해하는 데 중점을 둔다.
| (7) |
| (8) |
| (9) |
| (10) |
결과적으로, Mg(AlH4)2의 분해 반응(식 [7])에 대한 반응 Gibbs 자유에너지(ΔG(n, T))는 입자 크기(n) 및 온도(T)의 함수에 따라 kJ/mol FU 단위이며, 이를 Fig. 4에 나타내었다(수소 분압은 101,325 Pa이라 가정). Mg(AlH4)2의 n 단위마다 2n 단위의 Al과 n 단위의 MgH2가 있으므로, 그 결과 ΔG(n, T) 계산에서 ΔEform (n)을 계산할 때 Mg(AlH4)2, Al, MgH2에 대한 Eform (n) 항의 n 변수는 각각 n, 2n, n이어야 한다. 나노 입자 직경(nm)은 n과 실험적으로 결정된 NaAlH4 나노 입자 크기 간의 관계에서 유래된 식 (11)의 FUs (n)의 수로써 나타낼 수 있다24,29).
| (11) |
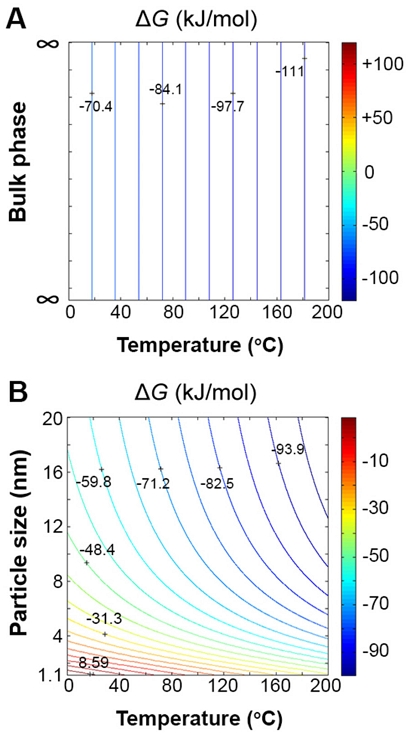
Free energy contours for bulk (A) and nanoparticle (B) phases of Mg(AlH4)2 decomposition (Eq. (7)) as a function of the particle size (nm) and temperature under the pressure of 101,325 Pa. Color scale represents ΔG (kJ/mol)
Fig. 4는 벌크 및 나노 입자상의 입자 크기(nm)와 온도에 따른 Mg(AlH4)2 분해(식 [7]) 반응 Gibbs 자유에너지(ΔG) 등고선(즉, 탈수소화 반응)을 보여준다. 벌크 상의 경우(Fig. 4[A]), ΔG는 0-200℃ 범위의 온도에서 음수(파란색)를 나타내며(즉, 식 [7]의 반응은 항상 왼쪽에서 오른쪽으로 진행), 이는 Mg(AlH4)2의 분해(탈수소화)가 자발적 반응임을 나타내고, 역반응인 수소화 반응은 비가역적임을 나타낸다. 이러한 결과는 벌크 Mg(AlH4)2에 대한 압력-온도 평형 선도에서 벌크 Mg(AlH4)2의 안정한 상이 나타나지 않는다는 점에서 Palumbo 등25)의 DFT 연구 결과와 일치한다. Fichtner 등8)은 또한 Mg(AlH4)2가 163℃에서 발열적으로 탈수소화될 수 있지만 열역학적으로 비가역적인 반응임을 실험적으로 입증했다. 따라서 본 연구의 결과는 벌크 Mg(AlH4)2가 가역적 수소 저장 물질로 적합하지 않다는 실험적으로 알려진 사실을 증명함을 알 수 있다26).
하지만 매우 작은 나노 입자의 경우(Fig. 4[B]), 나노 입자 크기와 온도가 감소함에 따라 ΔG 값이 양수(붉은색)가 되는 영역이 존재한다. 이러한 영역에서는 식 (7)의 반응이 항상 오른쪽에서 왼쪽으로 진행되며, 이는 Mg(AlH4)2로의 수소화 반응이 자발적 반응임을 나타낸다.
나노 입자 크기와 온도에 따라 ΔG가 0이 되는 평형 지점을 Fig. 5에 실선으로 나타내었다. 이로써 Mg(AlH4)2 나노 입자의 가역적 탈수소화 반응을 위해 필요한 나노 입자 크기 및 온도의 조건을 도출할 수 있다. 수소와 금속 사이의 결합을 끊기 위해 열을 가해야 한다는 것을 고려하면, 이는 수소의 방출30)과 수소의 재충전이 나노 입자의 크기와 온도를 제어함으로써 가능할 수 있음을 의미한다. 예를 들어, Fig. 5에서 Mg(AlH4)2 나노 입자 크기가 약 2 nm 미만으로 유지되는 경우 MgH2, Al, 기체 H2 상이 우세함에 따라 실온 이상으로 온도가 상승하면 수소가 방출될 수 있고, Mg(AlH4)2 상이 우세함에 따라 101,325 Pa의 수소 압력에서 온도가 감소하면 수소를 저장할 수 있다. 탈수소화 반응의 가역성을 나타내는 예를 Fig. 5의 (a)와 (b) 사이의 화살표로 나타내었다. 추가적으로, Mg(AlH4)2가 작은 나노 입자 크기에서 상대적으로 더 안정될 것으로 나타나는 이유는 더 작은 MgH2 및 Al 나노 입자가 분해되어 더 높은 표면적/체적 비율로 인해 불안정해질 것이기 때문이다.
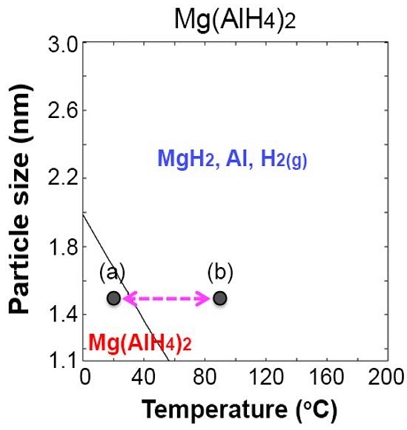
Equilibrium diagrams of the Mg(AlH4)2 nanoparticle decomposition with a line of ΔG = 0. An arrow between (a) and (b) indicates an example of temperature change
약 2 nm 미만의 나노 입자 크기에서 Mg(AlH4)2 나노 입자의 수소 방출 및 재충전의 가역성은 실온에서부터 100℃ 범위의 온도 영역에서 달성될 수 있을 것으로 예상된다. 그러나 다른 나노 입자 크기 범위에서의 가역성은 100℃보다 높은 온도에서 가능할 수 있으며, 이는 약 100℃에서 작동하는 양성자교환막(proton exchange membrane) 연료전지의 적용에 최적이 아닐 수 있다. 왜냐하면, 탈수소화 가역성을 위해 100℃ 이상으로 온도를 높이면 물이 끓어 증발되어 버리기 때문이다. 이에 대한 해결책을 찾기 위해 수소 분압에 따른 Mg(AlH4)2 나노 입자 탈수소화 반응 평형선도를 도출하였다.
3.3 수소 분압의 영향
수소 분압은 Mg(AlH4)2 열역학적 분해에 영향을 미칠 수 있다. 이를 확인하기 위해 벌크 Mg(AlH4)2의 상 안정성이 이미 확보된 327℃ (600 K)25)까지의 온도 범위에서 수소 분압을 101,325×10-2에서 101,325×102 Pa까지 변화시키면서 앞서 Fig. 5에서 분석한 Mg(AlH4)2 분해 반응 Gibbs 자유에너지(ΔG) 평형점을 도출하였다. Fig. 6에서 볼 수 있듯이 압력이 증가함에 따라 Mg(AlH4)2의 상 영역이 확대된다. 즉, ΔG=0 선이 아래 영역에서 위로 이동되며, 그 경향은 온도와 압력에 따른 벌크 Mg(AlH4)2의 상 안정성에 대한 ab initio 기반 열역학 모델링 결과와 잘 일치함을 알 수 있다25). 수소의 압력을 증가시킴으로써 더 큰 나노 입자가 특정 온도 범위에서 더 작은 나노 입자와 비교하여 동일한 수소 방출 및 재충전 특성을 나타낼 수 있음을 알 수 있고, 이는 지름 약 2 nm 미만의 더 작은 나노 입자의 합성과 관련된 기술적 어려움 문제를 경감시킬 수 있을 것이다.
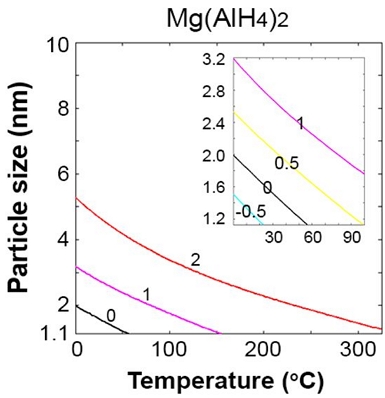
Equilibrium diagrams of Mg(AlH4)2 decomposition depending on hydrogen partial pressure (P) in terms of log10(P/P0) where P0 is the standard pressure of 101,325 Pa. An inset represents magnified region outlined by T=0 to 100℃ and n=1.1 to 3.2 nm
추가적으로, 본 연구의 한계점은 나노 입자의 FU 당 영점 에너지(zero-point energy) 및 엔트로피가 벌크 상 물질의 상태값과 동일하다고 가정한 것, FU 수와 실험적으로 결정된 나노 입자 크기 사이의 관계를 단순화시킨 것, Mg(AlH4)2 분해 과정에서 생성될 수 있는 Al3Mg2의 중간 생성물을 제외한 점, 그리고 실험값과 이론값의 직접적 비교가 어려운 점 등이다. 이러한 연구의 한계성에도 불구하고, 본 연구는 Mg(AlH4)2 벌크 상과 나노 입자 상 사이의 수소 방출 및 재저장 거동 특성 차이를 명확하게 보여줌으로써, 나노 입자의 상 안정성 선도로부터 도출한 결과는 Mg(AlH4)2 나노 입자에서 최적의 수소 방출 및 재충전을 위한 나노 입자 크기 및 온도 그리고 수소의 압력 등의 변수를 결정하는데 유용한 정보를 제공한다고 할 수 있다.
4. 결 론
본 연구는 DFT 계산을 기반으로 한 클러스터 전개법 방법론을 활용하여 Mg(AlH4)2 나노 입자의 크기, 온도 그리고 수소 분압에 따른 탈수소화 반응 Gibbs 자유에너지를 예측하였다. 결과로서, 벌크 Mg(AlH4)2 상태에서는 수소 방출이 자발적으로 발생되지만 수소의 재저장은 어려운 비가역성을 나타냈다. 하지만 Mg(AlH4)2 나노 입자의 경우, 101,325 Pa (1 bar)의 수소 분압 하에서 입자의 크기가 약 2 nm 이하일 때, 온도를 변화시킴으로써 수소 방출 및 재충전의 가역성을 나타낼 수 있음을 이론적으로 증명하였다. 또한, 101,325×102 Pa까지 수소 분압을 높임으로써 2 nm보다 더 큰 나노 입자에서도 2 nm 이하의 나노 입자가 가지는 탈수소화 반응의 가역성을 나타낼 수 있음을 증명하였다. 이는 수소 분압을 제어함으로써 더 작은 나노 입자의 합성과 관련된 기술적 문제를 줄일 수 있음을 보여 준다.
Acknowledgments
이 논문은 충북대학교 국립대학육성사업(2022) 지원을 받아 작성되었습니다. 클러스터 전개법 계산 코드를 제공해 주신 Johns Hopkins University의 Tim Mueller에게 감사함을 전합니다.
References
-
B. P. Tarasov, P. V. Fursikov, A. A. Volodin, M. S. Bocharnikov, Y. Y. Shimkus, A. M. Kashin, V. A. Yartys, S. Chidziva, S. Pasupathi, and M. V. Lototskyy, “Metal hydride hydrogen storage and compression systems for energy storage technologies”, International Journal of Hydrogen Energy, Vol. 46, No. 25, 2021, pp. 13647-13657.
[https://doi.org/10.1016/j.ijhydene.2020.07.085]

-
A. Schneemann, J. L. White, S. Y. Kang, S. Jeong, L. F. Wan, E. S. Cho, T. W. Heo, D. Prendergast, J. J. Urban, B. C. Wood, M. D. Allendorf, and V. Stavila, “Nanostructured Metal Hydrides for Hydrogen Storage”, Chemical Reviews, Vol. 118, No. 22, 2018, pp. 10775-10839.
[https://doi.org/10.1021/acs.chemrev.8b00313]

-
T. T. Le, C. Pistidda, V. H. Nguyen, P. Singh, P. Raizada, T. Klassen, and M. Dornheim, “Nanoconfinement effects on hydrogen storage properties of MgH2 and LiBH4”, International Journal of Hydrogen Energy, Vol. 46, No. 46, 2021, pp. 23723-23736.
[https://doi.org/10.1016/j.ijhydene.2021.04.150]

-
J. J. Vajo, F. Mertens, C. C. Ahn, R. C. Bowman Jr, and B. Fultz, “Altering hydrogen storage properties by hydride destabilization through alloy formation: LiH and MgH2 Destabilized with Si”, The Journal of Physical Chemistry B, Vol. 108, No. 37, 2004, pp. 13977-13983.
[https://doi.org/10.1021/jp040060h]

-
B. Dai, D. S. Sholl, and J. K. Johnson, “First-principles investigation of adsorption and dissociation of hydrogen on Mg2-Si surfaces”, The Journal of Physical Chemistry C, Vol. 111, No. 18, 2007, pp. 6910-6916.
[https://doi.org/10.1021/jp070469h]

-
C. Milanese, S. Garroni, F. Gennari, A. Marini, T. Klassen, M. Dornheim, and C. Pistidda, “Solid state hydrogen storage in alanates and alanate-based compounds: a review”, Metals, Vol. 8, No. 8, 2018, pp. 567.
[https://doi.org/10.3390/met8080567]

-
B. Sakintuna, F. Lamari-Darkrim, and M. Hirscher, “Metal hydride materials for solid hydrogen storage: a review”, International Journal of Hydrogen Energy, Vol. 32, No. 9, 2007, pp. 1121-1140.
[https://doi.org/10.1016/j.ijhydene.2006.11.022]

-
M. Fichtner, O. Fuhr, and O. Kircher, “Magnesium alanate—a material for reversible hydrogen storage?”, Journal of Alloys and Compounds, Vol. 356-357, 2003, pp. 418-422.
[https://doi.org/10.1016/S0925-8388(02)01236-7]

-
J. Block and A. P. Gray, “The thermal decomposition of lithium aluminum hydride”, Inorganic Chemistry, Vol. 4, No. 3, 1965, pp. 304-305.
[https://doi.org/10.1021/ic50025a009]

-
B. Bogdanović and M. Schwickardi, “Ti-doped alkali metal aluminium hydrides as potential novel reversible hydrogen storage materials”, Journal of Alloys and Compounds, Vol. 253-254, 1997, pp. 1-9.
[https://doi.org/10.1016/S0925-8388(96)03049-6]

-
L. Pasquini, E. Callini, E. Piscopiello, A. Montone, M. V. Antisari, and E. Bonetti, “Metal-hydride transformation kinetics in Mg nanoparticles”, Applied Physics Letters, Vol. 94, No. 4, 2009, pp. 041918.
[https://doi.org/10.1063/1.3077186]

-
R. W. P. Wagemans, J. H. van Lenthe, P. E. de Jongh, A. J. van Dillen, and K. P. de Jong, “Hydrogen storage in magnesium clusters: quantum chemical study”, Journal of the American Chemical Society, Vol. 127, No. 47, 2005, pp. 16675-16680.
[https://doi.org/10.1021/ja054569h]

-
M. Christiana and K. F. Aguey-Zinsou, “Destabilisation of complex hydrides through size effects”, Nanoscale, Vol. 2, No. 12, 2010, pp. 2587-2590.
[https://doi.org/10.1039/C0NR00418A]

-
P. Hohenberg and W. Kohn, “Inhomogeneous electron gas”, Physical Review, Vol. 136, No. 3B, 1964, pp. B864-B871.
[https://doi.org/10.1103/PhysRev.136.B864]

-
W. Kohn and L. J. Sham, “Self-consistent equations includeeing exchange and correlation effects”, Physical Review, Vol. 140, No. 4A, 1965, pp. A1133-A1138.
[https://doi.org/10.1103/PhysRev.140.A1133]

-
G. Kresse and J. Hafner, “Ab initio molecular dynamics for liquid metals”, Physical Review B, Vol. 47, No. 1, 1993, pp. 558-561.
[https://doi.org/10.1103/PhysRevB.47.558]

-
G. Kresse, and J. Hafner, “Ab initio molecular-dynamics simulation of the liquid-metal–amorphous-semiconductor transition in germanium”, Physical Review B, Vol. 49, No. 20, 1994, pp. 14251-14269.
[https://doi.org/10.1103/PhysRevB.49.14251]

-
G. Kresse and J. Furthmüller, “Efficient iterative schemes for ab initio total-energy calculations using a plane-wave basis set”, Physical Review B, Vol. 54, No. 16, 1996, pp. 11169-11186.
[https://doi.org/10.1103/PhysRevB.54.11169]

-
G. Kresse and J. Furthmüller, “Efficiency of ab-initio total energy calculations for metals and semiconductors using a plane-wave basis set”, Computational Materials Science, Vol. 6, No. 1, 1996, pp. 15-50.
[https://doi.org/10.1016/0927-0256(96)00008-0]

-
P. E. Blöchl, “Projector augmented-wave method”, Physical Review B, Vol. 50, No. 24, 1994, pp. 17953-17979.
[https://doi.org/10.1103/PhysRevB.50.17953]

-
G. Kresse and D. Joubert, “From ultrasoft pseudopotentials to the projector augmented-wave method”, Physical Review B, Vol. 59, No. 3, 1999, pp. 1758-1775.
[https://doi.org/10.1103/PhysRevB.59.1758]

-
J. P. Perdew and Y. Wang, “Accurate and simple analytic representation of the electron-gas correlation energy”, Physical Review B, Vol. 45, No. 23, 1992, pp. 13244-13249.
[https://doi.org/10.1103/PhysRevB.45.13244]

-
M. Methfessel and A. T. Paxton, “High-precision sampling for Brillouin-zone integration in metals”, Physical Review B, Vol. 40, No. 6, 1989, pp. 3616-3621.
[https://doi.org/10.1103/PhysRevB.40.3616]

-
T. Mueller and G. Ceder, “Effect of particle size on hydrogen release from sodium alanate nanoparticles”, Acs Nano, Vol. 4, No. 10, 2010, pp. 5647-5656.
[https://doi.org/10.1021/nn101224j]

-
M. Palumbo, F. J. Torres, J. R. Ares, C. Pisani, J. F. Fernandez, and M. Baricco, “Thermodynamic and ab initio investigation of the A1-H-Mg system”, Calphad, Vol. 31, No. 4, 2007, pp. 457-467.
[https://doi.org/10.1016/j.calphad.2007.04.005]

-
Y. Kim, E. K. Lee, J. H. Shim, Y. W. Cho, and K. B. Yoon, “Mechanochemical synthesis and thermal decomposition of Mg(AlH4)2”, Journal of Alloys and Compounds, Vol. 422, No. 1-2, 2006, pp. 283-287.
[https://doi.org/10.1016/j.jallcom.2005.11.063]

-
R. A. Varin, C. Chiu, T. Czujko, and Z. Wronski, “Mechano-chemical activation synthesis (MCAS) of nanocrystalline magnesium alanate hydride [Mg(AlH4)2] and its hydrogen desorption properties”, Journal of Alloys and Compounds, Vol. 439, No. 1-2, 2007, pp. 302-311.
[https://doi.org/10.1016/j.jallcom.2006.08.080]

-
T. N. Dymova, N. N. Mal'tseva, V. N. Konoplev, A. I. Golovanova, D. P. Aleksandrov, and A. S. Sizareva, “Solid-phase solvate-free formation of magnesium hydroaluminates Mg-(AlH4)2 and MgAlH5 upon mechanochemical activation or heating of magnesium hydride and aluminum chloride mixtures”, Russian Journal of Coordination Chemistry, Vol. 29, 2003, pp. 385-389.
[https://doi.org/10.1023/A:1024025925617]

-
P. Canton, M. Fichtner, C. Frommen, and A. Léon, “Synchrotron X-ray studies of ti-doped NaAlH4”, The Journal of Physical Chemistry B, Vol. 110, No. 7, 2006, pp. 3051-3054.
[https://doi.org/10.1021/jp0538565]

-
A. W. McClaine, K. Brown, and D. D. G. Bowen, “Magnesium hydride slurry: a better answer to hydrogen storage”, Journal of Energy Resources Technology, Vol. 137, No. 6, 2015, pp. 061201.
[https://doi.org/10.1115/1.4030398]
