0D 모델을 활용한 메탄-수소 혼소에 따른 MILD 연소 및 NOx 배출 특성 해석 연구
2022 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
Hydrogen with high chemical reactivity and combustion efficiency, is expected to reduce greenhouse gas and CO emission. However, there is a problem of increase in NOx emission due to hydrogen combustion. MILD combustion technology has been proposed to resolve NOx emission. In this study, the characteristics of MILD combustion and NOx formation by flue gas recirculation (KV) in CH4-H2 mixture were analyzed and predicted using 0D premixed combustion model. The ignition delay time became shorter as the hydrogen co-firing rate increased, and longer as the recirculation rate increased. For NOx emission, EINO decreased as the KV increased, but EINO increased as the hydrogen co-firing rate increased. In particular, EINO was predicted to increase significiently above 80% hydrogen. Through the pathway analysis of NO formation, it was found that the influence of N2O intermediate route and NNH route was enhanced for hydrogen co-firing.
Keywords:
Methane, Hydrogen, MILD combustion, Flue gas recirculation, NOx formation, Chemical pathway키워드:
메탄, 수소, MILD 연소, 배가스 재순환, 질소산화물 생성, 생성 경로1. 서 론
에너지 차원에서 온실가스 저감 효과를 가진 수소는 현재 주목받는 에너지원 중 하나로1-4), 화석 연료 기반의 에너지 생산 시스템에서 수소혼소용 가스터빈 등의 개발을 통해 수소 기반의 에너지 생산 시스템으로의 전환이 이루어지고 있다5). 연료에 수소가 첨가되면서 H2의 높은 반응성과 연소율로 인해 저농도의 CO 배출이 가능하며, 연소기는 향상된 연소 효율로부터 더 낮은 당량비에서 작동할 수 있게 된다6). 그러나 수소 경제로의 전환기인 현재까지도 수소 연소에 의한 NOx 배출 증가에 대한 지적이 나오고 있다. Arghode와 Gupta7)는 연료와 공기의 비예혼합 조건에서 대향류 반응기를 이용하여 수소 첨가의 영향에 대해 연구하였으며, 수치 해석을 통해 메탄-수소 혼소 시 NOx 방출이 증가한다고 보고하였다.
질소산화물 배출에 대한 문제를 해결하기 위한 방법으로 moderate or intense low-oxygen dilution (MILD) 혹은 무화염 연소 기술이 제안되고 있다. MILD 연소는 기존 화염에서 발생하는 국부적인 연소 반응을 확장하여 연소기 내부 온도가 감소하고 thermal-NOx의 생성량이 감소되는 특징이 있다. Cavaliere와 de Joannon8)은 메탄 혼합물의 초기 온도(Tin)에 따라, 자발화 온도(Tsi)가 온도 변화량(ΔT=T-Tin)보다 큰 경우를 feedback combustion (FC)과 high temperature combustion (HTC)으로 나누었고, ΔT가 Tsi보다 작으면서 Tin은 Tsi보다 큰 경우를 MILD combustion (MILD)으로 정의하였다. ΔT가 Tsi보다 작으면서 Tin이 Tsi보다 작으면 pilot combustion (PC)에 해당되며9), 이와 같은 기준으로 분류된 연소 영역은 Fig. 1과 같이 나타낼 수 있다. MILD 연소는 자발화 온도 이상의 고온으로 공기를 예열하고 희석제와 반응물들의 혼합을 통해 연소 영역에서의 최대 온도를 감소시킴으로써 구현이 가능하다. Wünning과 Wünning10)은 연소기 내에 발생하는 강한 배기가스 재순환을 통해 낮은 화염 온도에서의 안정적인 연소 반응을 연구하였으며, 이를 통해 thermal-NOx의 발생이 억제되는 결과를 도출하였다.
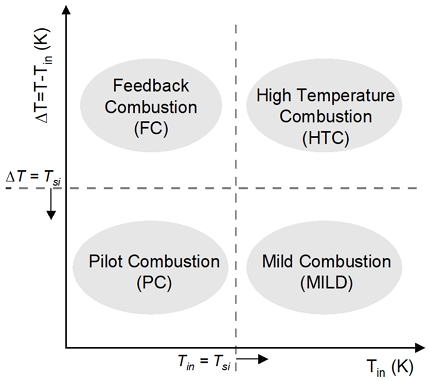
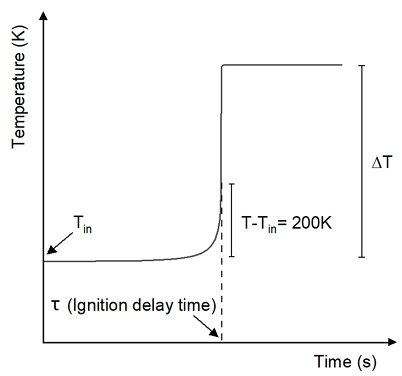
Classification of different combustion modes as function of Temperature increase (ΔT) and Inlet temperature (Tin)
Taamallah 등11)은 가스터빈 연소실에서의 수소 혼합 연소에 대한 수치해석을 통해 메탄 화염 대비 수소는 높은 난류 화염 속도를 가지며, 빠른 화염 전파 속도 특성에 의해 낮은 당량비로 가연 한계가 확장되는 효과가 있음을 밝혔다. 이를 바탕으로 MILD 연소의 넓은 반응 영역, 낮은 연소 소음 등의 장점을 활용하기 위해, Mardani와 Tabejamaat12)는 메탄에 수소를 첨가하여 수소가 MILD 연소 영역에서 화염 구조에 미치는 영향을 연구하였다. 수치해석을 통해 수소 혼소율이 5%에서 20%까지 증가하면 혼합 분율과 화염 신장율이 증가하고 열 방출 속도가 증가한다는 결과를 도출하였다. 또한 수소 혼소시 NOx 생성의 영향을 알아보기 위해 메탄-수소 연소에서 발생하는 NOx의 형성 메커니즘과 경로에 대한 다양한 연구가 진행되었다7,13,14). Ali 등15)은 수소 혼소율 0-60% 범위에서의 MILD 연소 영역에서의 NOx 생성에 대한 연구를 수행하였다. 이를 통해 수소 첨가로 인해 NNH route가 증가하는 반면 prompt route와 N2O intermediate route는 감소하였으며, NO-reburning의 감소로 인해 NOx 배출량이 증가하는 결과를 도출하였다.
앞서 언급된 바와 같이 기존에 수행된 수소 혼소 연관 연구는 60% 이하의 수소 혼소율에 대한 분석에 집중되어 있으며, 무탄소 연료 전환을 위해서는 높은 수소 혼소율에 대한 연구가 필요한 상황이다. 이에 따라 본 연구에서는 실험적 접근에 앞서, 선행적으로 0D 예혼합 모델을 활용하여 내부 배가스 재순환을 고려한 MILD 연소에서의 수소 혼소율에 대한 연소 특성을 알아보고, 화학적 분석을 통해 NOx 생성 및 경로에 대해 연구하고자 한다.
2. 수치해석 방법 및 조건
본 연구는 CH4와 H2의 MILD 연소에서의 연소 특성을 해석하고 NOx 생성을 예측하기 위하여 수행되었다. 이를 위해 CH4와 H2의 혼소율에 따른 착화 지연 시간과 연소 영역의 변화를 살펴보았다. MILD 연소는 대부분의 연구에서 연료와 산화제가 분리되어 있는 비예혼합 연소 위주로 수행되었다. 하지만 MILD 연소는 공간에서의 강한 난류장에 의한 내부재순환을 유도하여 예혼합 혹은 부분예혼합 연소 형태를 갖게 된다16). 이에 따라 많은 MILD 연소 관련 수치해석 연구는 상세 화학 반응을 고려한 EDC 모델을 적용하고 있다17-19). 본 연구에서는 단순하지만 MILD 연소 특성에 대한 기초적인 해석이 가능한 CHEMKIN의 0D 예혼합 모델인 0D homogeneous reactor와 perfectly stirred reactor (PSR)를 이용하였다.
CH4와 H2를 포함하여 대표적인 화학 반응 특성 연구에 적용되는 GRI-Mech 2.11 반응 기구20)를 사용하였다. GRI-Mech 2.11은 다양한 선행 연구를 통해 MILD 연소 해석의 상세 화학 반응을 모사하기 위해 적용되어 검증되었다14,21-23). 모든 조건은 단열 상태에서 수행되었으며, 해석에 적용된 조건은 Table 1과 같다. 반응물의 체류시간(residence time)은 모든 조건에서 10초로 동일하게 설정하였다. Fig. 2는 본 연구에서 착화 지연 및 MILD 연소 영역을 규정하기 위해 설정한 주요 온도 및 시간에 대한 정의를 도시한 것이다. 착화 지연 시간은 반응물의 온도가 초기 온도(Tin)보다 200 K 증가한 시점을 기준으로 선정하였다. 반응이 종료된 시점의 반응 후 온도와 초기 온도의 차이를 온도 변화량(ΔT)으로 정의하였다.
MILD 연소 구현을 위해 요구되는 내부 배가스 재순환(flue gas recirculation)에 대한 효과를 고려하기 위해 반응식 (1)에 따라 초기 반응물의 조성을 결정하였다.
| (1) |
여기서 a와 b는 CH4와 H2의 몰분율에 의해 결정되고 c는 당량비에 의해 결정된다. 재순환되는 가스가 없을 때, 반응 후 배출되는 flue gas는 P (flue gas at no recirculation)가 된다. KV (recirculation ratio)는 재순환되는 배가스와 초기에 주입되는 연료와 산화제 비를 뜻하며, 식 (2)로 정의된다10). 여기서 , , 은 각각 재순환되는 배가스, 초기에 주입하는 연료, 초기에 주입하는 산화제의 질량유량을 뜻한다.
| (2) |
메탄-수소 MILD 연소에서의 NOx 배출 특성을 정량적으로 비교, 분석하기 위해 emission index of NO (EINO)를 적용하였다. EINO는 투입되는 예혼합 반응물 중 연료인 메탄과 수소의 질량 대비 연소 후 생성되는 NO의 질량비로, 식 (3)과 같이 정의된다.
| (3) |
산화제인 공기는 부피를 기준으로 O2 21%, N2 79%로 고정하였으며, 메탄-수소 혼합 연료 내 수소 비율은 부피를 기준으로 0-100%까지 20 Vol.% 간격으로 증가시켰다. 이를 바탕으로 총 28가지의 반응물 조건을 기반으로 Table 1의 경계 조건에 대한 결과를 도출하였다.
3. 결과 및 고찰
3.1 착화 지연 시간(ignition delay time)
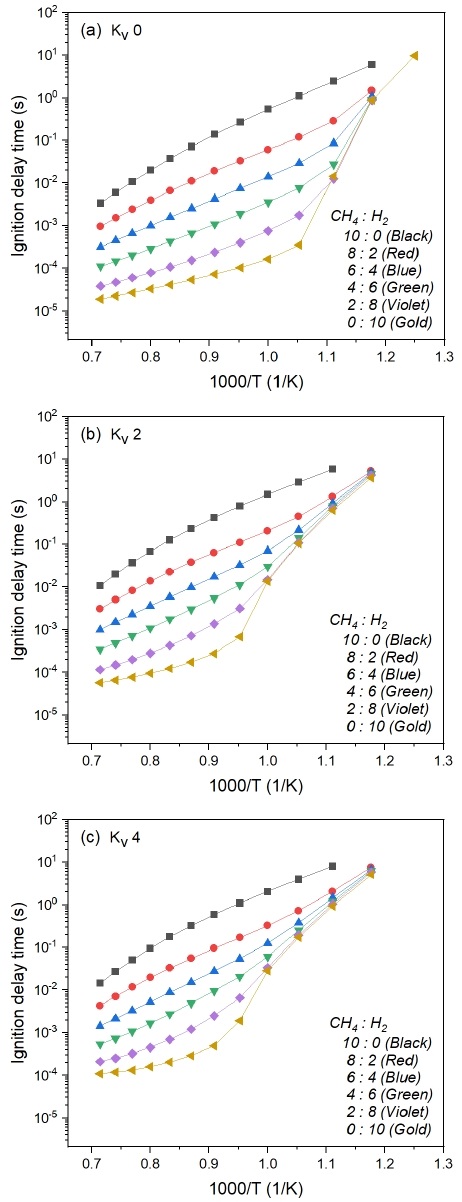
Fig. 3은 당량비(Φ) 0.9 조건에서 메탄과 수소의 혼합비 및 재순환율 변화에 따른 착화 지연 시간을 나타낸 것이다. 반응물의 초기 온도를 800 K에서 1,400 K까지 50 K의 간격으로 각 조건에 따른 착화 지연 시간을 분석하였다. 모든 경우에서 초기 온도 상승 및 수소 혼소율 증가에 따라 착화 지연 시간이 짧아지는 것으로 나타났다. 착화 지연 시간이 짧다는 것은 반응물이 초기 온도보다 200 K 증가하는 시간이 짧아진다는 것을 의미하며, 이는 연료와 산화제의 반응 속도 증가로 인해 연소 반응이 촉진된 결과이다. 높은 초기 온도는 반응물의 현열을 증가시켜 자발화(self-ignition)에 요구되는 라디칼 형성을 촉진하여 착화 지연 시간을 단축하는 효과가 있기 때문이다.
Fig. 3에서 동일한 KV의 경우, 수소 혼소율이 증가할수록 착화 지연 시간이 짧아지는 것을 확인할 수 있다. 이는 H2가 가지는 빠른 화학 반응 특성(fast chemistry)으로 인해 같은 초기 온도에서 CH4보다 빠르게 착화한 것으로 분석된다. 특히, 1,000 K 이상의 고온 영역에서는 연료 조성에 따라 착화 지연 시간의 큰 차이를 보이나, 1,000 K 이하의 저온 영역에서는 수소 혼소율 변화에 대한 민감도가 감소하여 착화 지연 시간의 차이가 줄어드는 것으로 나타났다.
연료에 상관없이 KV가 증가함에 따라 착화 지연 시간이 길어지는 것을 확인할 수 있다. KV의 증가에 따라 착화 지연 시간이 길어지는 것은 재순환율 증가에 따라 초기 반응물 내 CO2와 H2O 분율이 커지고, 희석 효과에 의해 착화 온도까지 도달하기 위해서는 높은 에너지가 요구되기 때문이다. 앞서 설명한 바와 같이 MILD 연소는 공간에서의 연료와 산화제의 혼합율을 높여 예혼합 혹은 부분 예혼합과 유사한 연소 특성을 가지게 되며 이로 인해 화학 반응 특성 시간(chemical time scale)과 난류 특성 시간(turbulent time scale)의 비로 표현되는 Da 수가 1에 가깝다24). 그러므로 반응물의 착화 지연 시간이 길수록 MILD 연소 구현에 있어 긍정적으로 작용할 수 있다는 것을 의미한다. 그러므로 재순환율을 높일수록 착화 지연 효과로 인해 MILD 연소의 조건에 근접할 수 있음을 알 수 있다. 이를 근거로 반응물의 초기 온도는 Fig. 1과 같이 자발화 온도와 연관되어 있기 때문에 높은 수소 혼소율에서 수소의 빠른 화학 반응을 억제하고 착화 지연 시간을 확보하기 위해서는 배가스 재순환율 강화를 통해 MILD 연소를 유도할 수 있을 것으로 기대된다.
3.2 연소 영역 변화(combustion modes)
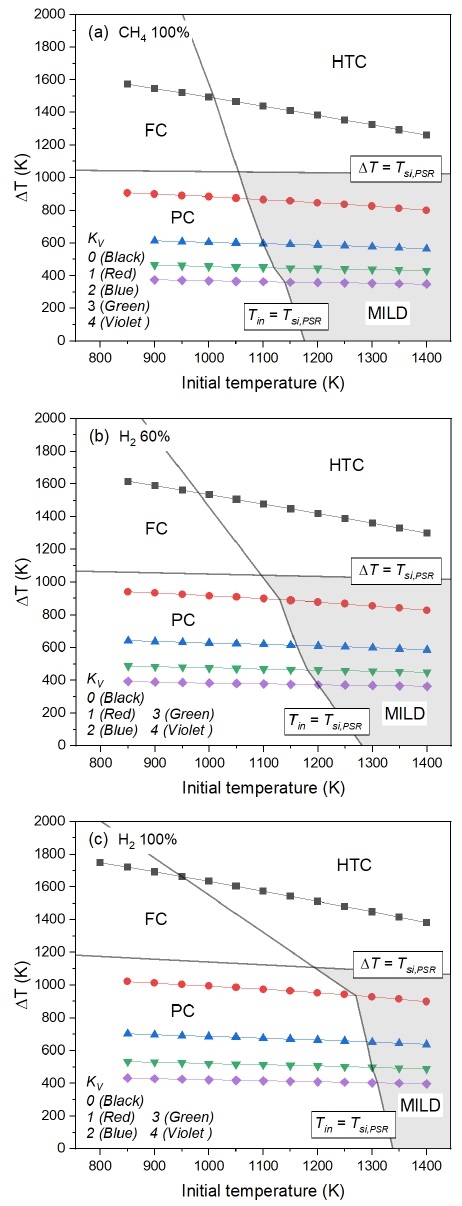
자발화 온도(self-ignition temperature)는 당량비, 압력, 반응물 조성 등에 영향을 받게 된다. 그렇기에 수소 혼소율과 재순환율에 따른 MILD 연소의 가능성을 판단하기 위하여, 0D homogeneous reactor와 perfectly stirred reactor (PSR)를 활용하여 초기 온도에 따른 MILD 연소 영역의 변화를 살펴보았다. 앞서 Fig. 3에서 도출된 0D homogeneous reactor 모델 결과를 바탕으로, PSR 모델에서 메탄 연소의 자발화 온도(Tsi,PSR)가 1,000 K8)를 만족하는 조건을 적용하였으며 수소 혼소율과 재순환율에 따른 초기 온도(Tin)와 온도 변화량(ΔT)를 Figs. 4, 5에 나타냈다. 이때 inlet gas 조성에 따른 Tsi,PSR을 Tin=Tsi,PSR 선으로 나타내고, ΔT와 Tsi,PSR이 동일해지는 지점을 예측하여 ΔT=Tsi,PSR 선으로 나타내 Fig. 1에 따라 FC, HTC, PC 그리고 MILD로 구분하였다. 참고로 해당 영역의 구분은 실제 실험 환경에 따라 달라질 수 있으며, 선행 연구로서의 사전 분석 결과이다.
Fig. 4는 각각 연료를 CH4 100%, CH4/H2 40/60%, H2 100%로 고정하고 KV를 0에서 4까지 변화하며 연소 영역에 대해 분석한 결과이다. 연료의 종류와 관계없이 KV가 증가할수록 ΔT는 감소하고 Tsi,PSR은 증가하는 경향을 나타냈다. 앞서 정의된 Tin=Tsi,PSR 선과 ΔT=Tsi,PSR 선으로 연소 영역을 구분하면 재순환이 없는 경우에는 모든 조건에서 높은 ΔT로 인해 MILD 연소 영역에 부합되는 조건이 없었으나 재순환이 고려되는 조건에서 MILD 연소 영역이 나타나는 것을 확인할 수 있다. 이는 재순환으로 인해 inlet gas에 연료의 분율이 작아지면서 발생한 희석 효과로 인해 온도 상승이 억제된 결과이다. 일반적으로 재순환이 배제된 경우에는 수소의 높은 반응성으로 인해 수소 혼소율이 증가함에 따라 Tsi,PSR은 감소하게 된다. 하지만 재순환이 고려된 경우, 수소 혼소율이 증가할수록 inlet gas의 H2O 분율이 증가하게 되고, 이로 인해 Tsi,PSR이 증가하여 Fig. 4와 같이 Tin=Tsi,PSR 선이 전체적으로 고온 방향인 오른쪽으로 이동한 것을 볼 수 있다. 수소 연소로부터 생성된 다량의 H2O는 반응기 내부에서 재순환하게 되고 H2O의 잠열에 의해 높은 자발화 에너지가 요구된다. 이로 인해 Tsi,PSR이 증가하게 되어 CH4 100%일 때보다 H2 100%인 경우에서 MILD 연소 영역이 감소하였다.
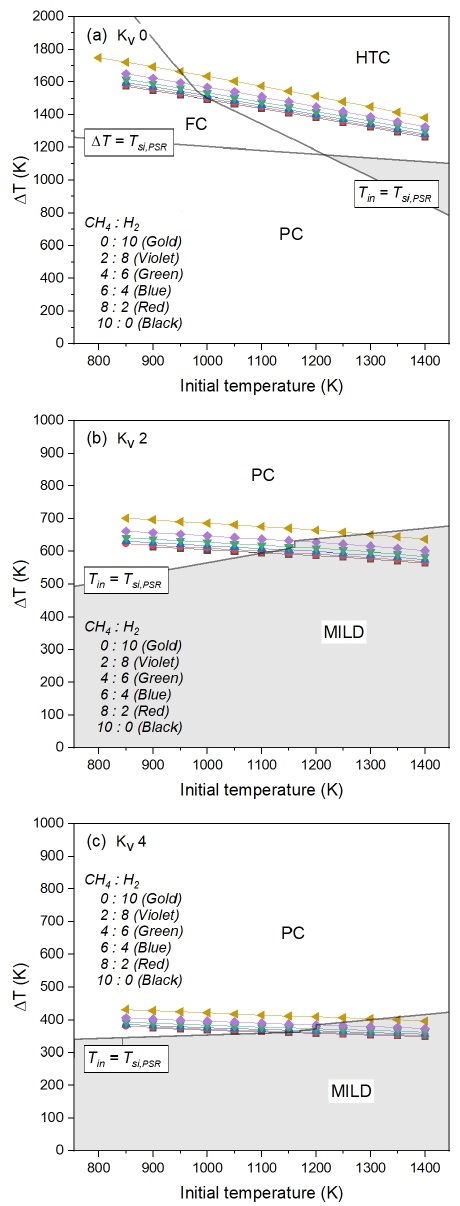
재순환이 고려된 경우, 수소 혼소율에 따른 MILD 연소 영역 변화에 대한 분석을 위해 KV를 각각 0, 2, 그리고 4로 고정한 조건에서의 연소 영역 예측 결과를 Fig. 5에 나타냈다. Fig. 5(a)의 재순환이 없는 경우, 수소 혼소율이 높아짐에 따라 ΔT는 증가하고 Tsi,PSR은 감소하는 경향을 보인다. 수소의 높은 반응성으로 인해 착화 온도가 낮아지게 되며, 높은 단열 화염 온도로 인해 반응 후 최대 온도가 상승한 결과를 나타낸다. Fig. 4와 Fig. 5(a)에서 네 가지 연소 영역이 모두 나타나는 것과는 달리 Fig. 5(b), (c)에서는 PC와 MILD 연소 영역만 나타난다. 그 이유는 재순환이 있을 때의 낮은 온도 변화량(ΔT)으로 인해 ΔT=Tsi,PSR 선이 초기 온도가 800 K 이하에서 형성되기 때문이다. 따라서 그래프에 나타난 모든 영역은 ΔT가 Tsi,PSR보다 작은 영역이며, Tin이 Tsi,PSR보다 큰 Tin=Tsi,PSR 선의 하단 부분이 MILD 연소 영역이 된다. Fig. 5(b)와 (c)에서 KV가 증가함에 따라 배가스의 H2O 분율이 증가하여 Tsi,PSR이 증가하는 것을 볼 수 있다. 수소의 높은 반응성으로 인해 낮은 온도에서 착화가 가능함에도 불구하고, 이와 같은 결과를 나타내는 것은 H2의 반응 속도보다 재순환에 의한 영향이 더 지배적임을 보여준다. 또한 H2 분율이 0%에서 100%까지의 ΔT의 차이가 약 100 K의 차이로 미미한 것으로 보아 온도 변화량 역시 재순환율에 비해 수소 혼소율에 의한 영향력이 작다는 것을 확인할 수 있다.
Fig. 5(b)와 (c)에서 재순환으로 인해 MILD 영역이 형성됨에도 불구하고, KV 4인 경우는 KV 2와 비교하여 전체적으로 MILD 영역이 감소하는 것으로 나타났다. 이는 높은 재순환율에서 ΔT가 급격히 감소하게 되고 반응물 내 높은 증기 함량으로 인하여 Tsi,PSR이 증가하게 된 결과이다. 따라서 안정적인 MILD 연소를 구현하기 위해서는 KV 2에서의 연구가 중요할 것으로 판단된다. 또한 MILD 연소 구현에는 반응물의 초기 온도에 대한 고려가 역시 필요할 것이다. Fig. 4에서 반응물의 초기 온도가 약 1,300 K 이상일 때, 연료의 종류에 상관없이 MILD 연소 영역에 포함되는 것을 확인할 수 있다. 이러한 예측 결과를 바탕으로 MILD 연소에서의 NOx 배출 특성에 대한 분석을 위해서는 반응물의 초기 온도 1,300 K에 대한 조건을 기준으로 재순환율 및 수소 혼소율에 따른 NOx 배출 변화를 살펴보는 것이 합리적이다.
3.3 NO 배출 변화(NO emission)
MILD 연소에서의 NOx 배출 특성을 분석하기 위해, 모든 경우에서 MILD 연소 영역에 해당하는 반응물의 초기 온도를 1,300 K로 고정하여 NOx 생성을 예측하였다. 이때 NO2는 NO에 비해 매우 소량 생성되므로 NO를 NOx로 대변한다. 여기서 H2 100%, KV 4, 당량비 0.9인 조건에서는 Tsi,PSR이 1,300 K 이상이므로 초기 온도가 1,300 K일 때는 PC 영역에 해당하기 때문에 MILD 연소에 대한 분석에서 배제하였다.
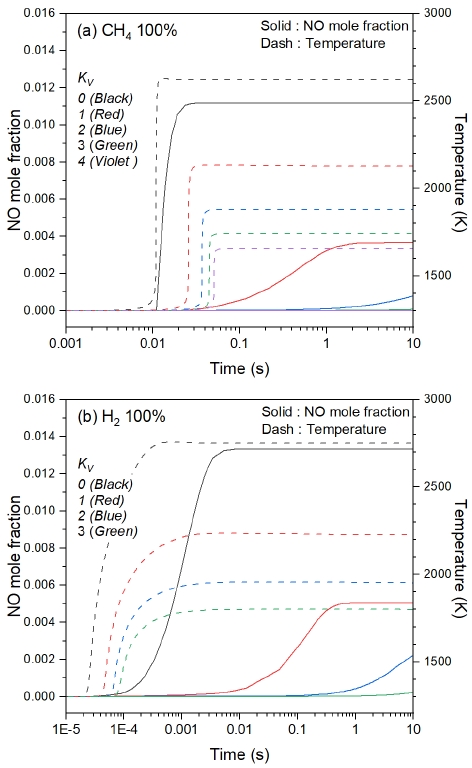
Fig. 6은 당량비 0.9 조건에서 재순환율에 따른 NO 배출량에 대해 분석한 결과이다. 모든 연료에서 KV가 증가함에 따라 NO 배출량이 감소하며 생성 속도가 감소하는 것을 확인할 수 있다. 이는 Fig. 4에서 나타난 KV가 증가함에 따라 ΔT가 감소하는 경향과 일치하며, 이로부터 ΔT의 감소는 NO 생성을 저감하는 효과가 있다는 것을 알 수 있다. 특히 KV가 2로 증가하면서 NO 증가율이 완만해지는데, 이는 높은 재순환율을 통해 NO 생성 속도를 감소시켜 NO가 상대적으로 느리게 생성되었다는 것을 의미한다. Fig. 6(a)의 CH4 100%와 비교하여 Fig. 6(b)의 H2 100%에서는 모든 재순환율에서 최종 생성된 NO의 몰분율이 증가하며 NO가 더 빠르게 생성되는 것을 확인할 수 있다. 이로부터 수소 혼소 시, 높은 재순환율에서 연소 온도 제어를 통해 NO 생성에 관여된 화학 반응률을 감소시킴으로써 NO 배출량을 저감할 수 있을 것으로 생각된다.
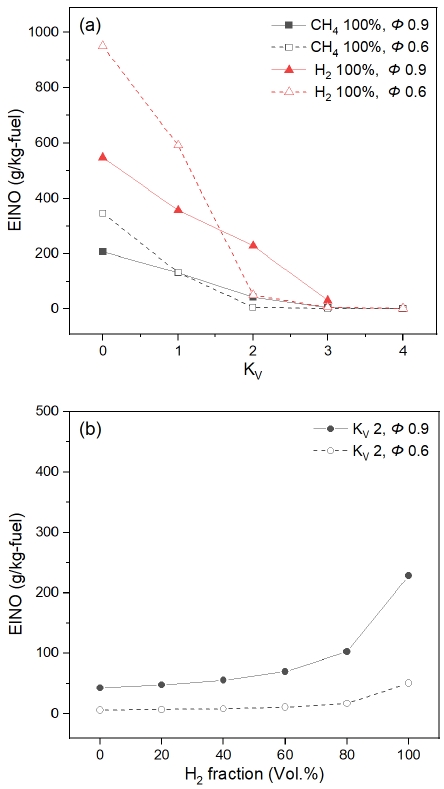
NO 생성에 대한 정량적 비교 및 분석을 위해, 식 (3)에 제시된 기준을 바탕으로 해석 조건별 emission index를 도출하여 Fig. 7에 나타냈다. Fig. 7(a)에서는 각각 CH4와 H2가 100%인 조건에서 당량비가 각각 0.6과 0.9인 경우, 재순환율에 따른 EINO를 나타냈다. 참고로 온도 결과를 통해 주 반응물에 의한 연소는 완료된 것으로 판단하였으며, 실제 실험 환경을 고려하여 반응물의 체류시간을 최대 10초로 가정하였다. 모든 조건에서 재순환율이 증가함에 따라 EINO는 감소하였으며 KV가 3 이상인 경우 매우 낮은 값을 나타내어 MILD 연소의 대표적인 저NOx 배출 특성을 잘 모사하였다. 이는 재순환으로 인해 연료가 희석되고 반응 후 온도가 감소하여 Figs. 4, 5와 같이 ΔT가 감소하기 때문에 thermal-NOx의 생성이 저하되었음을 보여준다.
일반적으로 당량비 0.9 부근에서 NOx 최대치를 나타내며 저 당량비에서 연료가 희석되어 NOx 생성량이 감소하는 것으로 알려져 있다25). 이는 KV가 2 이상일 때, 당량비 0.9인 경우가 0.6인 경우보다 높은 EINO를 나타내는 것에서 확인할 수 있다. 그러나 KV가 1 이하에서는 당량비 0.6에서 낮은 EINO를 나타내며 실험적 접근을 통해 이에 대한 추가 분석이 필요할 것으로 생각된다.
Fig. 7(b)는 KV를 2로 고정하고 수소 혼소율과 당량비 변화에 따른 EINO를 나타낸 결과이다. 모든 조건에서 수소 혼소율이 증가할수록 EINO는 증가하게 된다. 또한 모든 경우에서 저 당량비에서의 NO 생성량이 낮은 것으로 나타났다. 당량비가 0.9인 경우 H2 60%까지는 소폭 증가하다가 H2 80% 이상 조건에서 EINO가 103 g/kg-fuel에서 228 g/kg-fuel로 약 2.2배 이상 급격하게 증가하는 것으로 나타났다. 반면, 당량비 0.6인 경우 H2 80%까지 EINO는 큰 변화가 없었으나 H2 100% 조건에서 81 g/kg-fuel로 증가하였다. 이는 당량비 0.9에서 수소 혼소율이 낮은 조건에서의 EINO와 유사한 값으로 MILD 연소에서 수소 혼소시 당량비에 대한 고려가 중요하다는 것을 의미한다.
특정 조건에서 상대적으로 높은 NOx 생성량을 나타내는 것은 반응 후 온도가 매우 높은 온도에 형성되어 thermal-NOx가 다량 생성된 것으로 예측된다. 본 연구는 화학적, 반응적 특성만이 고려된 이상적인 조건에서의 모델을 활용한 수치해석 결과이므로 실제 연소 시스템에서는 물리적인 운전 조건 변경 및 최적화를 통해 추가적인 NOx 저감의 가능성이 있다고 생각된다.
3.4 NO 생성 경로(NO formation pathway)
지금까지 메탄-수소 혼소에 따른 착화 지연, 연소 영역 및 NOx 배출 특성에 대해 분석하였다. Fig. 7과 같이 MILD 연소 조건에서 재순환율 및 수소 혼소율 변화에 따른 EINO 예측 결과를 도출하였다. 이에 대한 구체적인 분석을 위해 당량비 0.9 조건에서의 주요 조건에 대한 NO 생성 경로를 주요 화학종의 생성량(rate of production, ROP)에 근거하여 Figs. 8, 9에 나타낸 것이다.
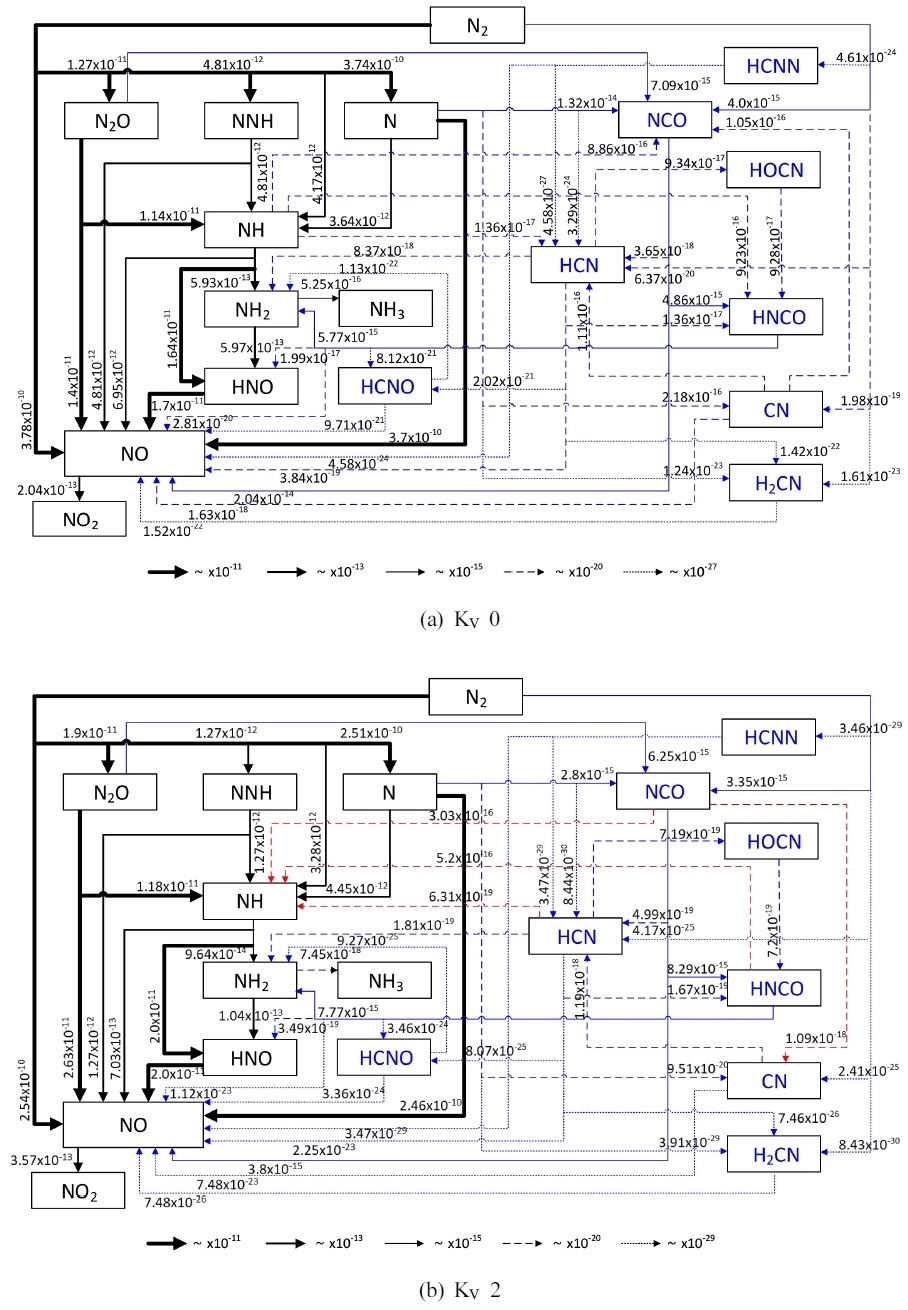
Fig. 8은 재순환 유무에 따른 CH4 100% 조건에서의 NO 생성 경로를 분석한 결과이다. Fig. 7(a)에서 재순환으로 인해 EINO가 207 g/kg-fuel에서 43 g/kg-fuel로 약 4.8배 차이로 감소한 것은 앞서 분석한 바와 같이 ΔT의 감소로 인해 thermal-NOx의 생성이 감소한 결과이다. 이와 동일한 결과로, Fig. 8에서 재순환이 고려된 경우 NO에 관여된 ROP는 재순환이 없을 때보다 대부분의 주요 화학 반응에서 낮게 나타났다. 그러나 N2→N2O→NO 반응 경로의 ROP는 증가하는 것으로 보아 배가스 재순환에 따라 N2O intermediate route26)의 영향력이 커지는 것을 알 수 있다. 또한 NH→HNO 반응 경로의 ROP가 증가한 것은 재순환에 의해 inlet gas 내 고온의 증기분율이 증가함에 따라 HNO로의 반응이 활성화되는 것으로 판단된다. Fig. 8(b)에서 붉은색 반응 경로는 재순환으로 인해 반응 경로가 정반응에서 역반응으로 변경된 것을 나타낸 것이다. 이로부터 재순환이 고려된 경우, 탄소가 포함된 중간 생성물(intermediate species)의 탈탄소화(decarbonization) 반응을 통해 NH 생성이 증가함을 알 수 있다.
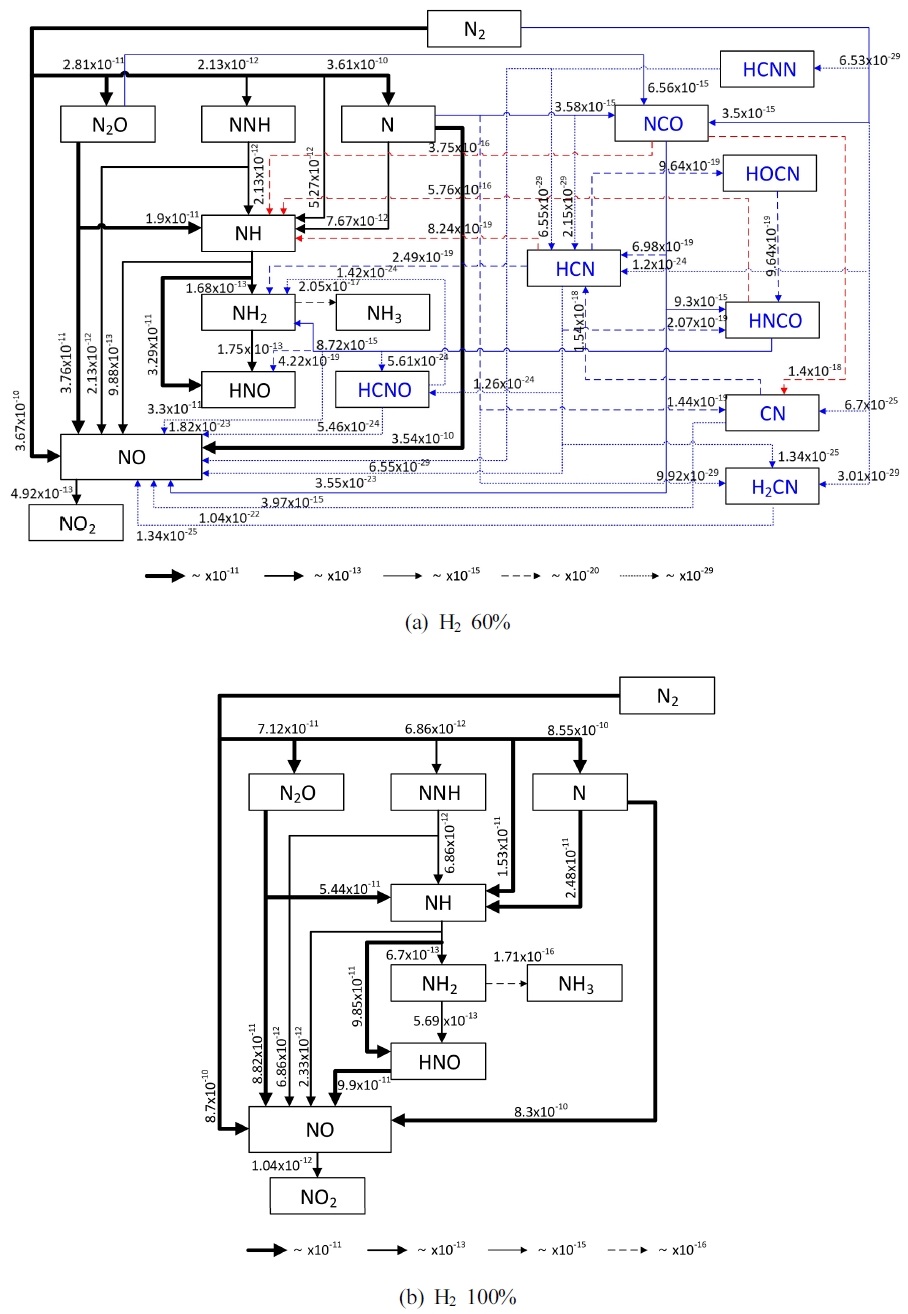
Fig. 9는 KV를 2로 고정하였을 때, 수소 혼소율에 따른 NO 생성에 대한 경로를 분석한 결과이다. 동일한 KV에서 수소 혼소로 인한 NO 생성 경로의 정성적인 큰 변화는 없으며, ROP의 값이 증가하는 결과를 보였다. Fig. 7(b)에서 당량비가 0.9인 경우 CH4 100%와 H2 60%의 EINO는 각각 43 g/kg-fuel과 70 g/kg-fuel으로 CH4 100% 대비 H2 60%에서 수소 혼소로 인해 EINO가 약 1.6배 증가하였다. 또한 Fig. 8(b)와 Fig. 9(a)를 비교하였을 때, 연료 내 수소 함량이 높아짐에 따라 탄소 함량이 낮아짐에도 불구하고 대부분의 NO 생성과 연관된 반응 경로에서의 ROP가 증가하는 경향을 보인다. 이는 수소 혼소로 인해 단열 화염 온도가 증가하여 thermal-NOx 생성이 증가한 것으로 예상된다. 또한 특징적으로 수소 혼소율 증가에 따라 N2→NH와 N→NH의 ROP가 크게 증가하는 것은 NH 반응 경로가 강화되었음을 보여주며, 이는 재순환이 고려된 MILD 연소에서의 수소 혼소시 NNH route27)의 중요성을 알 수 있다. 참고로 C-생성물의 ROP는 10-29에서 10-15로 NO 생성 과정에 대한 영향력은 상대적으로 크지 않은 것으로 판단된다.
Fig. 9(b)에서의 H2 100%의 경우, C의 부재로 인해 NO 생성 경로가 간소화되는 것을 Fig. 9(b)에서 확인할 수 있다. 당량비 0.9, KV 2, H2 100% 조건에서 Fig. 7(b)의 EINO는 228 g/kg-fuel로, H2 60%일 때보다 약 3.2배 NO 생성량이 증가하였다. 이로 인해 NO 생성에 관여한 ROP가 전체적으로 증가하는 경향을 나타낸 것으로 판단된다. 특히 탄소가 포함되어 있는 Fig. 8 그리고 Fig. 9(a)에서는 NH의 생성에 N2O의 영향력이 지배적이었으나, H2 100%에서는 연료 내 H2 함량 및 반응물 내 H2O 분율 증가로 N→NH 반응 경로의 영향력이 높아지게 된다. 결과적으로 수소 혼소에 따른 NOx 배출 저감을 위해 MILD 연소 적용 시, N2O intermediate route 및 NNH route 반응 경로에 대한 심층적인 연구가 필요할 것으로 사료된다.
4. 결 론
본 연구는 CHEMKIN의 0D 예혼합 연소 모델과 GRI-Mech 2.11 반응 기구를 활용하여 배가스 재순환이 고려된 MILD 연소에서의 메탄-수소 혼소 연소 특성과 NOx 배출 특성을 분석 및 예측하기 위하여 수행되었다. 이를 통해 착화 지연 및 연소 영역 분석을 통해 수소 혼소 및 배가스 재순환율에 따른 연소 영역을 규정하였으며, 화학적 반응 분석을 통해 NOx 배출량 및 생성 경로를 예측하였다.
메탄-수소 혼소에서 수소 혼소율이 증가할수록 H2가 가지는 빠른 화학 반응 특성으로 인해 착화 지연 시간이 짧아졌다. 재순환율이 증가함에 따라 착화 지연 시간이 길어지며, 이는 재순환율 증가에 따른 희석 효과에 의한 것으로 분석된다. 이를 통해 수소 혼소시 빠른 화학 반응을 억제하기 위해 재순환율을 높여 느린 착화 지연 시간을 유도할 수 있다.
Inlet gas에 따른 자발화 온도(Tsi,PSR)와 온도 변화량(ΔT)을 통해 각 조건에 대한 연소 영역을 예측하였다. 재순환이 고려된 경우에는 수소 혼소율이 증가할수록 inlet gas의 H2O 분율이 증가하여 CH4 100%일 때보다 H2 100%인 경우에서 MILD 연소 영역이 감소하였다. 재순환율이 증가할수록 ΔT는 감소하고 Tsi,PSR은 증가하는 경향에 의해 KV가 4 이상일 때는 MILD 연소 영역이 오히려 감소하는 결과를 나타냈다.
NOx 배출량은 재순환율이 증가함에 따라 EINO는 감소하였으며 KV가 3 이상인 경우 매우 낮은 값을 나타내어 MILD 연소를 통한 NOx 저감 효과를 잘 모사하는 것을 확인하였다. KV가 2일 때, 수소 혼소율이 증가할수록 EINO가 증가하는데, 이는 H2 60%까지는 완만하게 증가하다가 H2 80% 이상 조건에서 급격하게 증가하는 것으로 나타났다.
CH4 100% 조건에서 재순환이 고려되면 대부분의 주요 화학 반응에서 ROP가 낮게 나타났으나 N2O intermediate route의 ROP가 다소 증가하였다. 또한 탄소가 포함된 중간 생성물의 탈탄소화를 통해 NH 생성이 증가함을 알 수 있다. 동일한 재순환율에서는 수소 혼소율 증가에 따라 NH가 생성되는 반응이 강화되는 것을 통해 NNH route의 중요성을 확인하였다.
향후 수소 혼소 시 NOx 배출 저감을 위해서는 반응 경로에서 N2O intermediate route 및 NNH route에 대한 심층적인 분석과 실제 시스템을 활용한 실험적 접근이 필요할 것으로 사료된다.
Acknowledgments
본 논문은 한국생산기술연구원 기관주요사업 “탄소중립을 위한 암모니아 기반 청정 수소 생산 기술 개발(KITECH JD-220001)”의 지원으로 수행되었습니다.
References
-
J. Nowotny and T. N. Veziroglu, “Impact of hydrogen on the environment”, Int. J. Hydrogen Energy, Vol. 36, No. 20, 2011, pp. 13218-13224.
[https://doi.org/10.1016/j.ijhydene.2011.07.071]

-
W. Dougherty, S. Kartha, C. Rajan, M. Lazarus, A. Bailie, B. Runkle, and A. Fencl, “Greenhouse gas reduction benefits and costs of a large-scale transition to hydrogen in the USA”, Energy Policy, Vol. 37, No. 1, 2009, pp. 56-67.
[https://doi.org/10.1016/j.enpol.2008.06.039]

-
L. I. Lubis, I. Dincer, G. F. Naterer, and M. A. Rosen, “Utilizing hydrogen energy to reduce greenhouse gas emissions in Canada’s residential sector”, Int. J. Hydrogen Energy, Vol. 34, No. 4, 2009, pp. 1631-1637.
[https://doi.org/10.1016/j.ijhydene.2008.12.043]

-
M. Pudukudy, Z. Yaakob, M. Mohammad, B. Narayanan, and K. Sopian, “Renewable hydrogen economy in Asia – opportunities and challenges: an overview”, Renewable and Sustainable Energy Reviews, Vol. 30, 2014, pp. 743-757.
[https://doi.org/10.1016/j.rser.2013.11.015]

-
Y. Joo, M. Kim, J. Park, S. Park, and J. Shin, “Hydrogen enriched gas turbine: core technologies and R&D trend”, Trans Korean Hydrogen New Energy Soc, Vol. 31, No. 4, 2020, pp. 351-362.
[https://doi.org/10.7316/KHNES.2020.31.4.351]

-
A. E. E. Khalil and A. K. Gupta, “Hydrogen addition effects on high intensity distributed combustion”, Applied Energy, Vol. 104, 2013, pp. 71-78.
[https://doi.org/10.1016/j.apenergy.2012.11.004]

-
V. K. Arghode and A. K. Gupta, “Hydrogen addition effects on methane–air colorless distributed combustion flames”, Int. J. Hydrogen Energy, Vol. 36, No. 10, 2011, pp. 6292-6302.
[https://doi.org/10.1016/j.ijhydene.2011.02.028]

-
A. Cavaliere and M. de Joannon, “Mild combustion”, Progress in Energy and Combustion science, Vol. 30, No. 4, 2004, pp. 329-366.
[https://doi.org/10.1016/j.pecs.2004.02.003]

- P. Bozza, “Development of a fuel flexible, high efficiency combustion unit”, University of Naples Federico II Ph.D thesis, 2017. Retrieved from http://www.fedoa.unina.it/12213/1/Bozza_Pio_30.pdf, .
-
J. A. Wünning and J. G. Wünning, “Flameless oxidation to reduce thermal NO-formation”, Progress in Energy and Combustion Science, Vol. 23, No. 1, 1997, pp. 81-94.
[https://doi.org/10.1016/S0360-1285(97)00006-3]

-
S. Taamallah, K. Vogiatzaki, F. M. Alzahrani, E. M. Mokheimer, M. A. Habib, and A. F. Ghoniem, “Fuel flexibility, stability and emissions in premixed hydrogen-rich gas turbine combustion: technology, fundamentals, and numerical simulations”, Applied Energy, Vol. 154, 2015, pp. 1020-1047.
[https://doi.org/10.1016/j.apenergy.2015.04.044]

-
A. Mardani and S. Tabejamaat, “Effect of hydrogen on hydrogen–methane turbulent non-premixed flame under MILD condition”, Int. J. Hydrogen Energy, Vol. 35, No. 20, 2010, pp. 11324-11331.
[https://doi.org/10.1016/j.ijhydene.2010.06.064]

-
A. Parente, C. Galletti, and L. Tognotti, “A simplified approach for predicting NO formation in MILD combustion of CH4–H2 mixtures”, Proceedings of the Combustion Institute, Vol. 33, No. 2, 2011, pp. 3343-3350.
[https://doi.org/10.1016/j.proci.2010.06.141]

-
P. Li, F. Wang, J. Mi, B. B. Dally, Z. Mei, J. Zhang, and A. Parente, “Mechanisms of NO formation in MILD combustion of CH4/H2 fuel blends”, Int. J. Hydrogen Energy, Vol. 39, No. 33, 2014, pp. 19187-19203.
[https://doi.org/10.1016/j.ijhydene.2014.09.050]

-
G. Ali, T. Zhang, W. Wu, and Y. Zhou, “Effect of hydrogen addition on NOx formation mechanism and pathways in MILD combustion of H2-rich low calorific value fuels”, Int. J. Hydrogen Energy, Vol. 45, No. 15, 2020, pp. 9200-9210.
[https://doi.org/10.1016/j.ijhydene.2020.01.027]

-
M. M. Noor, A. P. Wandel, and T. Yusaf, “Analysis of recirculation zone and ignition position of non-premixed bluff-body for biogas MILD combustion”, International Journal of Automotive and Mechanical Engineering, Vol. 8, No. 1, 2013, pp. 1176-1186. Retrieved from http://eprints.usq.edu.au/id/eprint/24981, .
[https://doi.org/10.15282/ijame.8.2013.8.0096]

-
B. F. Magnussen and B. H. Hjertager, “On mathematical modeling of turbulent combustion with special emphasis on soot formation and combustion”, Symposium (International) on Combustion, Vol. 16, No. 1, 1977, pp. 719-729.
[https://doi.org/10.1016/S0082-0784(77)80366-4]

-
A. Parente, M. R. Malik, F. Contino, A. Cuoci, and B. B. Dally, “Extension of the Eddy Dissipation Concept for turbulence/chemistry interactions to MILD combustion”, Fuel, Vol. 163, 2016, pp. 98-111.
[https://doi.org/10.1016/j.fuel.2015.09.020]

-
M. T. Lewandowski and I. S. Ertesvåg, “Analysis of the Eddy Dissipation Concept formulation for MILD combustion modelling”, Fuel, Vol. 224, 2018, pp. 687-700.
[https://doi.org/10.1016/j.fuel.2018.03.110]

- C.T. Bowman, R.K. Hanson, D.F. Davidson, W.C. Gardiner, Jr., V. Lissianski, G.P. Smith, D.M. Golden, M. Frenklach and M. Goldenberg, “GRI-Mech 2.11”, 1995. Retrieved from http://combustion.berkeley.edu/gri-mech/, .
-
A. Mardani, S. Tabejamaat, and S. Hassanpour, “Numerical study of CO and CO2 formation in CH4/H2 blended flame under MILD condition”, Combustion and Flame, Vol. 160, No. 9, 2013, pp. 1636-1649.
[https://doi.org/10.1016/j.combustflame.2013.04.003]

-
Y. J. Kim, C. B. Oh, and O. Fujita, “Prediction performance of chemical mechanisms for numerical simulation of methane jet MILD combustion”, Advances in Mechanical Engineering, Vol. 5, 2013, pp. 138729.
[https://doi.org/10.1155/2013/138729]

-
M. Ravikanti, M. Hossain, and W. Malalasekera, “Laminar flamelet model prediction of NOx formation in a turbulent bluff-body combustor”, Proceedings of the Institution of Mechanical Engineers, Part A: Journal of Power and Energy, Vol. 223, No. 1, 2009, pp. 41-54.
[https://doi.org/10.1243/09576509JPE569]

-
J. Abraham, F. A. Williams, and F. V. Bracco, “A discussion of turbulent flame structure in premixed charges”, SAE Transactions, Vol. 94, 1985, pp. 128-143. Retrieved from http://www.jstor.org/stable/44467411, .
[https://doi.org/10.4271/850345]

- A. M. Y. Razak, “Industrial gas turbines: performance and operability”, Woodhead Publishing, UK, 2007.
- S. R. Turns, “An introduction to combustion: concepts and applications”, McGraw-Hill, USA, 1996.
-
J. W. Bozzelli and A. M. Dean, “O + NNH: a possible new route for NOX formation in flames”, Int. J. Chem. Kinet., Vol. 27, No. 11, 1995, pp. 1097-1109.
[https://doi.org/10.1002/kin.550271107]