직접내부개질형 용융탄산염 연료전지(DIR-MCFC)의 운전 조건에 따른 성능 분석
2022 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
In this study, the operation characteristics of the internal reforming type molten carbonate fuel cell (MCFC) were studied using computational fluid dynamics (CFD) analysis according to the steam to carbon ratio (S/C ratio), operating temperature, and gas utilization. From the simulation results, the distribution of gas composition due to the electrochemical reaction and the reforming reaction was predicted. The internal reforming type showed a lower temperature difference than the external reforming type MCFC. As the operating temperature decreased, less hydrogen was produced and the performance of the fuel cell also decreased. As the gas utilization rate decreased, more gas was injected into the same reaction area, and thus the performance of the fuel cell increased.
Keywords:
Molten carbonate fuel cell, Computational fluid dynamics, S/C ratio, Operating temperature, Gas utilization키워드:
용융탄산염 연료전지, 전산 유체 역학, S/C 비율, 작동 온도, 가스 이용률1. 서 론
최근 환경 문제가 대두되면서 수소 생산, 연료전지와 관련된 다양한 기술들이 연구되고 있다. 용융탄산염 연료전지(moltean carbonate fuel cell, MCFC)는 600℃ 이상의 고온에서 운전되기 때문에 백금과 같은 귀금속 촉매가 필요하지 않아 경제성이 뛰어나다. 이러한 고온형 연료전지는 전지 내에서 전기화학 반응과 개질 반응이 동시에 발생할 수 있어, 내부개질(internal reforming)을 통해 수소를 생산하고, 연료전지를 운전할 수 있다1). 한편, 전산 유체 역학(computational fluid dynamics, CFD)은 연료전지의 연구 분야에서 다양하게 사용되고 있다. 연료전지의 크기, 유로의 형태 등을 실제 실험에서 진행하기에는 높은 비용이 필요하기 때문이다2,3).
이에 따라 CFD를 이용한 MCFC의 연구들이 다양하게 진행되고 있다. Kim 등4)은 CFD를 이용하여 MCFC의 유동 방향 및 연료전지의 크기에 따른 운전 특성을 비교하였다. 그들은 대면적 연료전지에서 co-flow의 유동 방향을 사용하였을 때, 가장 안정적으로 운전 가능한 것을 확인하였다.
또한, Kim과 Lee5)는 CFD를 이용하여 내부 및 외부개질형 MCFC를 비교 분석하였다. Cross-flow의 유동 방향을 사용하는 MCFC에서는 외부 개질 대비, 내부 개질에서 안정적인 운전이 가능하다는 결론을 도출하였다.
본 연구에서는 메탄 수증기 개질을 이용한 직접내부개질형 MCFC에서 S/C ratio, 가스 이용률, 운전 온도에 따른 운전 특성을 CFD를 통해 비교 분석하였다.
2. 해석 방법
2.1 MCFC의 지배방정식
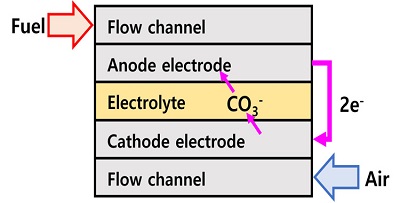
MCFC는 Fig. 1과 같이 용융탄삼염을 연료전지의 전해질로 사용한다. 연료극에서는 산화 반응으로 인해 수소와 탄산 이온이 결합하여 물, 이산화탄소와 함께 전기를 생성한다. 공기극에서는 환원 반응으로 인해 이산화탄소와 산소가 결합하여 탄산 이온을 생성하게 된다. 생성된 탄산 이온은 전해질을 통해 공기극에서 연료극으로 이동하게 된다. 연료극과 공기극에서의 반응식은 다음과 같다.
| (1) |
| (2) |
연료전지에서의 셀 전압(Vcell)은 식 (3)과 같이 네른스트 전위에서 내부의 셀 저항과 분극 저항을 제외한 값이다. 여기서 네른스트 전위(ENernst)는 식 (4)와 같다. 식 (4)에서 표준 포텐셜(E0)은 식 (5)와 같이 작동 온도의 함수로 표현된다.
| (3) |
| (4) |
| (5) |
공기극에서의 셀 저항(RCathode)과 연료극에서의 셀 저항(RAnode)은 식 (6)과 식 (7)을 사용하였고 분극 저항(ROhmic)은 식 (8)을 사용하였다. 위의 모델은 연료전지의 작동 온도와 화학종의 농도로 제어되는 Yuh and Selman의 전압 손실 모델이다6).
| (6) |
| (7) |
| (8) |
MCFC 전기화학 반응은 전해질과 전극 표면에서 발생하지만 본 연구에서는 Fig. 2에서와 같이 공기극과 연료극 사이의 면을 반응 표면(reaction surface)으로 정의하고 이 면에서 전기화학 반응이 발생한다고 가정하였다.
2.2 개질 반응 모델
본 연구의 내부개질형 연료전지에서는 메탄 수증기 개질 방법을 사용하였다. 메탄 수증기 개질은 다음과 같은 3가지의 반응으로 인해 수증기와 메탄이 수소로 전환된다. 여기서, ΔH는 개질 반응에서 엔탈피의 변화이다.
| (9) |
| (10) |
| (11) |
촉매는 연료극의 집전판에 고르게 분포되어 있다고 가정하였다. 또한 개질 반응을 속도로 제어하는 Froment의 개질 반응식을 사용하였다7). 식 (12), (13), (14)는 각각 습윤 개질에 대한 반응률 속도(r1), 수성 가스 전이에 대한 반응률 속도(r2), 복합 습윤 개질에 대한 반응률 속도(r3)이다.
| (12) |
| (13) |
| (14) |
| (15) |
반응률 속도 식에서 평형 상수(Keqi)와 개질 반응률 상수(ki)는 식 (16)과 식 (17)과 같다. 위의 식은 아레니우스식의 유형이며 지수의 인자와 활성화 에너지 그리고 흡수 엔탈피는 Table 1과 같다. 또한 전체 화학 반응의 반응 효율은 30%로 가정하였고, 이를 전체 반응식에 곱하여 사용하였다.
| (16) |
| (17) |
2.3 열전달 모델
연료전지는 전지 내부에서 엔탈피의 변화로 인해 열이 발생한다. 따라서 본 연구의 반응면에서 나타나는 전기화학 반응에 의한 발열량(qe)은 식 (18)과 같다8). 한편, 메탄 수증기 개질 반응은 강한 흡열 반응이고 수성 가스 전이 반응은 발열 반응이다. 이에 따라 식 (19)와 같이 각각의 반응율 속도와 엔탈피의 변화를 통해 계산할 수 있다. Table 2는 연료극과 공기극의 열물성이다.
| (18) |
| (19) |
2.4 해석 조건
S/C ratio는 수증기와 메탄의 몰 비율이다. 작동 온도 620℃와 가스 이용률 40%의 조건 하에서 S/C ratio가 2, 3, 4일 때 연료전지의 성능 등을 비교 분석하였다. 또한, S/C ratio 3과 작동 온도 620℃의 조건 하에서 가스 이용률이 40%, 60%, 80%일 때, S/C ratio 3과 가스 이용율 40%의 조건 하에서 작동 온도가 580℃, 620℃, 650℃일 때 연료전지의 운전 특성을 파악하였다. Table 3은 각 변수에 따른 해석 조건이다.
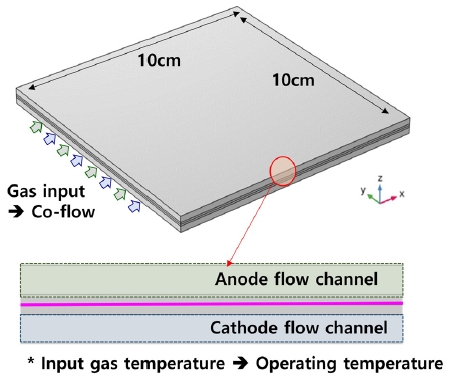
한편, 본 연구는 COMSOL Multiphysics 6.0 (COMSOL, Inc., Burlington, MA, USA)을 사용하여 가로, 세로 10 cm의 단위 전지 모델에서 해석을 진행하였다. 단위 전지 모델은 Fig. 3과 같다.
3. 결과 및 고찰
3.1 S/C ratio에 따른 연료전지의 해석 결과
Fig. 4는 S/C ratio가 3일 때, 연료전지의 연료극에서 유동 방향에 따른 각 화학종의 농도 분포이다. 개질 반응으로 인해 수증기와 메탄이 빠르게 감소하고 수소가 생성되었다. 또한, 유동 방향에 따라 이산화탄소가 생성되었다. 이는 개질 반응 중 수성 가스 전이 반응으로 인해 이산화탄소가 생성되었기 때문이다.
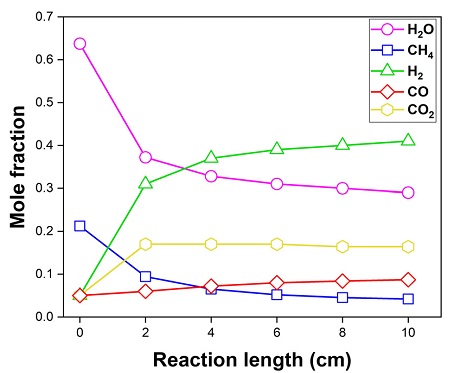
Mole fraction of gas composition according to the S/C ratio 3 in the absence of electrochemical reaction
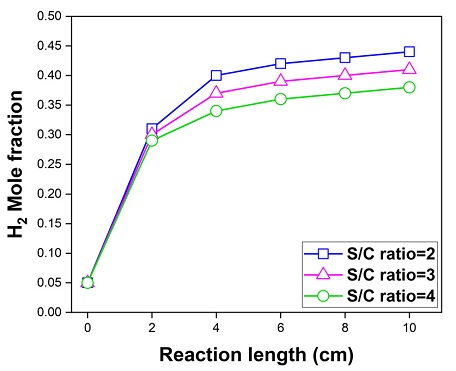
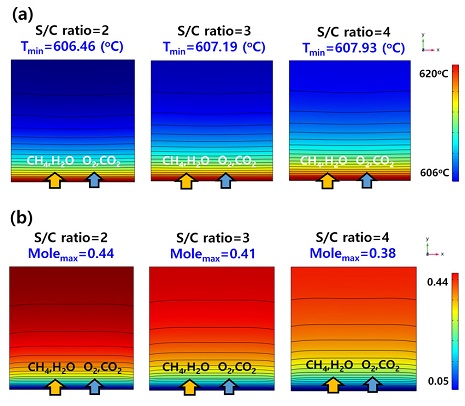
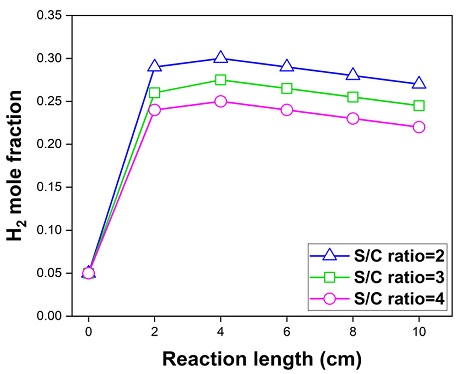
Fig. 5는 연료전지의 연료극에서 S/C ratio에 따른 수소 농도이다. S/C ratio가 2, 3, 4일 때 연료극에서의 최종 수소 몰 분율은 0.44, 0.41, 0.38로 S/C ratio가 감소함에 따라 더 많은 수소를 생산하였다. 또한, Fig. 6(a)과 같이 S/C ratio가 2, 3, 4일 때 연료전지에서 발생하는 최저 온도는 606.46℃, 607.19℃, 607.93℃이다. 이는 S/C ratio가 낮아짐에 따라 개질 반응으로 인해 상대적으로 더 많은 흡열 반응이 발생하여 연료전지의 온도가 낮아지는 것이다. Fig. 6은 S/C ratio에 따른 연료전지의 온도 분포와 수소 농도 분포이다.
Fig. 7은 S/C ratio에 따른 연료전지의 온도 분포이다. S/C ratio가 2, 3, 4일 때 연료전지에서 발생하는 최고 온도는 620.03℃, 624.55℃, 627.70℃이고 최저 온도는 615.92℃, 617.82℃, 618.90℃이다. 따라서 S/C ratio가 증가함에 따라 연료전지에서 발생하는 온도의 차가 증가함을 알 수 있다. 더 나아가, S/C ratio 2의 조건에서는 강력한 흡열 반응으로 인해 운전 온도와 유사한 온도에서 운전된다. 이는 연료전지의 안정적인 운전을 불가능하게 만든다.
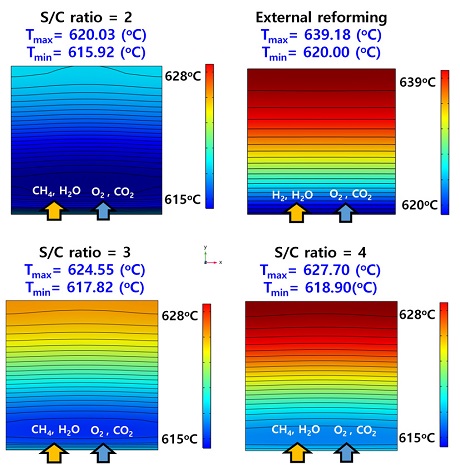
Temperature distribution of unit cell according to the S/C ratio and external reforming considering electrochemical reaction at 1,500 A/m2
한편, 외부개질형 연료전지의 최고 온도는 639.18℃이고 최저 온도는 620.00℃이다. 내부개질형 연료전지보다 외부개질형 연료전지에서 더 높은 온도 차가 발생하는 것을 확인할 수 있다.
Fig. 8은 S/C ratio에 따른 연료전지의 성능이다. 먼저, 외부개질형 연료전지 대비, 내부개질형 연료전지에서 연료전지의 성능이 저하됨을 확인할 수 있다. 본 연구에서는 외부개질형 연료전지에서 72%의 수소를 투입하는 것으로 가정하였다. 하지만 Fig. 5와 같이 내부개질형 연료전지 중, S/C ratio 2에서 44%로 가장 많은 수소를 생산하였다. 따라서 외부개질형 연료전지에 투입되는 수소에 비해 상대적으로 적은 양이기 때문에 이와 같은 결론에 도달하였다.
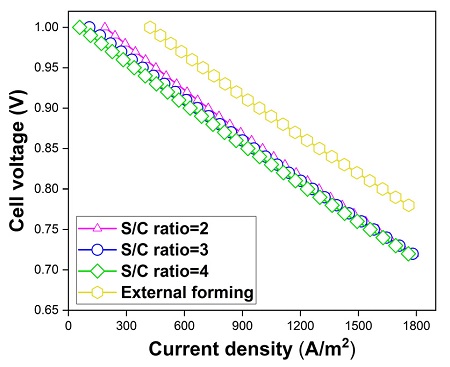
i-V curve of the unit cell according to the S/C ratio and external reforming in the electrochemical reaction
모든 S/C ratio의 조건에서 전류 밀도의 분포는 Fig. 9(a)와 같이 유동 방향에 따라 출구부에서 개질 반응 후에 발생하였다. 또한, 전류 밀도 1,500 A/m2에서 S/C ratio가 2, 3, 4일 때 셀 전압은 0.765 V, 0.762 V, 0.759 V로 S/C ratio에 따라 큰 차이를 보이지 않았다. Fig. 9는 S/C ratio에 따른 연료전지의 전류 밀도와 수소 농도의 분포이다.
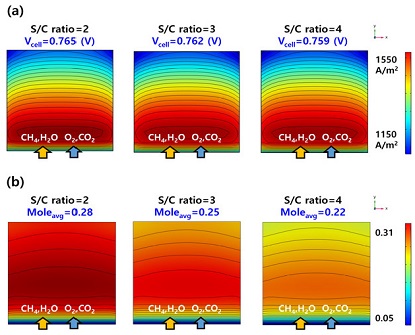
(a) Current density distribution of unit cell and (b) hydrogen distribution of anode according to the S/C ratio considering the electrochemical reaction at 1,500 A/m2
Fig. 10은 S/C ratio에 따른 수소의 농도이다. 투입구로부터 4 cm의 위치에서 S/C ratio가 2, 3, 4일 때 수소의 몰 분율은 0.30, 0.27, 0.24이다. 또한, 배출구에서는 0.27, 0.24, 0.22이다. 이에 따라 내부개질형 연료전지에서 개질 반응으로 인해 수소량이 증가하다 전기화학 반응으로 인해 감소하는 것을 확인할 수 있다.
3.2 작동 온도에 따른 연료전지의 해석 결과
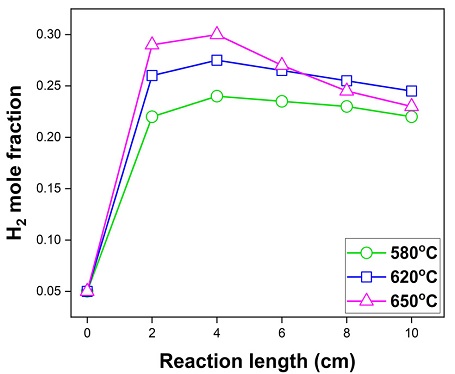
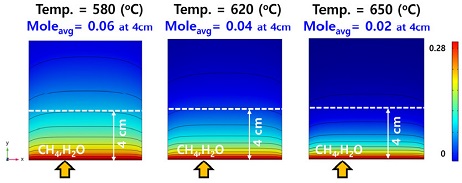
Fig. 11은 작동 온도에 따른 수소 농도의 비교 결과이다. 투입구로부터 4 cm 위치에서 작동 온도가 580℃, 620℃, 650℃일 때 수소의 몰 분율은 0.24, 0.27, 0.30이고 배출구에서는 0.22, 0.24, 0.23임을 알 수 있다. 이에 따라 Fig. 10과 유사하게 투입구로부터 수소가 증가, 감소하는 것을 확인할 수 있다. 하지만 수소의 감소 기울기는 온도가 높을수록 커졌다. 이는 작동 온도가 높을수록 더 많은 수소를 생산하게 되고 상대적으로 더 큰 전기화학 반응으로 인해 수소를 빠르게 소모하기 때문이다. Fig. 12는 작동 온도에 따른 수소와 메탄 농도의 분포이다.
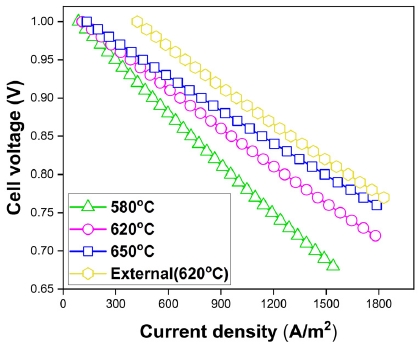
Fig. 13은 작동 온도에 따른 연료전지의 성능이다. 작동 온도 620℃에서의 외부개질형 연료전지보다 모든 작동 온도의 조건에서 내부개질형 연료전지의 성능이 저하되었다. 한편, 내부개질형 연료전지에서는 전류 밀도 1,500 A/m2에서 작동 온도가 580℃, 620℃, 650℃일 때 셀 전압은 0.688 V, 0.762 V, 0.799 V로 작동 온도가 증가할수록 성능이 우수하였다. 하지만 연료전지의 내구성을 고려하여 적합한 작동 온도를 선택해야 한다.
3.3 가스 이용률에 따른 연료전지의 해석 결과
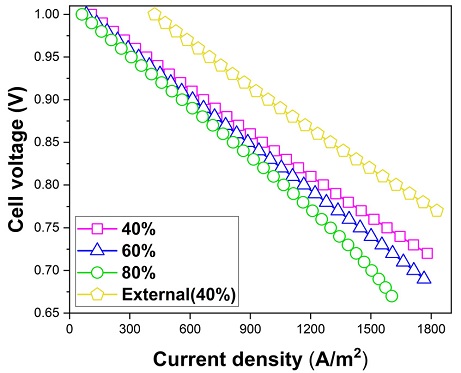
Fig. 14는 가스 이용률에 따른 전지의 성능 비교이다. 가스 이용률 40%의 외부개질형 연료전지 보다 모든 가스 이용률의 조건에서 내부개질형 연료전지의 성능이 저하되었다. 내부개질형 연료전지에서는 전류 밀도 1,500 A/m2에서 가스 이용률이 40%, 60%, 80%일 때 셀 전압은 0.762 V, 0.740 V, 0.700 V로 가스 이용률이 낮아짐에 따라 성능이 증가하였다.
본 연구에서는 연료전지에 투입되는 혼합 가스의 양은 반응 면적을 통해 필요한 가스의 투입량을 계산하게 되고, 식 (20)의 방법을 통해 혼합 가스의 투입량을 결정하게 된다. 따라서 이용률이 낮아짐에 따라 같은 반응 면적 대비, 더 많은 수소를 투입하게 되기 때문이다.
| (20) |
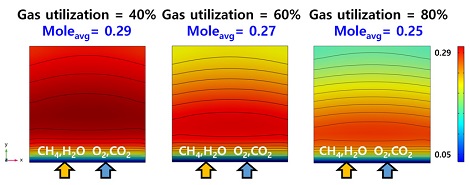
하지만 너무 낮은 가스 이용률은 미반응 상태의 수소가 많아 효율적인 수소 활용을 할 수 없다는 단점이 있다. Fig. 15는 연료전지의 연료극에서 가스 이용률에 따른 수소 분포이다. Table 4는 가스 이용률에 따른 공기극과 연료극에 투입되는 혼합 가스의 유량이다.
4. 결 론
본 연구에서는 CFD를 이용하여 직접내부개질형 용융탄산염 연료전지(DIR-MCFC)의 전기화학 반응, 개질 반응, 기체 유동 그리고 열전달 모델을 모사하였다. 가로, 세로 10 cm의 단위 전지 구조에서 S/C ratio, 작동 온도, 가스 이용률에 따른 해석을 진행하고 비교 분석하였다.
1) 전기화학 반응을 고려하지 않았을 경우, S/C ratio가 2, 3, 4일 때 연료극에서 수소의 몰 분율이 0.44, 0.41, 0.38로 S/C ratio가 감소함에 따라 더 많은 수소를 생산하였다.
2) 전기화학 반응을 고려하였을 경우, S/C ratio가 2, 3, 4일 때 셀 전압은 0.765 V, 0.762 V, 0.759 V로 유사한 성능이 도출되었다.
3) 작동 온도가 580℃, 620℃, 650℃일 때 작동 온도가 높아짐에 따라 연료전지의 성능이 증가하였다. 작동 온도 580℃ 대비 620℃에서는 10.75%, 작동 온도 620℃ 대비 650℃에서는 4.85%로 연료전지의 성능이 증가하였다.
4) 가스 이용률이 낮아짐에 따라 연료전지의 성능이 증가하였다. 가스 이용률 80% 대비 60%에서는 5.71%, 가스 이용률 60% 대비 40%에서는 2.97%로 연료전지의 성능이 증가하였다.
Acknowledgments
본 연구는 2021년도 산업통상자원부의 재원으로 한국에너지기술평가원(KETEP)의 지원을 받아 수행한 연구과제(No.20213030040080)입니다.
References
- C. G. Lee, K. S. Ann, S. Y. Park, H. K. Seo, and H. C. Lim, “Temperature characteristics of the molten carbonate fuel cell stack”, Trans Korean Hydrogen New Energy Soc, Vol. 15, No. 1, 2004, pp. 54-61. Retrieved from https://koreascience.kr/article/JAKO200430360539720.pdf, .
-
J. Cho, H. S. Kim, K. Min, J. H. Park, I. G. Chang, and T. W. Lee, “Numerical analysis of the gas flow rate uniformity in the molten carbonate fuel cell (MCFC) under various conditions”, J. Mech. Sci. Technol., Vol. 26, No. 6, pp. 1971-1978, 2012.
[https://doi.org/10.1007/s12206-012-0407-6]

-
S. Kim, “Performance analysis of PEMFC using computational flow dynamics (CFD)”, Journal of Digital Convergence, Vol. 11, No. 8, pp. 199-204, 2013.
[https://doi.org/10.14400/JDPM.2013.11.8.199]

-
D. W. Kim, H. Y. Kim, J. H. Choi, and C. W. Lee, “Study on the effects of the flow characteristics and size on the peformance of molten carbonate fuel cells using CFD”, Trans Korean Hydrogen New Energy Soc, Vol. 30, No. 2, 2019, pp. 147-154.
[https://doi.org/10.7316/KHNES.2019.30.2.147]

-
Y. J. Kim and M. C. Lee, “Comparison of thermal performances of external and internal reforming molten carbonate fuel cells using numerical analyses”, Int. J. Hydrogen Energy, Vol. 42, No. 5, pp. 3510-3520, 2017.
[https://doi.org/10.1016/j.ijhydene.2016.10.165]

-
J. Brouwer, F. Jabbari, E. M. Leal, and T. Orr, “Analysis of a molten carbonate fuel cell: numerical modeling and experimental validation”, Journal of Power Source, Vol. 158, No. 1, pp. 213-224, 2006.
[https://doi.org/10.1016/j.jpowsour.2005.07.093]

-
J. Xu and G. F. Froment, “Methane steam reforming, methanation and water-gas shift: I. Intrinsic kinetics”, AIChE J., Vol. 35, No. 1, 1989, pp. 88-96.
[https://doi.org/10.1002/aic.690350109]

-
C. W. Lee, J. H. Yu, H. W. Kin, and B. H. Ryu, “Effect of the size of molten carbonate fuel cells on the temperature distribution”, Trans. Tech. Publications, Vol. 773, No. 1, pp. 118-122, 2018.
[https://doi.org/10.4028/www.scientific.net/KEM.773.118]

- H. S. Kim, “An improved 3D heat and fluid analysis for the MCFC stack with internal manifolds”, Master Thesis, KAIST, 2010, pp. 12. Retrieved from https://library.kaist.ac.kr/search/detail/view.do?bibCtrlNo=255281&flag=dissertation, .