나노파우더형 Co/Al2O3 촉매를 활용한 NaBH4 가수분해반응 특성 연구
2022 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
Co/Al2O3 nanopowder was used as a catalyst to investigate the effect of catalyst support, reduction temperature, sodium borohydride (NaBH4) concentration, sodium hydroxide (NaOH) concentration, and reaction temperature on the characteristics of NaBH4 hydrolysis. The Co/Al2O3 nanopowder showed a high catalytic activity among various catalysts. Catalyst reduction at 250℃ exhibited a relatively good activity. The activity decreased with an increase in the NaBH4 concentration. Conversely, the activity increased and then decreased with an increase in the NaOH concentration. Additionally, the activity increased with an increase in the reaction temperature. The value of apparent activation energy was 40.81 kJ/mol, which was lower than the other Co-based catalysts. Thus, Co/Al2O3 nanopowder catalyst can be widely used for NaBH4 hydrolysis owing to its superior catalytic activity.
Keywords:
Sodium borohydride, Catalyst, Catalyst support, Reduction, Fuel composition, Apparent activation energy키워드:
수소화붕소나트륨, 촉매, 촉매지지체, 환원, 연료 조성, 겉보기 활성화 에너지1. 서 론
4차 산업혁명 기술의 집약체인 무인 이동체는 1차 산업, 운송, 미래 국방, 국토 및 인프라 관리, 촬영 및 오락과 같은 다양한 산업분야에 활용된다. 대한민국, 미국, 영국, 중국 등의 주요 선진국은 무인 이동체 산업을 미래 성장동력 산업으로 선정하고, 시장 선점을 위해 기술개발로드맵을 수립하며 관련 정책을 적극적으로 추진하고 있다1). 무인 이동체는 센서를 활용한 탐지 및 인식, 자율지능과 같이 고에너지를 소모하는 기술을 활용하여 임무를 수행한다. 따라서 원활한 에너지 공급을 위해 높은 에너지밀도를 갖는 동력원의 필요성이 점차 증대되고 있다.
무인 이동체에 활용되는 동력원으로는 내연기관, 태양전지, 배터리, 연료전지가 있다. 내연기관은 환경을 오염시키고, 태양전지와 배터리는 환경변화에 따라 성능이 불안정하다. 이에 반해, 연료전지는 고에너지밀도, 친환경성, 저소음과 같은 장점을 지녀 무인 이동체를 위한 차세대 동력원으로 주목받고 있다.
다양한 종류의 연료전지 중에서 고분자 전해질 연료전지(polymer electrolyte membrane fuel cell, PEMFC)는 시동특성이 우수하고, 시스템이 단순하기 때문에 무인 이동체에 적합하다. PEMFC는 순수한 수소와 산소를 연료로 사용하여 전기에너지를 생산한다. 따라서 많은 양의 순수한 수소를 안전하게 저장하는 방법이 필요하다.
대표적인 수소 저장법에는 액화수소, 기체수소, 금속 수소화물, 화학 수소화물이 있다. 액화수소는 수소를 -253℃로 냉각하기 위한 복잡한 냉각 시스템이 필요하며 충전 시설이 부족하다. 기체수소 역시 복잡한 압축시스템, 부족한 충전 시설과 같은 단점을 지니고 있다. 금속 수소화물은 질량적인 측면에서의 단점 때문에 활용이 제한된다. 하지만, 화학 수소화물은 비교적 가볍고 재충전이 용이한 장점을 보유하고 있기에 무인 이동체를 위한 수소 저장법으로 각광받고 있다.
화학 수소화물 중 하나인 수소화붕소나트륨(sodium borohydride, NaBH4)은 10.6 wt%의 수소 저장용량, 비교적 저렴한 가격, 생성물인 메타붕산나트륨(sodium metaborate, NaBO2)의 재활용과 같은 장점을 지니고 있다.
| (1) |
1 mol의 NaBH4는 식 (1)과 같이 2 mol의 물과 반응하여 4 mol의 수소와 1 mol의 NaBO2를 발생시킨다. 이 때, 가수분해반응의 생성물인 NaBO2는 수용액 상태로 존재하므로 수소발생기 제작 시 별도의 분리기를 통해 분리하면 연료전지에 순수한 수소를 공급할 수 있다. NaBH4의 자발적인 가수분해반응은 수소의 낭비로 이어지고, 이는 연료전지 시스템의 에너지밀도를 감소시킨다. NaBH4의 자발적인 가수분해반응을 억제하기 위해서는 수산화나트륨(sodium hydroxide, NaOH), 수산화칼륨(potassium hydroxide, KOH) 등을 사용하여 알칼리 NaBH4 수용액의 형태로 저장해야 한다. 수소가 필요한 경우에는 알칼리 NaBH4 수용액을 촉매와 반응시켜 수소를 발생시킬 수 있다. Ru2,3), Pt4-6), Rh7) 등의 귀금속 기반 촉매는 성능이 우수하지만, 높은 가격으로 인해 활용이 제한된다. 이를 개선하기 위해 세계 각국의 연구진은 가격 대비 준수한 성능을 갖는 비귀금속 Co 기반 촉매에 대한 연구를 활발히 진행하고 있다8-16).
촉매의 내구성을 향상시키고 재사용하기 위해 이산화티타늄2,13), 니켈폼8,9), 산화알루미늄12), 실리카14)와 같은 다양한 종류의 촉매지지체가 활용되고 있다. 특히 나노파우더 형태의 촉매지지체는 큰 비표면적으로 인해 활성 금속의 균일한 분산이 가능하여 활성이 우수하다는 장점을 지닌다6,13). 하지만, 다중벽 탄소나노튜브(multiwalled carbon nanotubes, MWCNTs)6)와 수소 티탄산염 나노튜브(hydrogen titanate nanotubes, HTNTs)13), 그리고 나노파우더형 산화알루미늄(aluminum oxide, Al2O3)같이 비표면적이 넓고 비교적 가벼운 나노파우더 형태의 촉매지지체를 활용한 NaBH4 가수분해반응 특성 연구는 부족한 실정이다.
본 연구에서는 나노파우더형 Co/Al2O3 촉매를 활용하여 NaBH4 가수분해반응 특성을 연구하였다. 먼저, 다양한 촉매지지체로 제작한 촉매를 분석하고 활성을 비교하여 나노파우더형 Co/Al2O3 촉매의 활용 가능성을 검증하였다. 또한, 다양한 온도에서 환원된 나노파우더형 Co/Al2O3 촉매의 활성을 비교하여 NaBH4 가수분해반응에 적합한 촉매 환원온도를 선정하였다. 선정된 조건에서 제작한 촉매를 활용하여 NaBH4 농도, NaOH 농도, 반응온도가 NaBH4 가수분해반응 특성에 미치는 영향을 확인하였다.
2. 실 험
2.1 시약 및 기구
본 연구를 위해 나노파우더형 Al2O3 (Sigam-Aldrich, St. Louis, MO, USA), 펠릿형 Al2O3 (Alfa Aesar, Ward Hill, MA, USA), 염화코발트(CoCl2·6H2O, Samchun Chemical, Seoul, Korea), 증류수(H2O, Samchun Chemical), MWCNTs (US Research Nanomaterials, Houston, TX, USA), NaBH4 (Samchun Chemical), 시트르산 나트륨(HOC[COONa] [CH2COONa]2·2H2O, Sigma-Aldrich), 에탄올(C2H5OH, Samchun Chemical), 실리카겔(SiO2, Samchun Chemical), NaOH(Samchun Chemical)를 사용하였다.
실험기구는 가열교반기(RCT Basic, Ika, Königswinter, Germany), 진공 건조기(C-DVD1, Changshin Science, Seoul, Korea), 초음파 세척기(US-2R, As One, Osaka, Japan), 시린지 펌프(LSP02-2A, Longer Precision Pump, Baoding, China), 전기로(Inwha HNC, Namyangju, Korea), 항온조(DRC-08, CPT, Ansan, Korea), 부피 유량계(FMA-1618A, Omega, Norwalk, CA, USA), 데이터 수집장치(GL240, Graphtec, Yokohama, Japan)를 사용하였다.
2.2 촉매 제작
나노파우더형 Co/Al2O3 촉매와 펠릿형 Co/Al2O3 촉매는 증발건조법으로 제작하였고, 촉매의 제작 과정은 모두 동일하였다. 10 wt%의 Co 촉매를 제작하기 위해 0.525 g의 코발트 전구체를 20 g의 증류수에 용해시켰다. 제작한 촉매용액에 Al2O3 1.13 g을 첨가하였다. 촉매 용액을 100℃에서 3시간 동안 150 rpm으로 교반하며 Co/Al2O3 촉매를 제작하였다. 제작한 촉매는 사용하기 전까지 진공 건조기에 40℃로 건조하며 보관하였다.
MWCNTs의 비활성으로 인해 MWCNTs 표면에 금속의 분산과 담지가 원활하게 이루어지지 않는다. 따라서 Co/MWCNTs 촉매는 증발건조법 대신 NaBH4 환원법을 적용하여 제작하였다. 먼저, 10 wt%의 Co 촉매를 제작하기 위해 0.525 g의 코발트 전구체를 20 g의 증류수에 용해시켰다. Co와 시트르산 나트륨의 몰비가 1:1이 되도록 0.65 g의 시트르산 나트륨을 촉매용액에 첨가하여 Co를 분산시켰고, 제작한 촉매용액에 1.13 g의 MWCNTs를 첨가하였다. 이후, 초음파 세척기로 MWCNTs를 30분 동안 분산하였다.
분산된 MWCNTs에 Co를 환원시키기 위해 Co와 NaBH4의 몰비가 1(Co):10(NaBH4)이 되도록 0.83 g의 NaBH4를 20 g의 증류수에 용해시켜 환원용액을 제작하였다. 제작한 NaBH4 수용액은 시린지 펌프를 사용하여 촉매용액에 1시간 동안 주입하였고, Co를 충분히 환원시키기 위해 용액을 24시간 동안 150 rpm으로 교반하였다. 제작한 Co/MWCNTs 촉매는 여과지로 여과하고 증류수와 에탄올을 활용하여 세척한 후, 사용하기 전까지 진공 건조기에 40℃로 건조하며 보관하였다.
촉매 환원이 촉매 활성에 미치는 영향을 확인하기 위해 혼합기체(10% H2+90% N2)를 사용하여 다양한 온도조건에서 나노파우더형 Co/Al2O3 촉매를 환원하였다. 전기로를 통해 7.3℃/min의 온도증가율로 목표온도(250-450℃)까지 증가시켰고, 목표온도를 3시간 동안 유지한 후 서냉하였다. 환원과정동안 혼합기체를 200 mL/min의 유량으로 계속 공급하여 환원 분위기를 조성하였다.
2.3 촉매 분석
촉매의 특성을 파악하기 위해 분석을 실시하였다. 촉매의 Co 담지량을 파악하기 위해 유도결합플라즈마 분광분석기(720, Agilent, Santa Clara, CA, USA)를 활용하였다. 또한, 촉매의 비표면적을 측정하기 위해 비표면적 분석기(Belsorp Max Ⅱ, Microtrac MRB, Haan, Germany)를 활용하였다.
2.4 수소발생실험
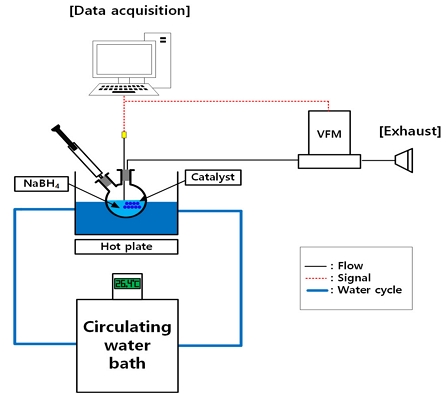
가수분해반응 특성을 평가하기 위해 Fig. 1과 같이 반응기, 항온조, 부피유량계, 데이터 수집장치, 컴퓨터로 실험 장치를 구성하였다. 반응온도의 영향 연구에서는 온도조절을 위한 가열교반기와 실험과정에서 발생한 수분을 제거하기 위한 실리카겔을 추가적으로 사용하였다.
수소발생실험 절차는 다음과 같다. 먼저 촉매를 반응기에 투입하고, 수소유량을 정확하게 측정하기 위해 밀폐된 상태를 유지하며 수소를 공급하여 실험장치 내부의 공기를 제거하였다. 그리고 시린지를 이용해 NaBH4 수용액을 반응기에 공급하였다. 식 (1)의 반응을 통해 생성된 수소유량은 부피유량계를 이용하여 측정하였고, 반응온도는 K-type 열전대를 활용하여 계측하였다. 측정한 수소유량과 반응온도는 데이터 수집장치를 이용해 컴퓨터에 저장하였다.
실험마다 50 mg의 촉매와 다양한 조성으로 제작한 5 g의 NaBH4 수용액을 사용하였다. NaBH4 농도는 2.3-30 wt%의 범위에서 조절하였고, NaOH 농도는 1-15 wt%의 범위에서 조절하였다. 또한, 반응온도는 25-55℃의 범위에서 조절하며 실험을 진행하였다. 반응온도는 실험 결과에 큰 영향을 주는 요인이기 때문에 항온조를 이용해 각 실험의 반응온도를 일정하게 유지하였다.
3. 결과 및 고찰
3.1 촉매 분석
Table 1은 다양한 촉매의 비표면적을 분석한 결과이다. 펠릿형 Co/Al2O3 촉매와 나노파우더형 Co/Al2O3 촉매의 비표면적은 각각 158.8 m2/g, 128.3 m2/g이었고, Co/MWCNTs 촉매의 비표면적은 85.6 m2/g이었다. 다공성 물질인 Al2O3를 활용하여 제작한 촉매의 비표면적이 MWCNTs를 활용하여 제작한 촉매의 비표면적보다 우수하였다.
각 촉매의 Co 담지량은 Table 2에 정리하였다. 모든 촉매의 목표 담지량은 10 wt%로 설정하였다. 나노파우더형 Co/Al2O3 촉매의 담지량이 8 wt%로 가장 우수하였다. 펠릿형 Co/Al2O3 촉매의 담지량은 4.1 wt%였으며, Co/MWCNTs 촉매의 담지량은 1.4 wt%로 가장 낮았다. 지지체 표면의 활성 차이와 비귀금속인 Co 환원의 어려움으로 인해 담지가 원활하게 이루어지지 않아 목표 담지량보다 적게 담지된 것으로 사료된다.
3.2 촉매지지체의 영향
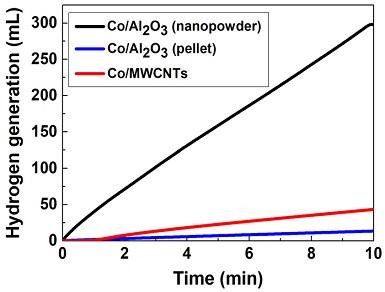
촉매지지체가 NaBH4 가수분해반응에 미치는 영 향을 확인하기 위해 나노파우더형 Co/Al2O3, 펠릿형 Co/Al2O3, Co/MWCNTs 촉매를 활용하여 수소발생실험을 진행하였다. 2.3 wt% NaBH4+5 wt% NaOH+92.7 wt% H2O의 조성으로 제작한 NaBH4 수용액을 사용하였고, 반응온도는 25.0±1.9℃의 범위에서 유지하였다.
Fig. 2는 다양한 촉매지지체를 활용하여 제작한 촉매의 수소발생실험 결과이다. 각 촉매에 담지된 Co의 양이 다르기 때문에 정량적인 비교가 불가능하다. 따라서 Table 2와 식 (2)를 이용해 정규화한 담지된 1 g의 Co당 수소발생률(L/min·gCo)을 Table 3에 제시하였다.
| (2) |
이때, 평균 수소발생률은 각 그래프에 제시된 10분간 수소발생률의 평균값으로 정의하였고, 반응이 10분 이전에 종료된 경우에는 종료 시점까지의 평균값으로 정의하였다.
나노파우더형 Co/Al2O3 촉매의 수소발생률은 7.45 L/min·gCo으로 또 다른 나노파우더 형태의 촉매인 Co/MWCNTs 촉매의 수소발생률인 6.05 L/min·gCo에 비해 23% (1.40 L/min·gCo)만큼 더 우수하였다. 펠릿형 Co/Al2O3 촉매의 비표면적(158.8 m2/g)이 나노파우더형 Co/Al2O3 촉매의 비표면적(128.3 m2/g)보다 24% (30.5 m2/g)만큼 더 우수하였음에도 불구하고, 나노파우더형 Co/Al2O3 촉매의 성능(7.45 L/min·gCo)이 펠릿형 Co/Al2O3 촉매의 성능(0.66 L/min·gCo)에 비해 1,029% (6.79 L/min·gCo)만큼 더 우수하였다. 촉매의 비표면적은 촉매 활성에 영향을 미치며, 일반적으로 촉매의 비표면적이 클수록 촉매반응에 유리하다. 그러나 촉매의 비표면적 외에도 다양한 요인(촉매의 기공 분포, 촉매 표면의 화학 조성 등)이 촉매 활성에 더 지배적인 영향을 미친 것으로 사료된다15).
나노파우더형 Co/Al2O3 촉매는 Co 담지량 뿐 아니라 담지된 1 g의 Co당 수소발생률(L/min·gCo)이 타 촉매에 비해 우수하였다. 따라서 다양한 촉매지지체 중에서 나노파우더형 Al2O3가 NaBH4 가수분해반응에 비교적 적합하다고 판단된다.
3.3 촉매 환원온도의 영향
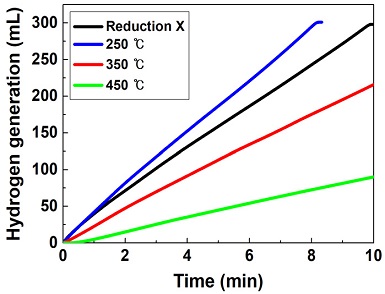
Co 촉매에서 Co는 상온에서 일부 산화된 상태로 존재하며, 산화된 Co는 NaBH4 가수분해반응에서 촉매 활성을 저하시킨다고 알려져 있다16). 고온에서 수소기체를 공급하면 산화된 금속을 환원할 수 있다. 따라서 촉매 환원온도가 NaBH4 가수분해반응에 미치는 영향을 확인하기 위해 혼합기체를 활용하여 나노파우더형 Co/Al2O3 촉매를 환원하였다. 이 때, 촉매 환원온도는 250-450℃로 조절하였다. 다양한 온도에서 환원한 나노파우더형 Co/Al2O3 촉매로 수소발생실험을 진행하였다. 2.3 wt% NaBH4+5 wt% NaOH+92.7 wt% H2O의 조성으로 제작한 NaBH4 수용액을 사용하였고, 반응온도는 25.0±1.9℃의 범위에서 유지하였다.
다양한 온도에서 환원한 나노파우더형 Co/Al2O3 촉매의 수소발생실험 결과를 Fig. 3과 Table 4에 제시하였다. 250℃에서 환원한 촉매의 활성(9.03 L/min·gCo)이 가장 우수하였고, 환원온도가 증가할수록 촉매의 활성(350℃: 5.39 L/min·gCo, 450℃: 2.25 L/min·gCo)이 감소하였다. 비록 상이한 반응이기 때문에 직접적인 비교는 어렵지만, 250℃에서 열처리되었을 때는 우수한 활성을 보인 Pd/Al2O3 촉매 역시 500℃에서의 열처리로 인해 금속 면적이 4.8 m2/g에서 0.8 m2/g으로 감소하고, 소결로 인해 입자 크기가 1-3 nm에서 7-11 nm로 증가하여 촉매의 성능이 저하되는 경향을 Fertal 등17)이 진행한 연구에서도 확인할 수 있다.
본 연구에서 350℃ 이상의 환원온도는 오히려 촉매의 활성을 저하시켰다. 또한, 환원온도가 높아질수록 전기로 가동시간이 늘어나고, 이에 따라 더 많은 혼합기체를 사용해야 하므로 경제적인 측면에서도 부적합하다. 따라서 본 연구에서는 NaBH4 가수분해를 위한 나노파우더형 Co/Al2O3 촉매에 비교적 적합한 환원온도를 250℃로 선정하였다. 만약 본 연구 결과를 토대로 350℃ 미만의 범위에서 촉매 환원온도의 영향을 더 세밀하게 분석하는 후속연구가 진행된다면, 나노파우더형 Co/Al2O3 촉매에 더 적합한 환원온도를 선정할 수 있을 것이다.
3.4 NaBH4 농도의 영향
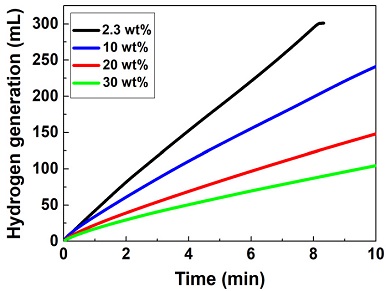
NaBH4 농도가 높을수록 동일 질량의 NaBH4 수용액에 더 많은 양의 수소를 저장할 수 있고, 이는 연료전지 시스템의 에너지밀도와 직결된다. NaBH4 농도의 변화가 NaBH4 가수분해반응에 미치는 영향을 확인하기 위해 x wt% NaBH4+5 wt% NaOH+(95-x) wt% H2O의 조성으로 제작한 NaBH4 수용액을 사용하여 수소발생실험을 진행하였다. NaBH4 농도는 2.3-30 wt%의 범위에서 조절하였고, 250℃에서 환원한 나노파우더형 Co/Al2O3 촉매를 활용하였다. 또한, 반응온도는 25.0±1.9℃의 범위에서 유지하였다.
Fig. 4와 Table 5에 다양한 NaBH4 농도에서의 수소발생실험 결과를 정리하였다. 2.3 wt%의 NaBH4 농도에서 수소발생률이 9.03 L/min·gCo으로 가장 우수하였고, NaBH4 농도가 증가할수록 수소발생률이 감소하였다. NaBH4 농도가 30 wt%로 증가하였을 때의 수소발생률은 2.61 L/min·gCo으로 2.3 wt%에서의 수소발생률에 비해 6.42 L/min·gCo만큼 감소하였다. Akti14)의 연구에서도 NaBH4 농도가 증가할수록 Co 기반 촉매의 활성이 점차 저하되는 경향이 나타났다.
NaBH4의 농도를 증가시키면 연료전지 시스템의 에너지밀도를 증가시킬 수 있지만, 이에 따라 용액의 점성과 반응 생성물인 NaBO2의 석출이 증가하여 촉매의 활성을 저하시킨다18,19). 흐름형 수소발생실험을 통해 NaBH4 농도의 변화가 연료전지 시스템의 에너지밀도에 미치는 영향을 규명한다면, 연료전지 시스템에 적합한 NaBH4 농도를 선정할 수 있을 것으로 예상된다.
3.5 NaOH 농도의 영향
식 (3)은 NaBH4 용액의 pH와 자발가수분해반응의 관계를 보여준다20). NaOH를 첨가하여 NaBH4 수용액의 pH를 증가시키면, NaBH4의 자발가수분해반응을 억제하여 수소의 저장기간을 늘릴 수 있다. 예를 들어, pH가 12인 NaBH4 수용액을 25℃에서 보관하였을 때, 저장된 수소의 반감기는 약 102시간이다. 따라서 10 wt% NaBH4+x wt% NaOH+(90-x) wt% H2O의 조성으로 제작한 NaBH4 수용액을 활용하여 NaOH 농도가 NaBH4 가수분해반응에 미치는 영향을 확인하였다. NaOH 농도는 1-15 wt%의 범위에서 조절하였고, 250℃에서 환원한 나노파우더형 Co/Al2O3 촉매를 사용하였다. 반응온도는 25.0±1.9℃의 범위에서 유지하였다.
| (3) |
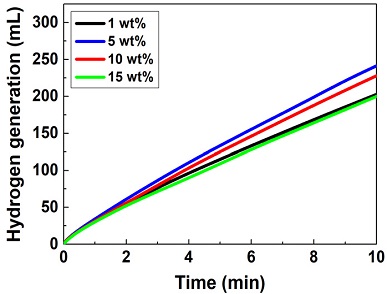
Fig. 5와 Table 6은 NaOH 농도 변화에 따른 수소발생실험 결과이다. NaOH 농도가 1 wt%에서 5 wt%로 증가하였을 때, 수소발생률은 5.07 L/min·gCo에서 6.03 L/min·gCo으로 증가하였다. 반면, NaOH 농도가 5 wt%에서 10, 15 wt%로 증가하였을 때, 수소발생률은 각각 5.69, 5.00 L/min·gCo으로 감소하였다. Wang 등12)의 연구에서도 NaOH 농도가 증가할수록 Co 기반 촉매의 수소발생률이 증가하다가 특정 농도부터 감소하는 경향을 확인할 수 있다.
낮은 NaOH 농도에서 NaOH의 OH-이온은 Co와 긍정적으로 상호작용하여 촉매의 활성을 증가시킨다. 하지만, NaOH 농도가 특정 수치 이상으로 증가하면, 용액 점성의 증가 및 제한된 용해도에서 비롯된 NaBO2의 석출로 인해 결국 촉매의 활성이 저하된다12). NaBH4 수용액의 조성은 NaBH4와 NaOH의 농도에 의해 결정된다. 따라서 3.4절에서 언급한 바와 같이, 연료전지 시스템에 적합한 NaBH4와 NaOH 농도를 선정하기 위해서는 NaBH4 수용액 조성의 변화가 연료전지 시스템의 에너지밀도에 미치는 영향을 고려하는 후속 연구가 진행되어야 한다.
3.6 반응온도의 영향
다양한 반응온도에서의 수소발생실험을 통해 반응온도가 NaBH4 가수분해반응 특성에 미치는 영향을 확인하였다. 10 wt% NaBH4+5 wt% NaOH+85 wt% H2O의 조성으로 제작한 NaBH4 수용액과 250℃에서 환원한 나노파우더형 Co/Al2O3 촉매를 사용하였고, 반응온도는 25.0±1.9℃, 34.2±1.2℃, 44.7±1.1℃, 54.8±3.1℃의 범위에서 유지하였다.
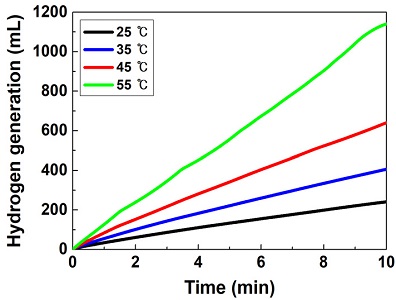
반응온도의 변화에 따른 수소발생실험 결과를 Fig. 6과 Table 7에 정리하였다. 반응온도가 증가할수록 수소발생률 또한 급격하게 증가하는 경향을 보였다. 55℃에서의 수소발생률(28.50 L/min·gCo)이 25℃에서의 수소발생률(6.03 L/min·gCo)에 비해 373% (22.47 L/min·gCo)만큼 더 우수하였다.
| (4) |
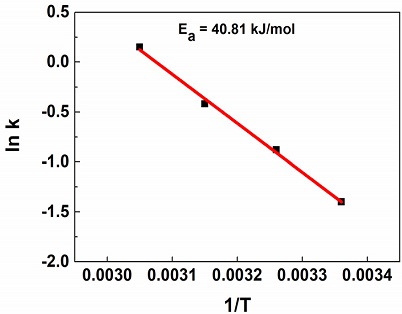
겉보기 활성화에너지는 반응온도에 따른 반응속도 변화를 반영하는 촉매의 고유 특성이다. 식 (4)는 자연대수 형태의 아레니우스 식이다. k는 반응속도 상수(mol/min·gCo)이고, A는 지수 앞자리 인자이다. 또한, Ea는 겉보기 활성화에너지이고, R은 기체상수이며, T는 반응온도(K)이다. 식 (4)와 반응온도의 영향 연구 결과를 활용하여 나노파우더형 Co/Al2O3 촉매의 아레니우스 그래프를 Fig. 7과 같이 도출하였고, 이를 통해 계산한 겉보기 활성화에너지는 40.81 kJ/mol이었다.
Table 8에 NaBH4 가수분해용 촉매의 겉보기 활성화에너지를 정리하였다. 나노파우더형 Co/Al2O3 촉매의 겉보기 활성화에너지는 Pt/C 촉매보다는 높았지만, Ru/G 촉매보다는 낮았다. 또한, Co-P/Ni foam, Co-P/Cu sheet 등의 다양한 Co 기반 촉매보다 낮았다. 따라서 비교적 낮은 겉보기 활성화에너지로 인해 나노파우더형 Co/Al2O3 촉매는 반응온도에 따른 반응속도의 변화가 적은 것으로 사료된다.
4. 결 론
본 연구에서는 나노파우더형 Co/Al2O3 촉매를 활용하여 NaBH4 가수분해반응 특성을 확인하였다. 먼저, 촉매지지체의 영향을 연구하였다. 촉매 분석과 수소발생실험을 진행하여 Co 담지량과 성능 측면에서 우수했던 나노파우더형 Al2O3를 NaBH4 가수분해반응에 적합한 촉매지지체로 선정하였다. 또한, 촉매 환원온도의 영향을 연구하였다. 250℃의 환원온도는 나노파우더형 Co/Al2O3 촉매의 활성을 증가시켰지만, 350℃ 이상의 환원온도는 오히려 촉매의 활성을 저하시켰다. 따라서 비교적 적합한 촉매 환원온도로 250℃를 선정하였다. 250℃에서 환원한 나노파우더형 Co/Al2O3 촉매를 활용하여 NaBH4 농도, NaOH 농도, 반응온도에 대한 영향을 확인하였다. NaBH4 농도가 증가할수록 촉매의 활성은 감소하였다. NaOH 농도가 1 wt%에서 5 wt%로 증가하면 촉매의 활성은 증가하였지만, NaOH 농도가 5 wt%에서 15 wt%로 증가하면 촉매의 활성은 다시 감소하였다. 반응온도가 증가할수록 촉매반응이 활발해지는 경향을 확인하였다. 아레니우스 식을 통해 계산한 나노파우더형 Co/Al2O3 촉매의 겉보기 활성화에너지는 40.81 kJ/mol로 타 연구진의 Co 기반 촉매에 비해 낮은 편이었다. 본 연구에서 활용된 나노파우더형 Co/Al2O3 촉매는 비교적 우수한 활성을 지녀 NaBH4 가수분해반응에 널리 활용될 수 있을 것으로 판단된다.
Acknowledgments
이 논문은 2021년도 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원(No. 2021R1F1A1046889)과 2021년도 정부(산업통상자원부)의 재원으로 한국에너지기술평가원의 지원(No. 20214000000480, 청정가스복합화력발전 핵심요소기술 및 국산화 전문인재양성)을 받아 수행된 연구입니다.
References
- Ministry of Science and ICT, “Unmanned vehicle technology Roadmap”, Ministry of Science and ICT, 2017. Retrieved from https://doc.msit.go.kr/SynapDocViewServer/viewer/doc.html?key=baa776faff8a4a50b4280bf59c53407a&convType=img&convLocale=ko_KR&contextPath=/SynapDocViewServer, .
-
J. Zhang, F. Lin, L. Yang, and H. Dong, “Highly dispersed Ru/Co catalyst with enhanced activity for catalyzing NaBH4 hydrolysis in alkaline solutions”, Chinese Chem. Lett., Vol. 31, No. 9, 2020, pp. 2512-2515.
[https://doi.org/10.1016/j.cclet.2020.03.072]

-
Y. Liang, H. B. Dai, L. P. Ma, P. Wang, and H. M. Cheng, “Hydrogen generation from sodium borohydride solution using a ruthenium supported on graphite catalyst”, Int. J. Hydrogen Energy, Vol. 35, No. 7, 2010, pp. 3023-3028.
[https://doi.org/10.1016/j.ijhydene.2009.07.008]

-
H. Zhang, L. Zhang, I. A. Rodríguez-Pérez, W. Miao, K. Chen, W. Wang, Y. Li, and S. Han, “Carbon nanospheres supported bimetallic Pt-Co as an efficient catalyst for NaBH4 hydrolysis”, Appl. Surf. Sci., Vol. 540, No. 1, 2021, pp. 148296.
[https://doi.org/10.1016/j.apsusc.2020.148296]

-
Y. Kojima, K. I. Suzuki, K. Fukumoto, M. Sasaki, T. Yamamoto, Y. Kawai, and H. Hayashi, “Hydrogen generation using sodium borohydride solution and metal catalyst coated on metal oxide”, Int. J. Hydrogen Energy, Vol. 27, No. 10, 2002, pp. 1029-1034.
[https://doi.org/10.1016/S0360-3199(02)00014-9]

-
A. Uzundurukan and Y. Devrim, “Hydrogen generation from sodium borohydride hydrolysis by multi-walled carbon nanotube supported platinum catalyst: a kinetic study”, Int. J. Hydrogen Energy, Vol. 44, No. 33, 2019, pp. 17586-17594.
[https://doi.org/10.1016/j.ijhydene.2019.04.188]

-
V. G. Minkina, S. I. Shabunya, V. I. Kalinin, and A. Smirnova, “Hydrogen generation from sodium borohydride solutions for stationary applications”, Int. J. Hydrogen Energy, Vol. 41, No. 22, 2016, pp. 9227-9233.
[https://doi.org/10.1016/j.ijhydene.2016.03.063]

-
T. H. Oh and S. Kwon, “Effect of manufacturing conditions on properties of electroless deposited Co–P/Ni foam catalyst for hydrolysis of sodium borohydride solution”, Int. J. Hydrogen Energy, Vol. 37, No. 21, 2012, pp. 15925-15937.
[https://doi.org/10.1016/j.ijhydene.2012.08.053]

- D. Park and T. G. Kim, “Hydrogen generation from NaBH4 hydrolysis on Co-Ni-P-B/Ni foam catalyst”, Trans Korean Hydrogen New Energy Soc, Vol. 21, No. 5, 2010, pp. 383-389. Retrieved from https://www.kci.go.kr/kciportal/ci/sereArticleSearch/ciSereArtiView.kci?sereArticleSearchBean.artiId=ART001492984, .
-
D. H. Kim, S. Jo, J. H. Kwon, S. Lee, and K. S. Eom, “Effect of iron content on the hydrogen production kinetics of electroless-deposited Co-Ni-Fe-P alloy catalysts from the hydrolysis of sodium borohydride, and a study of its feasibility in a new hydrolysis using magnesium and calcium borohydrides”, Int. J. Hydrogen Energy, Vol. 44, No. 29, 2019, pp. 15228-15238.
[https://doi.org/10.1016/j.ijhydene.2019.04.169]

-
K. S. Eom, K. Cho, and H. Kwon, “Effects of electroless deposition conditions on microstructures of cobalt–phosphorous catalysts and their hydrogen generation properties in alkaline sodium borohydride solution”, J. Power Sources, Vol. 180, No. 1, 2008, pp. 484-490.
[https://doi.org/10.1016/j.jpowsour.2008.01.095]

-
L. Wang, Z. Li, X. Liu, P. Zhang, and G. Xie, “Hydrogen generation from alkaline NaBH4 solution using electroless-deposited Co–W–P supported on γ-Al2O3”, Int. J. Hydrogen Energy, Vol. 40, No. 25, 2015, pp. 7965-7973.
[https://doi.org/10.1016/j.ijhydene.2015.04.110]

-
R. Li, F. Zhang, J. Zhang, and H. Dong, “Catalytic hydrolysis of NaBH4 over titanate nanotube supported Co for hydrogen production”, Int. J. Hydrogen Energy, Vol. 47, No. 8, 2022, pp. 5260-5268.
[https://doi.org/10.1016/j.ijhydene.2021.11.143]

-
F. Akti, “Hydrogen generation from hydrolysis of sodium borohydride by silica xerogel supported cobalt catalysts: positive roles of amine modification and calcination treatment”, Fuel, Vol. 303, 2021, pp. 121326.
[https://doi.org/10.1016/j.fuel.2021.121326]

-
C. H. Liu, B. H. Chen, C. L. Hsueh, J. R. Ku, F. Tsau, and K. J. Hwang, “Preparation of magnetic cobalt-based catalyst for hydrogen generation from alkaline NaBH4 solution”, Appl. Catal. B: Environ., Vol. 91, No. 1-2, 2009, pp. 368-379.
[https://doi.org/10.1016/j.apcatb.2009.06.003]

-
N. Patel, R. Fernandes, and A. Miotello, “Hydrogen generation by hydrolysis of NaBH4 with efficient Co-P-B catalyst: a kinetic study”, J. Power Sources, Vol. 188, No. 2, 2009, pp. 411-420.
[https://doi.org/10.1016/j.jpowsour.2008.11.121]

-
D. R. Fertal, M. Monai, L. Proaño, M. P. Bukhovko, J. Park, Y. Ding, B. M. Weckhuysen, and A. C. Banerjee, “Calcination temperature effects on Pd/alumina catalysts: Particle size, surface species and activity in methane combustion”, Catal. Today, Vol. 382, 2021, pp. 120-129.
[https://doi.org/10.1016/j.cattod.2021.08.005]

-
Z. P. Li, B. H. Liu, K. Arai, K. Asaba, and S. Suda, “Evaluation of alkaline borohydride solutions as the fuel for fuel cell”, J. Power Sources, Vol. 126, No. 1-2, 2004, pp. 28-33.
[https://doi.org/10.1016/j.jpowsour.2003.08.017]

-
T. H. Oh and S. Kwon, “Effect of Additives for Prevention of NaBO2 Precipitation on Hydrogen Generation Properties of NaBH4 Hydrolysis”, Trans Korean Hydrogen New Energy Soc, Vol. 24, No. 1, pp. 1-11.
[https://doi.org/10.7316/KHNES.2013.24.1.001]

- M. M. Kreevoy and R. W. Jacobson, “The rate of decomposition of NaBH4 in basic aqueous solutions”, Ventron Alembic, Vol. 15, 1979, pp. 2-3.