Pt포일 양극을 이용한 전기화학적 암모니아 수전해 특성 연구
2022 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
In this study, a water electrolysis was studied to investigate the effect of ammonia on current density and H2 gas production. A H type cell with three electrodes was used and KOH solution was used as electrolyte. The conventional platinum foil was used for working electrode, whereas nickel foam was used for counter electrode. CV experiment was performed to see the activity of ammonia oxidation reaction. In addition, CP experiment was done to examine the dependence of Faraday efficiency of hydrogen on current density and NH3 concentration. The CV result shows the 0.5M NH3 concentration required for highest current density and reliable operation. The CP result shows the increased current density leads to higher H2 generation. The higher H2 production and subsequent energy efficiency was observed for 0.5M NH3 using a Pt/13%Rh coil for a cathode as compared to those in water electrolysis.
Keywords:
Water electrolysis, Ammonia, Electrochemical reaction, H2 production, Faraday efficiency, cyclic voltametry(CV)키워드:
수전해, 암모니아, 전기화학, 수소생산, 패러데이 효율, 순환전압전류법1. 서 론
암모니아(NH3)는 낮은 증기압으로 인한 액화의 용이성과 낮은 연소성으로 인한 안정성 때문에 운송시 수소에 비해 많은 장점을 가지고 있다. 이같이 운송된 암모니아를 추후 실제 현장에서 전환시켜, 수소나 탄화수소 연료를 얻을 수 있는 관계로 수소 저장매체로서 인기를 끌고 있다. 이같은 암모니아 전환 기술 중 전기화학적 암모니아 수전해 기술이 특히 관심을 끌고 있다1-3).
기존 수전해를 이용한 수소생산에 비해 저농도 암모니아를 수용액에 첨가할 경우 수소생산 및 전기화학 반응성이 향상되는 것으로 알려져 있다4). 특히 암모니아 산화반응(ammonia oxidation reaction, AOR)의 전위차가 10배 이상 낮은 관계로 에너지 효율이 수전해에 비해 60% 정도 저감된다고 보고되고 있다5,6). 이같은 장점을 가지기 위해서는 다양한 형태와 성분을 가지는 전극촉매의 개발이 필수적이다7,8). 특히 양극에서 일어나는 AOR 반응의 느린 반응속도와 높은 셀 전압으로 인해 질소와 잘 결합하는 Pt와 이의 합금(Pt-Ir, Pt-Ru, Pt-Rh)이 사용되고 있다. 그러나 이같은 고가의 전극을 대체하기 위해 Ni, Cu 등과 관련 산화물 전극에 대한 연구도 진행되고 있다8,9). 본 연구는 이같은 전극촉매 연구를 수행하기 전 선행연구로서 3전극 시스템과 수전해에서 많이 사용하는 Pt포일 양극과 Ni폼 음극을 이용하였다. 이를 통해 최적의 수소생산 및 전류밀도를 얻을 수 있는 최적의 암모니아 및 전해질 농도를 찾고자 노력하였다.
2. 실 험
2.1 전기화학 실험
Fig. 1과 같이 암모니아 수전해가 가능하도록 3전극이 설치된 전기화학 셀을 제작하였다. 전압 또는 전류를 인가하기 위해 potentiostat를 사용하였다. 두 가지 다른 실험기법을 적용하였다. 먼저 AOR 반응의 반응성을 보기 위해 순환전압전류법(cyclic voltametry, CV)을 사용하였고, 수소생산량과 관련된 패러데이 효율을 얻기 위해서 정전류법(chrono potentiometry, CP)을 사용하였다. 작동전극은 Pt포일을, counter 전극은 니켈 폼을 사용하였다. 특히 counter 전극은 기존 수전해에서 많이 사용하는 저렴한 니켈 폼을 사용하였다. 기준전극은 Ag/Cl 전극을 사용하였다. 알칼리 전해질은 KOH를 사용하여 농도를 최대 5 M까지 변화시킬 수 있었다. 암모니아는 최대 2 M까지 첨가하여 이의 영향을 살펴보고자 하였다. 상기 두 가지 전기화학 실험은 대기압과 상온에서 수행하였으나, 암모니아 증발은 미비한 것으로 확인되었다. KOH 첨가 후 온도상승이 나타나서 chiller를 이용하여 온도를 조절하고자 하였다. 또한 pH미터를 반응기 셀 안에 설치하여 전기화학 반응전과 반응 동안의 pH 변화를 측정할 수 있었다.
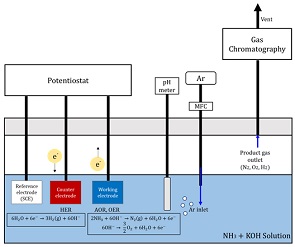
Electrochemical cell with three electrodes connected to Gas Chromatography and potentiostat for measuring product gases and cell potential at 25℃
반응식 (1)은 수소반응(hydrogen evolving reaction, HER)으로서 표준 전위차가 -0.827 V로 알려져 있다. 반응식 (2)는 암모니아 산화반응(ammonia oxidation reaction, AOR)으로서 표준전위차가 -0.77 V이며, 이와 경쟁하는 산소반응(oxygen evolving reaction, OER)은 0.401 V로서 반응식 (3)과 같이 표시된다. 전자를 잃는 두 개의 산화반응은 양극인 Pt포일에서 일어난다.
| (1) |
| (2) |
| (3) |
2.2 가스분석 및 해석
CP실험의 경우 60분 동안 전기화학 반응 진행한 후 2분간 10 cc/min의 아르곤 가스를 주입하여 반응 셀의 잔류가스를 샘플링 백에 밀어 넣도록 하였다. 샘플링 백안의 1 mL 용량의 가스를 gas chromatography (GC)에 넣고 생성가스 분석을 진행하였다. N2, O2가스는 TCD 센서에서, H2 가스는 FID 센서에서 측정할 수 있었다. 그리고 생성가스 패러데이 효율과 에너지 효율은 다음 식을 이용하여 계산하였다.
| (4) |
| (5) |
또한, 상기 CP실험의 경우 다른 영향을 줄일 수 있도록 전류를 고정한 상태에서 전기화학 반응을 진행하였다. 전류는 5, 10, 30, 50 mA까지 변화시켜 가면서 수소 생성량 및 패러데이 효율의 변화를 살펴보았다. 또한 에너지 소비율을 나타내는 에너지 효율의 변화도 관찰하였다. 또한 최적의 암모니아 첨가비율을 결정하기 위해 이에 따른 수소 패러데이 효율 및 셀 전압 변화도 살펴보았다.
3. 실험 결과 및 고찰
3.1 CV 및 I-V 실험 결과
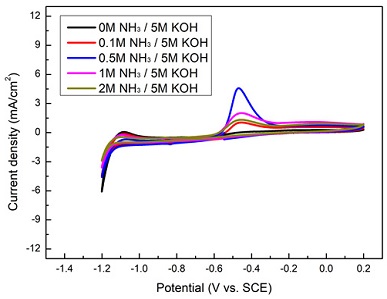
앞서 실험 방법에서 설명하였듯이 AOR 반응의 반응성을 보기 위해 CV를 사용하였다. 이를 통해 전해질(KOH) 및 NH3 변화에 따른 반응성을 확인해 볼 수 있었다. Fig. 2는 전압이 -1.4 V에서 0.2 V까지 시간에 따라 선형적으로 증가하였다가 감소하는 사이클 동안에 전류밀도의 변화를 보여주고 있다. 양의 전류밀도 peak는 AOR 반응이 일어나는 양극에서 일어나는 반응의 반응성 정도를 나타낸다. 음의 전류밀도 peak는 이 경우 나타나지 않은데, AOR 반응만을 보고 있기 때문이다. 전류밀도 peak는 -0.5 V에서 나타나며 암모니아 농도가 0.5 M일 때 최대를 보여주고 1 M, 2 M으로 더 증가하면 오히려 감소하는 것을 볼 수 있다. 이는 전극표면에서 metal산화반응으로 인해 metal oxynitrides (MeOxNy)가 만들어져서 AOR 반응이 억제되기 때문으로 알려져 있다10). Fig. 3은 -0.4V에서 첫 번째 peak가 나타나고 KOH 농도가 0에서 5 M으로 증가할 때 이온전도도가 높아져서 전류밀도가 같이 증가하는 것을 알 수 있다. 이는 KOH 농도 증가로 인해 OH 이온이 전극으로 보다 잘 전달되어 흡착되기 때문으로 보인다6). 그러나 너무 많은 KOH를 첨가할 경우 발열반응으로 인해 온도가 상승하여 운전에 대한 안정성을 위해서는 KOH 농도를 제한할 필요가 있다.
Effect of NH3 concentration in solution on the current density relevant to AOR reactivity in the CV measurement
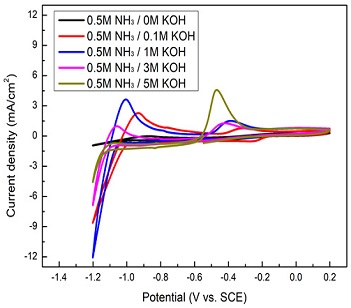
Effect of KOH concentration in solution on the current density relevant to AOR reactivity in the CV measurement at the same amount of NH3 in 0.5 M
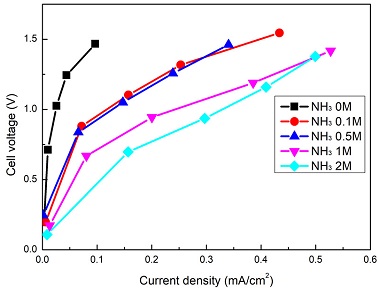
제 전압을 선형적으로 증가시키기보다 각 전압을 0부터 1.4 V까지 0.2 V씩 증가시켜가면서 3분 동안 전류의 변화를 읽었다. 동시에 반대전극의 전압도 읽음으로써 전체 셀에 걸리는 전압을 결정하여 전류와의 관계(I-V) 곡선을 그려 보았다. Fig. 4는 KOH 농도 증가에 따른 전류밀도와 셀전압의 변화를 보여주고 있다. KOH 농도가 증가할수록 같은 전류에서 낮은 셀전압을 가지는 것을 볼 수 있고, 이는 전류를 흘리기 위해, 낮은 에너지 barrier가 필요한 것으로 해석할 수 있다. 이같은 경향은 Ni/Cu/C가 carbon paper에 코팅된 전극이 기존 carbon paper 전극에 비해 셀전압이 줄어드는 실험 결과와 일치한다11). 그리고 Pt black 전극에 비해 전기 도금된 Pr-Ir 전극을 사용할 경우, NH3가 초기 흡착 후 N2로 전환되는 AOR 세부반응들이 빨라져서 전체 셀전압이 줄어드는 결과와도 유사하다12). Fig. 5는 NH3 농도를 변화시켜 가면서 I-V 곡선을 측정한 결과이다. CV 결과와 달리 0.5M에서 최소 셀 전압을 가지는 것이 아니라 2M에서 최소 셀 전압을 가지는 것을 확인할 수 있다.
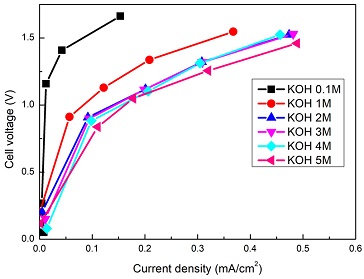
Effect of KOH concentration in solution on I-V curve in the CV measurement at the same amount of NH3 in 2 M
3.2 CP 실험 결과
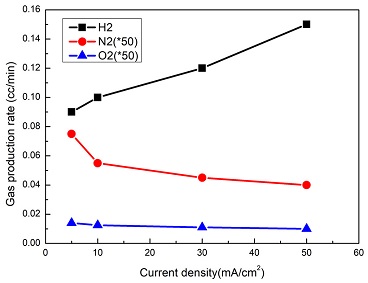
이제 0.5M NH3와 5M KOH가 섞인 수용액을 가지고 전류밀도를 5, 10, 30, 50 mA로 증가시켜 가면서 암모니아 수전해 시 발생하는 생성가스의 변화를 살펴보았다. Fig. 6에 나타나 있듯이 전류가 증가함에 따라 식 (1)의 HER 반응속도가 증가하여 H2생성율이 증가하는 경향을 보여주고 있다. 반대로 식 (2)의 AOR 반응과 식 (3)의 OER 반응은 전류증가에 따라 감소하는 것을 알 수 있다. 이로 인해 O2와 N2의 생성율이 오히려 감소하는 경향이 나타나고 있다. 가스생성율의 실험오차는 최대치의 ±10%임을 확인하였다. 모든 전류조건에서 80% 이상의 수소 Faraday효율은 보여주고 있다. AOR 반응이 경쟁반응인 OER 반응에 비해 전체 반응을 지배할 경우, 질소는 이론적으로 3배 적게 나와야 하지만 실제는 50배 적게 나오는 것을 알 수 있다. 이는 AOR 반응과 OER 반응 외에 metal oxynitride 생성 등의 기타 반응이 추가적으로 일어나기 때문으로 보인다. 참고로 간단한 mass balance를 이용하여 50 mA일 때 H2, N2, O2 생성량을 이론적으로 계산해 보았다. NH3, H2O, Ar 희석가스의 초기 몰수에서 두 개 반응에 대해 가정한 전환율을 고려한 몰수를 더하거나 빼면 반응 후 가스의 몰수를 계산할 수 있다. 그 결과 AOR 반응의 전환율이 90%이고, OER 반응 전환율이 10%로 가정할 경우에 가장 실험치와 유사한 경향을 보여주고 있다.
Table 1은 10 mA 전류조건에서 기존 수전해(0M NH3)와 0.5M NH3를 섞은 암모니아 수전해를 비교한 결과이다. 기존 수전해에 비해 암모니아 수전해의 경우 수소 생산량이 0.140에서 0.125 cc/min으로 11%정도 감소하고 셀전압과 이로 인한 소요전력이 43%정도 증가한다. 상기 실험 결과를 고려하면, 식 (5)로 표현되는 에너지 효율이 35% 이상 감소하는 효과를 볼 수 있다. 이같은 경향은 HER 반응이 일어나는 전극이 Ni일 경우, 수용액에 1 M 암모니아를 첨가할 경우 전류가 10% 적게 나오는 결과와 일치한다13). 특히 Pt, Ru 전극일 경우 암모니아 첨가로 인해 전류가 보다 더 감소하는 경향을 보여준다. 이는 암모니아가 존재할 경우 Ni 표면으로의 NH3 흡착과 이로 인한 메탈전극에 흡착된 수소의 탈착이 지연되어 HER 반응이 감소하기 때문으로 알려져 있다. 반대로 Rh전극일 경우는 암모니아 첨가로 인해 전류가 66% 이상 증가하는 결과를 보여주고 있다. 따라서 수전해에 많이 사용하는 니켈 폼을 암모니아 수전해에 음극으로 그대로 사용할 경우 수소생산과 에너지 효율의 저하를 가져 올 수 있음을 보여주고 있다. 이를 해결하기 위해 값비싼 Pt-13%Rh 코일을 사용하여 동일한 실험을 수행하였다. 그 결과 Botte 연구진의 실험 결과13)와 비슷하게 암모니아 수전해가 20% 증가된 수소생산으로 인해 기존 수전해에 비해 4% 정도 증가하는 에너지 효율을 가지는 것을 확인할 수 있었다.
4. 결 론
1) 암모니아 산화반응(AOR)의 전기화학 반응성을 보여주는 CV 실험 결과로부터 암모니아 농도 0.5M에서 가장 큰 전류밀도를 가지는 것을 알 수 있다.
2) I-V 실험 결과로부터 암모니아 농도 2M일 때 가장 낮은 셀 전압을 가지는 것을 알 수 있다.
3) CP 실험 결과로부터 전류밀도에 따라 수소생성량은 증가하고, 질소와 산소의 생성량은 감소하는 경향을 볼 수 있다.
4) Pt-Ni 전극을 사용하는 본 CP 실험에서는 기존 수전해에 비해 암모니아 수전해(0.5M)가 11%감소된 수소생성량과 43% 높은 셀 전압으로 인해 에너지 효율이 35% 정도 감소하는 결과를 보여준다.
5) 이와 달리 Pt-Pt/13%Rh 전극을 사용할 경우는 기존 수전해에 비해 암모니아 수전해(0.5 M)가 20% 증가된 수소 생성으로 인해 에너지 효율이 4% 정도 증가함을 확인하였다.
Nomenclature
| n : | number of electron involved in electrochemical reaction |
| F : | Faraday constant (96,487 C/mol) |
| xH2 : | mole fraction of hydrogen in the mixture of product gases analyzed |
| : | molar flow rate of product gas (mol/s) |
| I : | current (A) |
| HHV : | higher heating value (J/g) |
| MW : | molecular weight (g/mol) |
| e : | electron |
| ηF,H2 : | Faraday efficiency |
| ηenergy,H2 : | energy efficiency |
Subscripts
| H2 : | hydrogen |
| N2 : | nitrogen |
| O2 : | oxygen |
| Ar : | argon |
| energy : | energy efficiency |
Superscripts
| - : | negative charged |
Acknowledgments
이 과제는 부산대학교 기본연구지원사업(2년)에 의하여 연구되었다.
References
-
R. Lan, J. T. S. Irvine, and S. Tao, “Ammonia and related chemicals as potential indirect hydrogen storage materials”, Int. J. Hydrogen Energy, Vol. 37, No. 2, 2012, pp. 1482-1494.
[https://doi.org/10.1016/j.ijhydene.2011.10.004]

-
H. L. Jiang, S. K. Singh, J. M. Yan, X. B. Zhang, and Q. Xu, “Liquid-phase chemical hydrogen storage: catalytic hydrogen generation under ambient conditions”, ChemSusChem, Vol. 3, No. 5, 2010, pp. 541-549.
[https://doi.org/10.1002/cssc.201000023]

-
S. Lee and H. J. Lee, “Potential applicabilities of ammonia in future hydrogen energy supply industries”, Appl. Chem. Eng., Vol. 30, No. 6, 2019, pp. 667-672.
[https://doi.org/10.14478/ace.2019.1094]

-
J. Gwak, M. Choun, and J. Lee, “Alkaline ammonia electrolysis on electrodeposited platinum for controllable hydrogen production”, ChemSusChem, Vol. 9, No. 4, 2016, pp. 403-408.
[https://doi.org/10.1002/cssc.201501046]

-
S. Wasmus, E. J. Vasini, M. Krausa, H. T. Mishima, and W. Vielstich, “DEMS-cyclic voltammetry investigation of the electrochemistry of nitrogen compounds in 0.5 M potassium hydroxide”, Electrochim Acta., Vol. 39, 1994, PP. 23-31.
[https://doi.org/10.1016/0013-4686(94)85006-2]

-
Y. Yang, J. Kim, H. Jo, A. Seong, M. Lee, H. K. Min, M. G. Seo, Y. Choi, and G. Kim, “A rigorous electrochemical ammonia electrolysis protocol with in operando quantitative analysis”, J. Mater. Chem. A, Vol. 9, No. 19, 2021, pp. 11571-11579.
[https://doi.org/10.1039/D1TA00363A]

-
T. L. Lomocso and E. A. Baranova, “Electrochemical oxidation of ammonia on carbon-supported bi-metallic PtM (M = Ir, Pd, SnOx) nanoparticles”, Electrochim. Acta, Vol. 56, No. 24, 2011, pp. 8551-8558.
[https://doi.org/10.1016/j.electacta.2011.07.041]

-
M. Jiang, D. Zhu, and X. Zhao, “Electrolysis of ammonia for hydrogen production catalyzed by Pt and Pt-Ir deposited on nickel foam”, Journal of Energy Chemistry, Vol. 23, No. 1, 2014, pp. 1-8.
[https://doi.org/10.1016/S2095-4956(14)60110-8]

-
J. H. Woo, T. Y. Kim, J. E. Kim, B. Cho, S. Jung, S. Park, S. C. Lee, and J. C. Kim, “Ni catalyst properties for ammonia reforming: comparison of Ni content and space velocity”, Trans Korean Hydrogen New Energy Soc, Vol. 32, No. 5, 2021, pp. 464-469.
[https://doi.org/10.7316/KHNES.2021.32.6.464]

-
A. C. A. De Vooys, M. T. M. Koper, R. A. Van Santen, and J. A. R. Van Veen, “The role of adsorbates in the electrochemical oxidation of ammonia on noble and transition metal electrodes”, J. Electroanal. Chem., Vol. 506, No. 2, 2001, pp. 127-137.
[https://doi.org/10.1016/S0022-0728(01)00491-0]

-
H. Zhang, Y. Wang, Z. Wu, and D. Y. Leung, “An ammonia electrolytic cell with NiCu/C as anode catalyst for hydrogen production”, Energy Procedia, Vol. 142, 2017, pp. 1539-1544.
[https://doi.org/10.1016/j.egypro.2017.12.605]

-
F. Vitse, M. Cooper, and G. G. Botte, “On the use of ammonia electrolysis for hydrogen production”, Journal of Power Sources, Vol. 142, No. 1-2, 2005, pp. 18-26.
[https://doi.org/10.1016/j.jpowsour.2004.09.043]

-
R. Palaniappan and G. G. Botte, “Effect of ammonia on Pt, Ru, Rh, and Ni cathodes during the alkaline hydrogen evolution reaction”, J. Phys. Chem. C, Vol. 117, No. 34, 2013, pp. 17429-1744.
[https://doi.org/10.1021/jp405191c]