직접 수소화붕소나트륨/과산화수소 연료전지를 위한 니켈 기반 촉매
2020 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
Nickel-based bimetallic catalysts were investigated for use in direct borohydride/hydrogen peroxide fuel cells. For anode and cathode, PdNi and AuNi catalysts were used, respectively. Nickel-based bimetallic catalysts have been investigated through various methods, such as inductively coupled plasma optical emission spectroscopy, transmission electron microscopy, scanning electron microscopy, and energy dispersive spectroscopy. The performance of the catalysts was evaluated through fuel cell tests. The maximum power density of the fuel cell with nickel-based bimetallic catalysts was found to be higher than that of the fuel cell with the monometallic catalysts. The nickel-based bimetallic catalysts also exhibited a stable performance up to 60 minutes.
Keywords:
Sodium borohydride, Hydrogen peroxide, Catalyst, Multiwalled carbon nanotubes, Direct borohydride/hydrogen peroxide fuel cell키워드:
수소화붕소나트륨, 과산화수소, 촉매, 다중벽탄소나노튜브, 직접 수소화붕소나트륨/과산화수소 연료전지1. 서 론
기술 개발을 통한 국력 신장과 자원 개발로 인한 경제적 효과로 인해 선진국에서는 우주 탐사와 해양 탐사 연구를 활발히 진행하고 있다. 이차전지, 원자력전지, 태양전지가 우주 탐사와 해양 탐사를 위한 소형 시스템의 동력원으로 널리 사용되고 있지만, 기존 동력원은 단점을 지니고 있다. 이차전지는 에너지 밀도가 낮아 임무 기간을 제한하고, 원자력전지는 위험하며, 태양전지는 태양광이 존재하지 않는 영역에서 작동되지 않는다.
우주 및 해양 탐사를 위한 소형 시스템의 차세대 동력원으로 연료전지가 많은 관심을 받고 있지만, 소형 시스템의 동력원으로 널리 활용되는 고분자 전해질 연료전지(polymer electrolyte membrane fuel cell, PEMFC)는 연료 저장의 문제점을 갖고 있다. 우주 및 해양의 무산소 환경을 위해 기체 수소와 기체 산소를 사용하는 경우에는 기체 연료의 큰 부피로 인해서 연료전지 시스템의 단위 부피당 에너지 밀도가 낮다. 액체 수소와 액체 산소를 사용하는 경우에는 낮은 저장온도(액체 수소: -253℃, 액체 산소: -183℃)로 시스템이 복잡해져 연료전지 시스템의 단위 질량당 에너지 밀도가 낮아진다. 또한, 연료의 증발로 인해 저장 기간이 짧아지기 때문에 임무 기간이 제한된다.
미국, 영국, 중국, 인도는 PEMFC 시스템이 갖는 연료 저장의 문제점을 해결하기 위해서 2000년대부터 직접 수소화붕소나트륨/과산화수소 연료전지(direct borohydride/hydrogen peroxide fuel cell, DBHPFC) 연구를 수행하고 있다1-7). PEMFC는 수소와 산소를 이용하여 전기를 생산하지만, DBHPFC는 액체 연료인 수소화붕소나트륨(NaBH4) 용액과 과산화수소(H2O2)용액을 직접 산화, 환원시켜 전기를 생산한다.
| (1) |
DBHPFC는 많은 장점을 지닌다. 첫째, 액체 연료를 사용하기 때문에 단위 부피당 에너지 밀도가 높고, 연료의 저장성과 취급성이 우수하며, 연료의 충전이 용이하다. 미국의 연구진은 DBHPFC의 실험 결과를 바탕으로 1,000 Wh/kg의 에너지 밀도와 90일 이상의 임무 기간을 예상하였다3). 둘째, 동력밀도가 높다. 지금까지 개발된 DBHPFC의 최대 동력밀도는 680 mW/cm2 (작동 온도: 60℃)로 직접 메탄올 연료전지에 비해 우수하며, PEMFC보다는 다소 낮은 수준이다8). DBHPFC는 2000년대부터 연구가 시작되었기 때문에 PEMFC만큼 연구가 활발히 수행된다면 동력밀도는 향상될 수 있다. 셋째, DBHPFC의 이론 전압은 3.01 V로 PEMFC의 이론 전압(1.23 V)보다 높다. 넷째, 작동 온도가 100℃ 미만이므로 시동 특성이 비교적 우수하다.
DBHPFC의 장점과 가능성으로 인해 DBHPFC 연구가 점차 확대되고 있다. 그러나 DBHPFC는 전극 촉매에서 연료가 분해되는 단점을 갖고 있다. 산화극에서는 NaBH4의 분해 반응으로 수소가 발생하고, 환원극에서는 H2O2의 분해 반응으로 산소가 발생한다. 분해 반응으로 열이 발생하고 발생된 열은 주변으로 소산된다. 따라서 분해 반응은 에너지의 손실을 의미한다. 많은 연구진이 우수한 반응성을 갖는 전극 촉매를 연구하여 DBHPFC의 성능을 향상시켰지만9-13), 전극 촉매의 반응 선택성을 정량적으로 평가하지 않았다. 분해 반응이 활발해지면 효율이 감소하기 때문에 연료전지 시스템의 효율을 높이기 위해서는 반응 선택성도 반드시 고려되어야 한다.
| (2) |
| (3) |
본 연구진은 선행 연구에서 Rh, Ru, Pt, Au, Ag, Pd, Ni, Cu 촉매를 사용하여 DBHPFC를 위한 산화극과 환원극을 제작하였다14). NaBH4 용액과 H2O2 용액의 분해 반응에 대한 활성을 평가하였고, 연료전지 성능평가를 실시하였다. 반응성과 반응 선택성을 고려하여 산화극과 환원극을 위한 촉매를 선정하였다. 산화극에는 Pd 촉매가 가장 적합하였으며, 환원극에는 Au 촉매가 가장 적합하였다.
본 연구에서는 촉매의 가격을 절감하기 위해서 DBHPFC의 전극을 위한 Ni 기반 촉매(산화극: PdNi 촉매, 환원극: AuNi 촉매)를 연구하였다. Ni 기반의 촉매를 제작하고 다양한 분석을 실시하여 촉매의 특성을 확인하였다. 또한, 연료전지 성능평가를 실시하여 기존의 단일 촉매와 반응성과 반응 선택성을 비교하였다. Ni 기반의 촉매를 갖는 DBHPFC의 성능을 검증하기 위해 반응 온도와 시간에 따른 영향도 확인하였다.
2. 실 험
2.1 촉매 제작
선행 연구의 제작 절차를 따라 Pd 촉매, Au 촉매, Pd50Ni50 촉매, Au50Ni50 촉매를 제작하였다14). 촉매 제작을 위해 촉매 전구체, 시트르산 나트륨(HOC[COONa][CH2COONa]2·2H2O, Sigam-Aldrich, St. Louis, USA)을 20 g의 증류수(H2O, Samchun Chemical, Seoul, Korea)에 용해시켜 촉매 용액을 제작하였다. 촉매 전구체는 염화 금(AuCl3, Sigma-Aldrich), 질산 팔라듐(Pd[NO3]2·2H2O, Sigma-Aldrich), 염화 니켈(NiCl2, Sigma-Aldrich)을 사용하였다. 촉매의 분산을 위해 시트르산 나트륨을 사용하였으며, 촉매와 시트르산 나트륨의 몰비가 1:1이 되도록 용액을 제작하였다. 제작된 촉매 용액에 촉매와 지지체의 질량비가 1 (촉매):5 (지지체)가 되도록 카르복실기(COOH)로 기능화 된 다중벽 탄소나노튜브(multiwalled carbon nanotubes, MWCNTs)를 첨가하였다. MWCNTs (US Research Nanomaterials, Houston, USA)의 분산을 위해서 MWCNTs가 첨가된 촉매 용액을 초음파 세척기(US-2R, As One, Osaka, Japan)로 30분 동안 분산시켰다.
MWCNTs가 분산된 촉매 용액에 NaBH4 용액을 주입하여 MWCNTs에 촉매를 환원시켰다. 촉매와 NaBH4의 몰비가 1 (촉매):10 (NaBH4)이 되도록 20 g의 증류수에 NaBH4 (Samchun Chemical)를 용해시켜 NaBH4 용액을 제작하였다. 제작된 NaBH4 용액은 시린지 펌프(LSP02-2A, Longer Precision Pump, Baoding, China)를 사용하여 촉매 용액에 1시간 동안 주입하였다. 충분한 환원을 위해서 NaBH4 용액 주입 시점부터 24시간 동안 자석 교반기(RCT Basic, Ika, Königswinter, Germany)를 이용하여 촉매 용액을 100 rpm으로 교반하였다. 이후 MWCNTs에 환원된 촉매를 여과하였으며, 충분한 물과 에탄올(C2H5OH, Samchun Chemical)을 사용하여 세척하였다. 세척된 촉매는 진공 건조기(C-DVD1, Changshin Science, Seoul, Korea)를 사용하여 40℃로 건조하였으며, 촉매를 사용하기 전까지는 진공건조기에 보관하였다.
2.2 전극 제작
촉매 슬러리를 제작하기 위해 촉매/MWCNTs, 5 wt% 나피온 용액(D521, Chemours, Wilmington, USA), 에탄올을 사용하였고, 1 (촉매/MWCNTs):1 (나피온 용액):20 (에탄올)의 질량 비율로 촉매 슬러리를 제조하였다. 촉매를 균일하게 분산하기 위해 자석 교반기를 이용하여 제작된 촉매 슬러리를 300 rpm에서 30분 동안 교반하였다. 스프레이 건(Spray-Work Basic Airbrush, Tamiya, Shizuoka, Japan)을 이용하여 촉매 슬러리를 3.3 cm (가로)×3.3 cm (세로)×0.04 cm (두께)의 탄소천(CCP40, Fuel Cell Earth, Woburn, USA)에 분사하였다. 탄소천 위에 1 mg/cm2의 촉매를 코팅하기 위해 촉매 슬러리 분사와 건조를 반복하였다. 촉매가 코팅된 탄소천을 황산 용액(H2SO4, Samchun Chemical)에 30초 동안 넣어 산 처리를 하고, 증류수에 2회 세척하였다. 제작된 전극은 진공 건조기를 이용하여 40℃로 건조하였으며, 전극을 사용하기 전까지는 진공건조기에 보관하였다.
2.3 전해질 세척
본 연구진은 선행 연구에서 상용 Nafion 211, 212, 115, 117 전해질을 사용하여 DBHPFC의 성능을 평가하였다. 전해질 중에서 Nafion 212 전해질을 갖는 DBHPFC의 성능이 가장 우수하였다15). 따라서 본 연구에서는 연료전지 성능평가를 위해 상용 Nafion 212 전해질(Chemours)을 사용하였으며, 선행 연구와 동일한 절차로 전해질을 세척하였다. 4.7 cm (가로)×4.7 cm (세로) 크기의 Nafion 212 전해질을 준비한 후 1시간 동안 80℃의 세척 용액에 넣어 전해질을 세척하였다. 세척에 사용된 용액은 3 wt% H2O2 (Samchun Chemical), 3 wt% H2SO4, 94 wt% H2O의 조성으로 제조하였다. 용액에서 꺼낸 전해질을 1시간 동안 80℃의 증류수에 넣어 추가 세척을 진행하였다. 세척된 전해질을 사용하기 전까지는 증류수에 넣어 보관하였다.
2.4 연료전지
연료전지의 구성은 본 연구진이 선행 연구에서 사용한 연료전지와 유사하였다15). 전해질, 전극, 실리콘 가스킷, 양극판, 집전판, 끝판을 사용하여 연료전지를 구성하였다. 세척 후 보관된 전해질을 0.5 mol/kg H2SO4 용액에 2시간 동안 넣어 활성화를 시켰고, 활성화 된 전해질, 산화극, 환원극을 사용하여 막-전극 접합체를 제작하였다. 깊이와 폭이 1 mm인 사형(serpentine) 유로를 갖는 흑연 양극판을 사용하였다. 막-전극 접합체와 흑연 양극판 사이의 연료 누설을 방지하기 위해서 0.25 mm의 두께를 갖는 실리콘 가스킷(SGC30, Fuel Cell Earth)을 적용하였다. 연료전지 성능을 측정하기 위해서 2개의 금 도금된 집전판을 사용하였으며, 연료전지 구성품을 체결하기 위해서 2개의 스테인리스 강 재질의 끝판을 사용하였다. 균일한 압력으로 구성품을 체결하기 위해서 토크 렌치(50QL, Tohnichi, Tokyo, Japan)를 사용하였으며, 20 kgf cm의 체결압으로 구성품을 체결하였다.
2.5 촉매 및 전극 분석
다양한 분석법을 활용하여 촉매와 전극의 특성을 분석하였다. 유도결합플라즈마 분광분석기(720, Agilent, Santa Clara, USA)를 사용하여 MWCNTs에 환원된 촉매의 양을 측정하였다. 투과전자현미경(JEM-2100F, Jeol, Tokyo, Japan)을 사용하여 MWCNTs에 환원된 촉매의 분산 특성을 확인하였다. 주사전자현미경(MIRA1 LMH, Tescan, Brno, Czech Republic)과 에너지분산 X선 분광분석기(MIRA1 LMH, Tescan)를 활용하여 전극의 표면 상태와 조성을 분석하였다.
2.6 연료전지 성능평가
촉매의 반응성과 반응 선택성을 평가하기 위해서 연료전지 성능평가를 실시하였다. 연료의 조성은 본 연구진의 선행 연구의 결과를 참고하여 결정하였다15). 연료의 안정화를 위해 수산화 나트륨(NaOH, Samchun Chemical)과 인산(H3PO4, Samchun Chemical)을 사용하였다. 산화극을 위한 연료는 5 wt% NaBH4+10 wt% NaOH+85 wt% H2O의 조성으로 제조하였고, 환원극을 위한 연료는 20 wt% H2O2+5 wt% H3PO4+75 wt% H2O의 조성으로 제조하였다. 성능평가 동안에는 가열기를 이용하여 연료의 온도를 일정하게 유지시켰다.
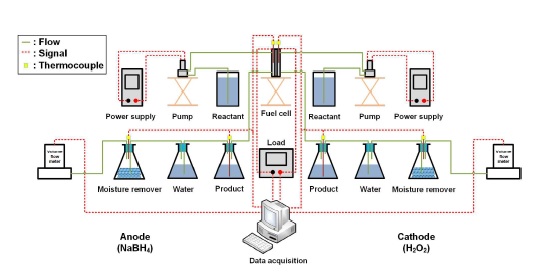
Fig. 1은 연료전지 성능평가에 사용된 실험 장치의 구성도이다. 연료전지는 산화극과 환원극에서 전기화학 반응이 일어나며 산화극에서 생성된 전자가 환원극으로 이동함에 따라 전기가 발생된다. 따라서 산화극과 환원극의 실험장치 구성은 동일하다. 전원공급기(IT6720, Itech, New Taipei City, Taiwan)를 이용하여 액체 펌프(9QQ, Boxer, Ottobeuren, Germany)를 구동하였으며, 액체 펌프가 비커에 있는 연료를 분당 10 mL씩 연료전지에 공급하였다. 공급된 연료는 사형 유로를 따라 흐르면서 전극 촉매와 반응을 하고, 반응에 의해서 전자, 액체 생성물, 기체 생성물이 생성된다. 전자의 이동에 따른 연료전지의 성능을 측정하기 위해 전자 부하장치(3315F, Prodigit, New Taipei City, Taiwan)를 사용하였다. 액체 생성물은 삼각 플라스크에 저장하였으며, 기체 생성물은 물과 실리카겔(SiO2, Samchun Chemical)이 담긴 삼각 플라스크를 통과시켜 불순물과 수분을 제거하였다. 촉매의 반응 선택성을 확인하기 위해서 부피 유량계(수소: FMA-1606A, 산소: FMA-1605A, Omega, Norwalk, USA)를 이용하여 기체 생성물의 부피 유량을 측정하였다. 연료전지, 액체 생성물, 기체 생성물의 온도는 K타입 열전대를 사용하여 측정하였다. 측정된 전압, 부피 유량, 온도는 데이터 획득 장치(GL240, Graphtec, Yokohama, Japan)를 사용하여 컴퓨터에 저장하였다.
전류밀도를 0 mA/cm2부터 400 mA/cm2까지 25 mA/cm2의 간격으로 변화시켜 가며 성능을 측정하였고, 각 전류밀도에서 1분 동안 데이터를 획득하여 평균 전압과 동력밀도를 계산하였다. 연료전지의 성능은 반응 온도에 의해서도 영향을 받기 때문에 온도의 영향을 줄이고자 일정한 범위의 온도(35.0±4.5℃ 또는 56.0±2.0℃)에서 성능을 평가하였다.
3. 결과 및 고찰
3.1 Ni 기반 촉매의 특성 분석
전극 촉매의 반응성과 반응 선택성을 평가하기 위해서 Ni 기반의 산화극 촉매 Pd50Ni50와 환원극 촉매 Au50Ni50을 제작하였다. 제작된 촉매로 전극을 제작하였으며, 다양한 분석법을 활용하여 촉매와 전극의 특성을 분석하였다.
촉매의 특성을 분석하기 위해 유도결합플라즈마 분광분석기와 투과전자현미경을 사용하여 MWCNTs에 환원된 촉매의 양과 분산 특성을 확인하였다. Table 1은 환원된 촉매의 양을 나타낸다. 1 (촉매):5 (지지체) 비율로 촉매를 제작하였으므로, 제작된 촉매의 질량 백분율은 16.7 wt%이다. 비교적 환원이 용이한 Pd 촉매와 Au 촉매의 경우에는 분석된 촉매의 질량 백분율이 제작 시 의도된 질량 백분율인 16.7 wt%와 유사하였다. 그러나 비 귀금속 Ni을 포함하는 Pd50Ni50 촉매와 Au50Ni50 촉매의 경우에는 Ni의 환원이 적절히 이루어지지 않아 질량 백분율이 16.7 wt%보다 작았다. at% 비율 역시 의도와 달리 Pd75Ni25과 Au75Ni25로 제작되었다. 촉매의 환원을 위해서 몰 비율 1 (촉매):10 (NaBH4)의 NaBH4 용액을 사용하였지만 비 귀금속인 Ni을 환원시키기에는 부족하다고 판단된다. He 등16)은 DBHPFC의 전극을 위한 Au75Ni25 촉매, Au50Ni50 촉매, Au25Ni75 촉매의 제작을 시도하였지만, 비 귀금속인 Ni의 환원이 적절히 이루어지 않아 Au80Ni20 촉매, Au58Ni42 촉매, Au41Ni59 촉매가 제작되었다. 따라서 환원이 잘 이루어지지 않는 비 귀금속인 Ni을 환원시키기 위해서는 촉매의 제작 조건에 대한 후속 연구가 필요하다고 사료된다. Fig. 2는 제작된 촉매의 분산 특성을 나노 스케일 수준으로 보여준다. MWCNTs에 환원된 촉매 입자의 크기는 대부분 20 nm 이하였으며, 비교적 고르게 분포하였다. 그러나 Au 촉매와 Ni 기반 촉매의 경우에는 Au 촉매와 Ni 촉매의 분산특성이 좋지 않아 작은 촉매 입자가 뭉쳐서 클러스터를 형성한 부분도 존재하였다. 이는 본 연구진의 선행 연구와 유사한 결과이다17). Fig. 2(d)는 20 nm 이하의 작은 촉매 입자가 뭉쳐서 클러스터를 형성한 모습을 보여준다. 촉매제작 과정에서 촉매와 시트르산 나트륨의 몰비가 1:1이 되도록 시트르산 나트륨을 촉매 용액에 첨가하였으나 촉매의 분산 특성을 향상시키기에는 다소 부족하다고 판단된다.

TEM images of the catalysts for anode and cathode: (a) Pd/MWCNTs, (b) Au/MWCNTs, (c) Pd75Ni25/MWCNTs, and (d) Au75Ni25/MWCNTs
전극의 특성을 분석하기 위해 주사전자현미경과 에너지분산 X선 분광분석기를 사용하여 전극의 표면 상태와 조성을 확인하였다. Fig. 3은 제작된 전극의 표면을 나타낸다. 탄소천 위에 촉매층이 균일하게 형성된 것을 확인할 수 있다. 에너지분산 X선 분광분석기를 활용하여 전극 표면의 조성을 분석하였으며, Pd, Au, Ni, C, F, S, O가 검출되었다. 촉매와 지지체의 성분 외에도 나피온 바인더의 사용과 촉매의 산화로 인해서 소량의 F, S, O가 검출되었다. Fig. 4와 Fig. 5는 Ni 기반 촉매를 갖는 전극의 촉매 분포를 마이크로 스케일 수준으로 보여주고 있다. 촉매가 비교적 균일하게 분포된 부분도 존재하였으나, Ni이 혼합됨에 따라 Pd, Au, Ni 촉매 입자가 뭉쳐서 클러스터를 형성한 부분도 확인되었다. 이는 나노 스케일 수준에서 관찰된 분산 특성과 유사하다.

SEM images of the electrodes: (a) Pd75Ni25/MWCNTs anode electrode and (b) Au75Ni25/MWCNTs cathode electrode
3.2 Ni 기반 촉매의 성능평가
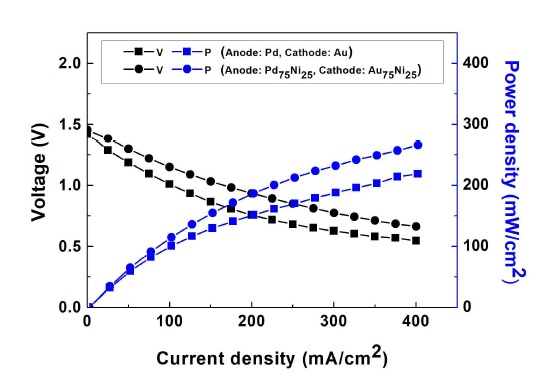
단일 촉매를 갖는 기존의 전극(산화극: Pd, 환원극: Au)과 Ni 기반 촉매를 갖는 새로운 전극(산화극: Pd75Ni25, 환원극: Au75Ni25)의 반응성과 반응 선택성을 비교하기 위해서 연료전지 성능평가를 실시하였다. 촉매를 제외한 모든 조건은 동일하였으며, 35.0±4.5℃의 온도에서 성능을 평가하였다.
반응성은 Ni 기반의 촉매가 우수하였다. Fig. 6과 Table 2는 연료전지 성능평가 결과를 나타낸다. 단일 촉매를 갖는 연료전지와 Ni 기반 촉매를 갖는 연료전지의 개회로 전압은 각각 1.43 V와 1.45 V로 유사하였다. 그러나 전압 손실로 인해서 단일 촉매를 갖는 연료전지의 작동 전압이 Ni 기반 촉매를 갖는 연료전지의 작동 전압보다 작았다. 따라서 Ni 기반 촉매를 갖는 연료전지의 최대 동력밀도는 265.6 mW/cm2로 단일 촉매를 갖는 연료전지의 최대 동력밀도인 218.8 mW/cm2에 비해 21% 증가하였다.

Maximum power density and average gas generation rates using electrodes with monometallic catalysts and bimetallic catalysts (operating temperature: 35.0±4.5℃)
그러나 반응 선택성은 기존의 단일 촉매가 우수하였다. Ni을 첨가한 촉매의 수소 발생률은 114.6 mL/min으로 Pd 촉매의 수소 발생률인 59.1 mL/min보다 높았다. Ni 촉매는 NaBH4 가수분해 반응에도 사용되기 때문에 수소 발생률이 증가할 것으로 예측하였으나 Ni을 첨가한 촉매의 수소 발생률이 Pd 촉매에 비해 194%나 높게 측정되었다. 이는 연료전지 성능평가를 수행하기 위해 연료전지를 체결하는 과정에서 부주의로 인해 산화극 촉매층 일부가 손상되었기 때문이다. 손상된 촉매층과 탄소천 사이의 결합력이 약화되었고, 수소발생 반응으로 인해 손상된 촉매층의 촉매 일부가 전극으로부터 소실되었다. 소실된 촉매는 생성물과 함께 생성물 삼각 플라스크에 저장되었다. 생성물 삼각 플라스크에 저장된 촉매가 연료전지에서 미반응한 NaBH4와 반응하여 수소 발생률이 다소 높게 측정되었다고 사료된다. Au 촉매와 Au75Ni25 촉매의 산소 발생률은 각각 45.7 mL/min과 47.4 mL/min으로 유사하였다.
Ni 기반의 촉매는 기존의 단일 촉매에 비해 반응성은 다소 우수하여 최대 동력밀도가 증가하였다. 최대 동력밀도가 증가하면 전극의 단위 면적당 많은 양의 동력을 생산할 수 있어 연료전지 스택의 무게와 부피가 감소한다. 그러나 Ni 기반 촉매는 반응 선택성이 좋지 못하여 기체 발생률 역시 증가하였다. 기체 발생률이 증가하면 연료의 손실이 증가하고 연료의 무게와 부피가 증가한다. 따라서 촉매의 반응성과 반응 선택성 데이터를 바탕으로 연료전지 스택 및 연료의 무게와 부피를 예측하여 적절한 촉매를 결정해야 한다.
3.3 반응 온도에 따른 성능변화
Ni 기반 촉매를 갖는 전극(산화극: Pd75Ni25, 환원극: Au75Ni25)의 반응 온도에 따른 성능변화를 확인하였다. 반응 온도를 제외한 모든 조건은 동일하였으며, 35.0±4.5℃와 56.0±2.0℃의 온도에서 성능을 평가하였다.
Fig. 7과 Table 3은 연료전지 성능평가 결과를 나타낸다. 반응 온도가 증가함에 따라 개회로 전압은 1.45 V에서 1.54 V로 증가하였다. 전압 손실이 감소하여 최대 동력밀도는 265.6 mW/cm2에서 347.0 mW/cm2로 증가하였다. 반응 온도가 증가함에 따라 분해 반응에 대한 활성도 증가하여 산소 발생률 역시 47.4 mL/min에서 66.3 mL/min로 증가하였다. 최대 동력밀도는 131% 증가하였고, 산소 발생률은 140% 증가하였다. 그러나 56.0±2.0℃의 반응 온도에서 수소 발생률은 63.8 mL/min으로 35.0±4.5℃의 반응 온도에서 수소 발생률보다 작았다. 이는 반응 온도가 증가함에 따라 수소 발생률이 감소한 것이 아니라 35.0±4.5℃에서 연료전지 성능평가를 실시하였을 때 산화극 촉매 일부가 소실되어 생성물 플라스크에서 NaBH4와 반응을 하였기 때문이다.
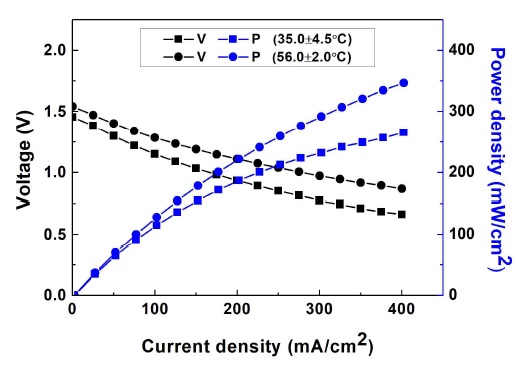
Fuel cell performance when operating temperature was varied (anode catalyst: Pd75Ni25, cathode catalyst: Au75Ni25)

Maximum power density and average gas generation rates using electrodes with bimetallic catalysts (anode catalyst: Pd75Ni25, cathode catalyst: Au75Ni25)
반응 온도를 증가시키면 Ni 기반 촉매의 반응성이 향상되어 동력밀도가 증가된다. 그러나 반응 온도가 증가하면 기체 발생률 역시 증가하였다. 반응 온도가 증가하면 연료전지 스택의 경량화 측면에서는 유리하지만, 연료의 경량화 측면에서는 불리하다. 따라서 반응온도에 따른 반응성과 반응 선택성 데이터를 바탕으로 연료전지 스택 및 연료의 무게와 부피를 예측하여 적절한 반응온도를 결정해야 한다.
3.4 반응 시간에 따른 성능
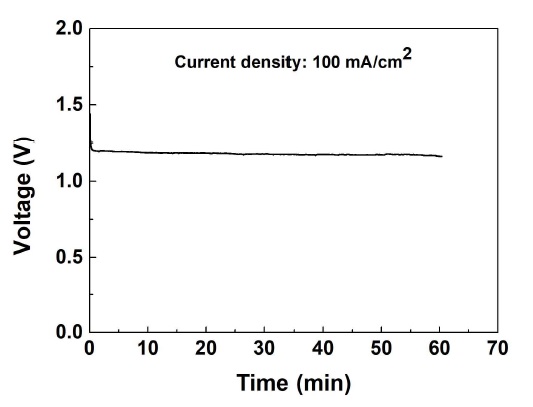
Ni 기반 촉매를 갖는 전극(산화극: Pd75Ni25, 환원극: Au75Ni25)의 반응 시간에 따른 성능을 확인하기 위해 100 mA/cm2의 전류밀도에서 전압을 측정하였다. 연료전지의 온도는 36.5±1.0℃로 유지하였다.
Fig. 8은 100 mA/cm2의 전류밀도에서 측정된 연료전지의 전압을 나타낸다. 연료전지의 개회로 전압은 1.43 V로 측정되었다. 100 mA/cm2의 전류밀도가 인가되자 전압이 1.20 V로 감소하였다. 1시간 동안 작동전압은 1.20 V에서 1.16 V로 감소하여, 전압 감소율은 약 40 mV/h로 측정되었다. 1시간 동안 평균적으로 29.3 mL/min의 수소가 발생되었으며, 21.3 mL/min의 산소가 발생되었다. Ni 기반의 촉매는 1시간 동안 비교적 안정적으로 성능을 유지하였다.
4. 결 론
촉매의 가격을 절감하기 위해서 DBHPFC의 전극을 위한 Ni 기반 촉매(산화극: PdNi 촉매, 환원극: AuNi 촉매)를 연구하였다. Ni 기반의 촉매를 제작하고 다양한 분석을 실시하여 촉매의 특성을 확인하였다. 또한, 연료전지 성능평가를 수행하여 기존의 단일 촉매와 반응성과 반응 선택성을 비교하였다. Ni 기반의 촉매는 기존의 단일 촉매에 비해 반응성은 우수하였지만 반응 선택성이 좋지 못하였다. Ni 기반 촉매는 100 mA/cm2의 전류밀도에서 1시간 동안 비교적 안정적인 성능을 유지하였다. 촉매의 비율을 조절하여 반응 선택성을 향상시킨다면, 가격이 저렴하고 반응성이 우수한 Ni 기반의 촉매는 DBHPFC에 적용될 수 있을 것이다.
Acknowledgments
이 논문은 2018년도 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구입니다(No. 2018R1D1A1B07040966).
References
-
R. K. Raman, N. A. Choudhury, and A. K. Shukla, “A high output voltage direct borohydride fuel cell”, Electrochem. Solid St., Vol. 7, No. 12, 2004, pp. A488-A491.
[https://doi.org/10.1149/1.1817855]

-
C. P. León, F. C. Walsh, A. Rose, J. B. Lakeman, D. J. Browning, and R. W. Reeve, “A direct borohydride—acid peroxide fuel cell”, J. Power Sources, Vol. 164, No. 2, 2007, pp. 441-448.
[https://doi.org/10.1016/j.jpowsour.2006.10.069]

-
G. H. Miley, N. Luo, J. Mather, R. Burton, G. Hawkins, L. Gu, E. Byrd, R. Gimlin, P. J. Shrestha, G. Benavides, J. Laystrom, and D. Carroll, “Direct NaBH4/H2O2 fuel cells”, J. Power Sources, Vol. 165, No. 2, 2007, pp. 509-516.
[https://doi.org/10.1016/j.jpowsour.2006.10.062]

-
J. Wei, X. Wang, Y. Wang, J. Guo, P. He, S. Yang, N. Li, F. Pei, and Y. Wang, “Carbon-supported Au hollow nanospheres as anode catalysts for direct borohydride-hydrogen peroxide fuel cells”, Energy Fuels, Vol. 23, No. 8, 2009, pp. 4037-4041.
[https://doi.org/10.1021/ef900186m]

-
R. O. Stroman, G. S. Jackson, Y. Garsany, and K. Swider-Lyons, “A calibrated hydrogen-peroxide direct-borohydride fuel cell model”, J. Power Sources, Vol. 271, 2014, pp. 421-430.
[https://doi.org/10.1016/j.jpowsour.2014.07.139]

-
B. Li, C. Song, X. Huang, K. Ye, K. Cheng, K. Zhu, J. Yan, D. Cao, and G. Wang, “A novel anode for direct borohydride-hydroge peroxide fuel cell: Au nanoparticles decorated 3D self-supported reduced graphene oxide foam”, ACS Sustain. Chem. Eng., Vol. 7, No. 13, 2019, pp. 11129-11137.
[https://doi.org/10.1021/acssuschemeng.9b00192]

-
Z. Wang, J. Parrondo, C. He, S. Sankarasubramanian, and V. Ramani, “Efficient pH-gradient-enabled microscale bipolar interfaces in direct borohydride fuel cells”, Nat. Energy, Vol. 4, 2019, pp. 281-289.
[https://doi.org/10.1038/s41560-019-0330-5]

-
L. Gu, N. Luo, and G. H. Miley, “Cathode electrocatalyst selection and deposition for a direct borohydride/hydrogen peroxide fuel cell”, J. Power Sources, Vol. 173, No. 1, 2007, pp. 77-85.
[https://doi.org/10.1016/j.jpowsour.2007.05.005]

-
F. Pei, Y. Wang, X. Wang, P. He, Q. Chen, X. Wang, H. Wang, L. Yi, and J. Guo, “Performance of supported Au–Co alloy as the anode catalyst of direct borohydride-hydrogen peroxide fuel cell”, Int. J. Hydrogen Energy, Vol. 35, No. 15, 2010, pp. 8136-8142.
[https://doi.org/10.1016/j.ijhydene.2010.01.016]

-
B. Šljukić, J. Milikić, D. M. F. Santos, C. A. C. Sequeira, D. Macciò, and A. Saccone, “Electrocatalytic performance of Pt–Dy alloys for direct borohydride fuel cells”, J. Power Sources, Vol. 272, 2014, pp. 335-343.
[https://doi.org/10.1016/j.jpowsour.2014.08.080]

-
M. G. Hosseini, R. Mahmoodi, and M. S. Amjadi, “Carbon supported Ni1Pt1 nanocatalyst as superior electrocatalyst with increased power density in direct borohydride-hydrogen peroxide and investigation of cell impedance at different temperatures and discharging currents”, Energy, Vol. 131, 2017, pp. 137-148.
[https://doi.org/10.1016/j.energy.2017.05.034]

-
L. Yi, B. Yu, W. Yi, Y. Zhou, R. Ding, and X. Wang, “Carbon-supported bimetallic platinum–iron nanocatalysts: application in direct borohydride/hydrogen peroxide fuel cell”, ACS Sustain. Chem. Eng., Vol. 6, No. 7, 2018, pp. 8142-8149.
[https://doi.org/10.1021/acssuschemeng.7b04438]

-
B. Li, C. Song, D. Zhang, K. Ye, K. Cheng, K. Zhu, J. Yan, D. Cao, and G. Wang, “Novel self-supported reduced graphene oxide foam-based CoAu electrode: an original anode catalyst for electrooxidation of borohydride in borohydride fuel cell”, Carbon, Vol. 152, 2019, pp. 77-88.
[https://doi.org/10.1016/j.carbon.2019.06.018]

-
T. H. Oh, B. Jang, and S. Kwon, “Electrocatalysts supported on multiwalled carbon nanotubes for direct borohydride–hydrogen peroxide fuel cell”, Int. J. Hydrogen Energy, Vol. 39, No. 13, 2014, pp. 6977-6986.
[https://doi.org/10.1016/j.ijhydene.2014.02.117]

-
T. H. Oh, B. Jang, and S. Kwon, “Performance evaluation of direct borohydride–hydrogen peroxide fuel cells with electrocatalysts supported on multiwalled carbon nanotubes”, Energy, Vol. 76, 2014, pp. 911-919.
[https://doi.org/10.1016/j.energy.2014.09.002]

-
P. He, Y. Wang, X. Wang, F. Pei, H. Wang, L. Liu, and L. Yi, “Investigation of carbon supported Au–Ni bimetallic nanoparticles as electrocatalyst for direct borohydride fuel cell”, J. Power Sources, Vol. 196, No. 3, 2011, pp. 1042-1047.
[https://doi.org/10.1016/j.jpowsour.2010.08.037]

-
T. H. Oh, “Gold-based bimetallic electrocatalysts supported on multiwalled carbon nanotubes for direct borohydride–hydrogen peroxide fuel cell”, Renew. Energy, Vol. 163, 2021, pp. 930-938.
[https://doi.org/10.1016/j.renene.2020.09.028]