알카라인 수전해 시스템의 HILS 동특성 모델 및 고장 진단 장치 개발
2024 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
In this study, an alkaline water electrolysis system was built and a hardware-in-the loop simulation (HILS) was developed that can simultaneously operate the experimental device and system simulator in real time to evaluate dynamic characteristics fault diagnosis by receiving data from the system. In order to analyze the dynamic characteristics, a numerical model was developed considering the temperature transient phenomenon according to the load of the stack. The alkaline water electrolysis simulations using various mathematical models agreed very well with experimental results. As a result, an abnormal conditions were detected in real time for system failure diagnosis using HILS.
Keywords:
Alkaline electrolysis, Hydrogen, Hardware in the loop simulation(HILS), Dynamic characteristics model, Fault diagnosis키워드:
알카라인 전기 분해, 수소, 동특성 모델, 고장 진단1. 서 론
최근 지속적인 인구 증가와 에너지 집약적인 생활 방식으로 인하여 전 세계적으로 에너지 수요가 증가하면서 화석 연료의 지속 불가능한 사용과 지구 온난화에 대한 우려가 증가하고 있다. 모든 인간의 활동을 지원하기 위해서는 에너지 자원이 필요하며 여기서 재생 에너지의 개발은 지구 탄소 중립을 향한 에너지 전환을 가속화하기 위해 필수적으로 요구된다. 수소는 산소와 반응하여 전기를 생성할 때 물만 생성되기 때문에 가장 탄소가 없는 에너지 운반체 중 하나로 간주된다. 또한 수소는 높은 에너지 밀도와 같은 청정 에너지 운반체로써 유익한 물리적이고 화학적인 특성을 모두 가지고 있다1-3).
수소는 자연에 존재하는 가장 풍부한 원소이지만 화석 연료나 물 등에 존재하기 때문에 다양한 화학적 방법을 통해 추출하는 과정이 필요하다. 따라서 수십 년 동안 증기 메탄 개질, 바이오매스, 물 전기 분해 등 다양한 수소 생산 기술이 연구되었다4-6). 물을 전기 분해하여 수소를 얻는 수전해 기술은 매우 고순도의 수소를 생산할 수 있고 환경 오염은 적지만 고가의 전력 비용이 발생한다. 수전해 기술에는 수전해 장치 구성 요소 및 반응 환경에 따라 알카라인 수전해(alkaline water electrolysis), 양성자 교환막 수전해(proton exchange membrane water electrolysis) 및 이온 전도성 세라믹을 이용한 고온 수증기전해(solid-oxide water electrolysis) 등이 있다. 알카라인 수전해는 알칼리 전해액을 사용하여 물을 수소 양이온과 수산화 음이온으로 분리하는 기술로 저가의 비귀금속 촉매를 사용하여 제조 비용을 현격하게 줄여 수소 생산 단가를 혁신적으로 낮출 수 있다는 장점이 있다. 또한 알카라인 수전해는 수전해 방법 중 가장 상용화된 기술로 연구가 오래 진행된 만큼 안정적이라는 장점이 있어 시스템 차원에서 활발히 연구가 진행되고 있다7-10).
Kim 등11)은 하이브리드 시스템 안전성 향상을 위해 국내외 수전해 시스템 기준의 평가 항목을 분석하였고 평가 항목을 토대로 수전해 시스템의 안전성 시험 항목을 도출하였다. 실증 실험을 통해 수전해 시스템의 효율과 발생한 수소의 순도를 측정하였다. Kim 등12)은 수전해 시스템의 수소 생산 효율의 향상을 위해 제작된 rotary magnet holder의 내부 자석의 배치 및 패턴, 회전 속도를 달리하여 수전해 반응의 효율을 향상시키기 위한 연구를 수행하였다. 전류 측정 실험을 통해 전하, 이온의 수송량 및 속도가 증가함을 보였으며 수전해 시스템에서 수소 생산 속도 및 효율 향상에 영향을 끼침을 보였다.
Park 등13)은 알카라인 수전해 시스템의 효율과 발생 수소의 순도 분석 실험을 통해 안전 성능을 분석하였다. 수전해 시스템의 평가 기준을 마련하여 수전해 시스템의 성능과 안전성 확보 방안을 구축하였다. Han 등14)은 알카라인 수전해 스택 내부 전극에서 발생하는 수소 기포의 유동을 수치 해석으로 수행하고 실험을 통해 신뢰성을 검증하는 연구를 진행하였다. 수치 해석을 활용하여 수전해 스택에서 원활한 수소 기포의 배출 및 수전해 효율의 개선을 위한 전극 형상과 유로 구조의 최적화 설계 기법을 제시하였다.
Choi 등15)은 알카라인 수전해용 전극으로 사용하기 위해 시판 중인 3가지 전극(SUS-316, Ni, NiFe)의 특성 평가 연구를 진행하였다. 여러 전해액을 이용하여 특정 전류 밀도 영역에서 전극의 전위를 측정하였으며 전극의 전기화학적 특성 측정 전후의 표면 변화를 측정하여 분석하였다. Koo 등16)은 수전해 시스템의 신뢰성 향상을 위해 시스템 고장 진단 기법을 제시하였다. 시스템을 제어하는 신호를 받아 실시간으로 실험 설정 및 시뮬레이션 모델을 운영하고 이를 바탕으로 시스템의 고장을 진단하는 모델을 개발하였다.
재생 에너지의 출력 제한 및 전력 계통 불안정성 완화를 위한 에너지 저장 시스템으로 상용화된 기술은 알카라인 수전해 방식이 유일하다. 그리고 그린수소를 생산하기 위해서는 많은 시간이 소비되며 각종 데이터를 실시간으로 보면서 저장할 수 있는 프로그램이 필요하다. 이러한 이유로 본 연구에서는 그린수소 생산에 필요한 수전해 장치의 내구성 및 안전 진단, 수소 생산 효율 향상 등 핵심 기술 개발 등을 위해 알카라인 수전해 시스템을 구축하였다. 또한 알카라인 수전해 시스템으로부터 데이터를 전달받아 시스템의 동특성을 모사할 수 있으며 장치 고장 진단을 위해 실시간으로 실험 장치와 시스템 시뮬레이터를 동시에 운용할 수 있는 hardware-in-the-loop simulation (HILS) 프로그램을 개발하였다.
2. 알카라인 수전해 실험 장치 구축
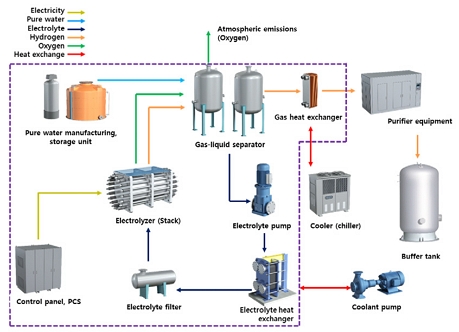
본 연구에서는 그린수소 생산을 위한 알카라인 수전해 시스템의 실험 장치를 구축하였다. Fig. 1은 본 연구에서 고려한 알카라인 수전해 장치의 개념도를 나타낸다. 본 연구에서 구축한 수전해 장치는 알카라인 수전해 방식을 사용하고 있으며 시간당 1 Nm3의 수소 생산 능력을 가지고 있다. 알카라인 수전해 장치는 수소를 생산할 수 있는 주요 부품인 전해조(스택)와 스택의 운용을 위해 사용하는 주변 기기인 balance of plant (BOP)로 구성되어 있다. BOP는 가스 열교환기, 칠러, 기액 분리기, 전해액 펌프, 순수 제조 장치, 순수 저장 탱크, 컨트롤 시스템, 정류기 및 수소 정제 장치 등으로 구성되어 있다. 자세한 알카라인 수전해 시스템의 주요 구성품과 기능은 각각 다음과 같다.
- 1. 전해조(스택): 물 전기 분해를 통해 수소 및 산소 제조.
- 2. 가스 열교환기: 고온의 가스(수소, 산소) 냉각.
- 3. 칠러(냉각기): 가스 열교환기의 냉각수 냉각.
- 4. 기액 분리기: 전해액과 가스(수소, 산소)를 비중차에 의해 분리.
- 5. 전해액 펌프: 기액 분리기에서 나온 전해액 순환.
- 6. 전해액 열교환기: 스택의 열에 의해 가열되는 전해액 냉각.
- 7. 냉각수 펌프: 전해액 열교환기로 냉각수 순환.
- 8. 전해액 필터: 전해액 속 불순물 제거.
- 9. 순수 제조 장치: 유기물, 염분 등을 제거한 순수한 물을 제조.
- 10. 순수 저장 탱크: 생산된 순수를 저장하는 탱크. 저항은 1-10 MΩ.
- 11. 컨트롤 판넬: 전기적 제어를 통해 시스템 관리.
- 12. Power conversion system: 수전해 직류 전원 공급(교류[alternating current] → 직류[direct current]).
- 13. 정제 장치: 수소의 불순물(산소, 수분) 제거.
전해조에서 생산된 산소는 대기 중으로 방출되며 수소는 수소 정제 장치를 통해 99.8% 이상의 순도를 유지한다. 순수 공급 설비는 전해조에서 소모되는 물을 공급하기 위하여 구성되며 상수에 포함된 칼륨, 마그네슘, 칼슘 등의 이온성 물질을 제거하여 순수 상태로 만들어 사용된다. 본 연구에서 구축한 시스템은 전해질로 사용되는 수산화나트륨(KOH) 수용액의 냉각을 위한 설비는 따로 시스템 내에 설치되어 있지 않아 따로 구성해야 할 필요가 있다. 전해조의 발열 반응에 의하여 온도가 상승하는 KOH 수용액의 냉각을 위해 외부 냉각 시스템이 필요하다. Fig. 2는 본 연구에서 구축한 알카라인 수전해 시스템의 실제 모습을 나타낸다.
본 연구에서 구축한 알카라인 수전해 시스템은 약 60℃에서 운전되며 최대 8 bar까지 가압 운전을 할 수 있다. 1 Nm3의 수소를 생산하기 위해서는 전해조에서 5.5 kW/Nm3의 전력을 소모하며 전체 시스템을 구동하기 위해서는 7 kW가 필요하다. 총 설비 효율은 고위 발열량 기준으로 6.7 kW/Nm3이며 상세한 내용은 Table 1에 명시되어 있다.
전력 변환 설비는 국내 전력망에서 공급되는 전력을 가정하여 교류 380 V 3상 4선식 전력을 알카라인 전해조 및 BOP에 공급할 수 있는 설비로 Table 2와 같다. 순수 공급 설비는 전해조에서 요구하는 수질을 맞추기 위해 상수에 포함된 이온 성분을 제거하는 설비이며 생산된 물은 탱크에 저장된 후 펌프에 의해 각 설비로 공급된다. 설비는 카본 필터, 역삼투압법 필터 그리고 이온 교환 수지로 구성되며 역세 과정은 자동으로 이루어져야 한다. 순수 공급 설비에 대한 상세한 설명은 Table 3에 명시되어 있다. 가스 분석기는 발생하는 수소가스 내 산소 함유량과 산소가스 내 수소 함유량을 측정하여 가스 순도에 이상 확인 시 수소를 외부로 방출시키고 시스템이 shut down될 수 있게 구성하여 안정성을 확보한다. Table 4는 가스 분석기의 원리 및 성능을 나타낸다.
3. 시뮬레이션 모델 구축
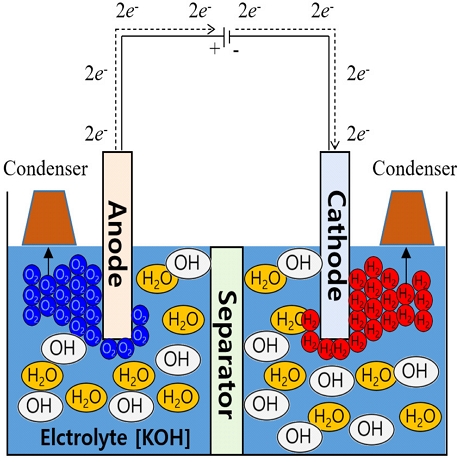
Fig. 3은 본 연구에서 고려한 알카라인 수전해 셀의 모식도를 나타낸다. 수소 스테이션의 동특성을 분석하기 위해 알카라인 수전해 스택의 전기화학적 모델 및 열적 모델의 결합이 필요하다. 기존의 모델은 스택의 정상 상태에 대한 분석이 주류를 이루고 있으며 수전해 시스템의 동적 현상이 스택의 부하에 따른 온도 과도 현상이 지배적인 것을 고려하면 전기화학 반응 모델과 열적 모델이 결합된 동특성 모델의 개발은 매우 중요하다. 알카라인 수전해 시스템에서 일어나는 양극과 음극의 반응은 다음과 같다17).
| (1) |
| (2) |
인가된 전위차(전압)에 의해 수소 이온은 양극 쪽으로 이동하는 반면 수산화 이온은 음극 쪽으로 이동한다. Fig. 4는 본 연구를 통해 개발된 모델이다. 알카라인 수전해 전극에서 생성된 수소 및 산소가스는 전극 표면에 균일하게 분포되어 있으며 체류 시간이 동일하고 음극과 양극의 활성 영역은 동일한 것으로 간주된다. 이는 각 전극에서 전류 밀도가 동일함을 의미한다.
3.1 Anode ancillary
애노드 전극에서는 다음 식과 같이 수산화 이온이 산화되며 산, 전자 그리고 물을 생산한다18,19).
여기서 F는 패러데이 상수이고 I는 셀을 통과하는 전류이다. 전류가 활성화 반응 면적에 걸쳐 일정하게 분포된 것으로 가정하면 다음과 같이 표현할 수 있다.
| (3) |
| (4) |
여기서 , , 는 각각 산소와 물의 양극 입구 및 출구 몰 유량이고 는 양극에서 발생하는 산소의 몰 유량이며 는 양극에서 생산되는 산소의 몰 유량이다.
패러데이의 법칙에 따르면 애노드 쪽의 산소와 물의 몰 유량은 다음과 같다.
| (5) |
| (6) |
| (7) |
여기서 I는 전류 밀도, A는 알카라인 수전해 스택을 구성하는 셀의 활성 영역이다. 양극을 통한 물의 몰 유동은 다음과 같이 표현할 수 있다.
| (8) |
그리고 애노드를 통한 산소의 몰 수는 다음과 같이 표현할 수 있다.
| (9) |
3.2 Cathode ancillary
캐소드 전극에서는 식 (8)과 (9)에 따라 물이 환원되며 양성자와 수산화 이온이 생산된다18,19).
| (10) |
| (11) |
여기서 , , 는 각각 캐소드 입구와 출구에서의 수소와 물의 몰 유량이며 는 캐소드에서 발생한 수소의 몰 유량이고 는 캐소드에서 소비된 물의 몰 유량이다. 패러데이 법칙에 따르면 캐소드 수소의 몰 유량은 다음과 같다.
| (12) |
캐소드 측 물은 수소 생산을 위하여 소비되며 다음과 같이 물의 몰 수를 표현할 수 있다.
| (13) |
캐소드에서 수소와 물의 몰량은 다음과 같이 표현할 수 있다.
| (14) |
| (15) |
3.3 알카라인 수전해 전압 모델
셀 전압은 개회로 전압과 전압 손실 사이의 차에 의해서 구해지며 일반적으로 전류 모드 또는 전압 모드에서 작동한다. 전압 모드로 실행되면 전압이 수전해 시스템에 가해지고 작동 조건에 따라 전류를 끌어온다. 상용화된 대부분의 전해질은 수전해로 유입되는 전류를 제어하여 수소 생산의 안정적인 상태를 제공하는 동시에 전원 공급기에 필요한 작동 전압을 준수하여야 한다. 수전해의 작동 전압은 다음과 같이 표현될 수 있다17-19).
| (16) |
ENernst는 Nernst 전압이고 ηact,a는 연료극 활성화 과전압, ηact,c는 공기극 활성화 과전압이며 ηohmic 은 전해질의 이온 전도성과 전기적 내부 저항에 관련된 옴 저항이다. 스택 내에서 농도 과전압(ηconcentration)은 다공성 전극을 통한 반응 물질에 대한 Stefan-Maxwell 다중성분 질량 이동 방정식으로 표현할 수 있다.
3.4 Nernst 전압
개회로 전압은 온도가 증가함에 따라 감소하고 압력이 증가함에 따라 증가한다. 알카라인 수전해의 경우 개회로 전압은 다음과 같이 Nernst 방정식으로 얻을 수 있다17).
| (17) |
여기서 R, T, F, P는 각각 이상기체 상수, 온도, 페러데이 상수 그리고 압력이다. PH2O와 는 각각 전극 근처의 수소와 산소 가스의 압력과 순수한 물의 증기압이다.
3.5 활성화 과전압
활성화 과전압은 전기화학 운동성을 나타내며 전극 표면에서 일어나는 반응 속도를 나타낸다. 따라서 전극으로 또는 전극으로부터 전자를 전송할 때 인가 전압 일부가 손실된다. 이 과전압은 전극 표면의 음극 및 음극 반응 모두에 대하여 Butlere-Volmer 방정식을 사용하여 전류 밀도 측면에서 설명할 수 있으며 이는 전하 전달 반응의 운동학적 특성을 고려하여 다음과 같이 나타낸다.
| (18) |
| (19) |
| (20) |
여기서 α는 양극과 음극의 charge transfer coefficient이고 i는 전류 밀도이며 io는 양극의 교환 전류 밀도이다. 전극 면적이 동일한 것으로 추정되므로 셀 전류를 보존하는 것은 양극과 음극에서 전류 밀도가 동일함을 의미한다. 유효 교환 전류 밀도는 전극 표면의 온도 및 거칠기 계수에 따라 달라지는데 이는 유효 전극 면적(전기화학)을 기하학적 면적으로 나눈 값으로 정의된다. 기준 온도 및 압력에서의 기준 교환 전류 밀도는 사용 가능한 촉매 표면적에 따라 달라지므로 활성화된 메커니즘을 가정할 때 어떤 온도에서든 유효 교환 전류 밀도를 나타낼 수 있다20,21).
3.6 농도 저항
전극 표면 근처의 반응물 농도 구배로 인해 농도 또는 전위 이상의 확산이 발생하며 이는 발생하는 전기화학적 반응으로 인하여 발생한다. 다공성 전극을 통한 질량 흐름은 일반적으로 확산 현상으로 설명되며 이원 화학에 의해 각각의 종들은 밀도 또는 몰 농도의 관점에서 정량화될 수 있다. 반응물 농도 구배로 인한 전압 손실을 예측하기 위해 Nernst 방정식을 Fick의 법칙과 결합하여 확산 속도를 모델링할 수 있다. 전극-전해질 표면에서의 생산 가스의 몰 농도는 다음과 같이 표현된다22,23).
| (21) |
| (22) |
| (23) |
| (24) |
여기서 , 는 연료극과 공기극에서의 채널 두께를 각각 나타내며 기공의 평균 반지름 을 가지고 있는 다공 매질을 통하여 일어나는 평균 자유 행로(mean free path, )를 가진 분자의 확산은 에 대한 분자 확산과 에 대한 Knudsen 확산에 의하여 일어난다. 특히 이러한 다공층 벽과의 상호작용은 다른 분자들과 충돌하는 것보다 더 자주 일어난다. 대부분의 다공층 구조에서 두 메커니즘은 상당히 중요하다. 따라서 연료극과 공기극에서 일어나는 물의 2항 유효 확산 계수는 다음과 같이 표현될 수 있다.
| (25) |
| (26) |
ε/ξ는 기공의 뒤틀림에 대한 전극 다공성의 비율이고 는 이항 시스템에 대한 유효 분자 확산 계수이며 는 이항 시스템에 대한 유효 분자 확산 계수이다. 그리고 는 물의 유효 Knudsen 확산 계수이다.
가스 분자들이 다공층 벽에 자주 충돌하기 때문에 Knudsen 확산에 대하여 분자들의 이동은 운동 에너지 이론을 적용하여 모델링할 수 있다.
| (27) |
은 기공의 평균 반지름이고 는 물의 분자량이다. 이상기체의 Chapman-Enskog 이론을 이용하여 유효 분자 이항 확산 계수 , 는 다음과 같이 표현될 수 있다.
| (28) |
| (29) |
와 는 수소와 산소의 분자량, , 는 와 의 평균 분자 반지름이며 다음과 같이 표현될 수 있다.
| (30) |
| (31) |
| (32) |
| (33) |
| (34) |
또한 Lennard-Jones 에너지 , 는 다음과 같이 표현될 수 있다.
| (35) |
| (36) |
, , 는 각각 , , 이다. 수소, 산소 물에 대한 Lennard-Jones potentials 는 각각 59.7, 106.7, 809.1 K이다. 결과적으로 농도 손실은 다음과 같이 표현된다.
| (37) |
| (38) |
| (39) |
4. 결과 및 고찰
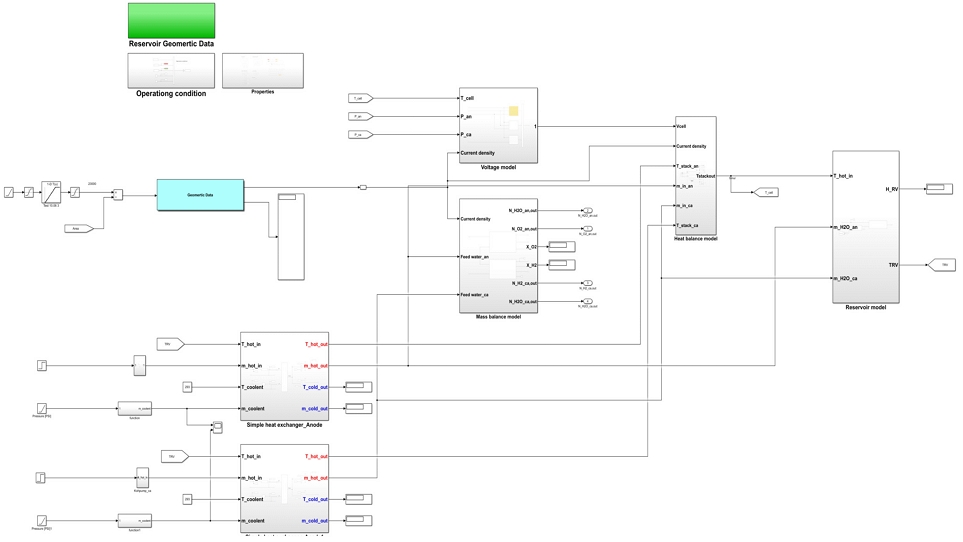
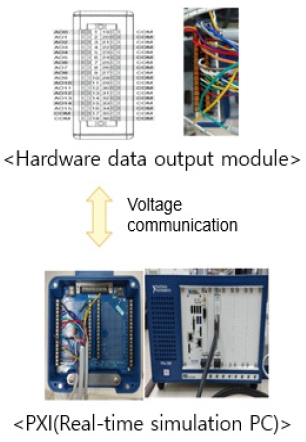
본 연구에서 진행한 HILS는 실제 실험 장치와 시스템의 동특성을 모사할 수 있는 수전해 시스템 시뮬레이터를 연동하여 실시간으로 장비와 시스템 시뮬레이터를 운용하는 것을 의미한다. 본 연구에서는 알카라인 수전해 HILS 시스템 구축을 위해 실제 하드웨어에서 측정되는 센서 및 제어 신호를 외부로 송출하는 아날로그 출력 신호 모듈이다. 아날로그 출력 신호 모듈에서 실제 실험 장치의 제어 신호 및 센서 데이터를 실시간으로 시뮬레이터에 송출하여 동시에 작동한다. 알카라인 수전해 시스템과 시뮬레이터의 통신은 채널 간 통신을 할 수 있도록 연결하였다. 통신은 입력 채널과 출력 채널의 이름을 같게 하여 프로토콜을 통해 값이 이동할 수 있도록 하였다. 또한 수전해 시스템 모델이 배포된 타겟에서 초기값을 설정할 수 있으며 Simulink (Mathworks, Natick, MA, USA)에서 개발된 모델을 개발된 HILS 시스템을 통해 검증할 수 있다.
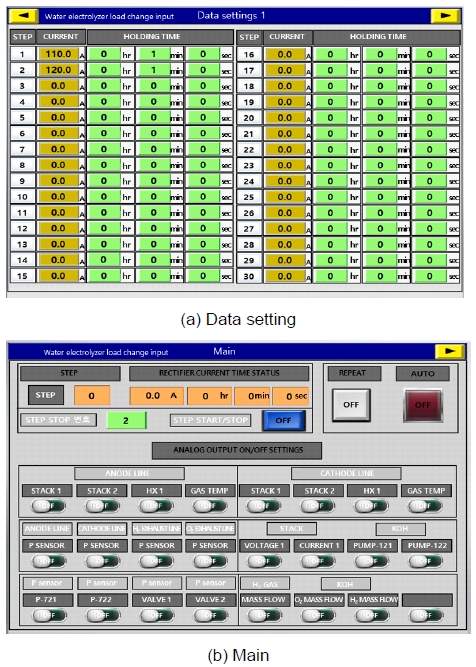
Fig. 5는 수전해 장치의 부하 변동 및 아날로그 출력 신호 모듈의 활성화 프로그램을 나타낸다. 개발된 프로그램을 통해 신재생에너지의 전력 프로파일을 모사할 수 있다. 총 100개의 전류 부하를 입력할 수 있으며 이는 따로 정지 신호가 활성화되기 전까지 반복한다. 아날로그 출력 신호 활성화 프로그램은 실제 실험 장치와 모듈형 계측기(PCI eXtensions for Instrumentation, PXI; National Instruments, Austin, TX, USA)에서 쇼트를 방지하기 위하여 사용된다. 알카라인 수전해 HILS 시스템 구동 시에만 출력 신호를 활성화하여 PXI상에 배포된 모델로 신호가 반입되게 구성되었다. 인터페이스 및 I/O 검증을 위하여 호스트 PC(시뮬레이터)와 타켓 PC (RT-PC) 통신 및 신호 흐름을 설계하였다. 호스트 PC 개발 환경은 수전해 시스템이 개발된 Matlab/SIMULINKⓇ (Mathworks)로 설정하였으며 타겟 PC인 실시간 제어기는 PXI로 설정하였다. 이러한 설정을 통해 본 연구에서는 수전해 시스템의 동특성 모델과 결합하여 HILS 시스템을 구성하였다.
Fig. 6은 수전해 평가 장치 및 PXI 신호 연결 현황을 보여준다. 실제 장치 및 센서와 같은 하드웨어가 모델과 연동되는 것은 각 PC 간의 응답성, 신호 등의 제약을 받게 되는데 이는 아래와 같은 입출력 검증을 통해 해결하였다. 본 연구에서는 이러한 복잡한 시스템을 구성하여 HLIS 기반 실시간 시뮬레이션을 수행함으로써 시스템의 성능 예측이나 전반적인 고장을 진단할 수 있는 시스템을 개발하였다.
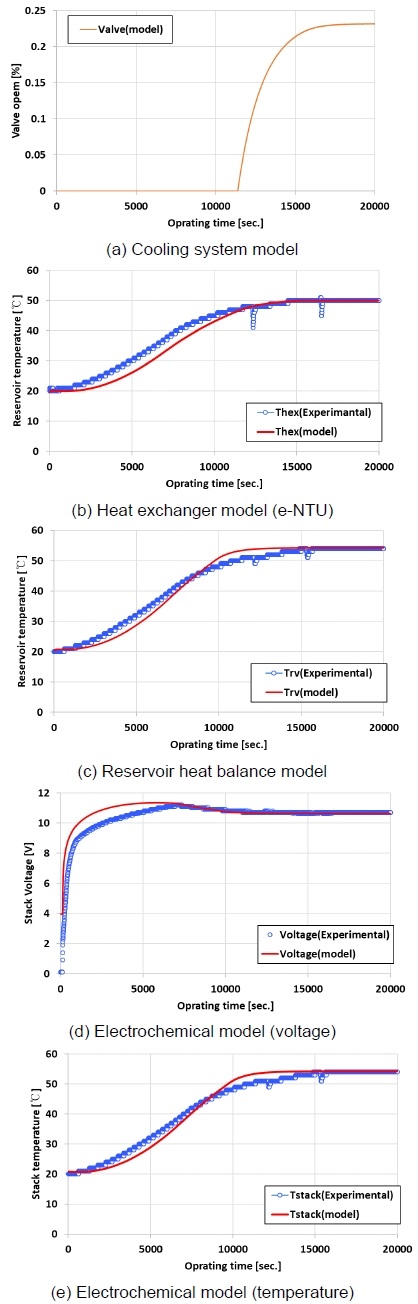
Fig. 7은 개발된 알카라인 수전해 시스템 시뮬레이션 및 실험과의 비교 결과를 나타낸다. 알카라인 수전해 시스템에서 주요한 동적 특성은 수전해 스택의 부하에 따른 발열에 의하여 발생한다. 따라서 주요 구성품인 알카라인 수전해 스택의 모델은 수학적으로 개발하였다. 알카라인 수전해 스택의 구동을 위한 BOP 장치들은 실험 데이터에 의한 경험식을 이용하여 모델링을 수행하였다.
냉각 시스템 모델은 밸브에 적용하여 나타내었으며 실제 실험과의 경향이 유사함을 확인하였다. 또한 열교환기 모델, 레저버 열평형 모델, 전압 및 온도에 대한 전기화학적 모델 등 다양한 수학적 모델을 적용한 알카라인 수전해 시뮬레이션은 실험 결과와 오차 범위에서 매우 잘 일치하였다. 따라서 본 연구에서 수행한 검증 테스트 결과에 따라 알카라인 수전해 시스템의 동특성 시뮬레이션을 적용하여 상태 진단을 하기 위한 분석을 합리적인 정확도로 수행할 수 있다.
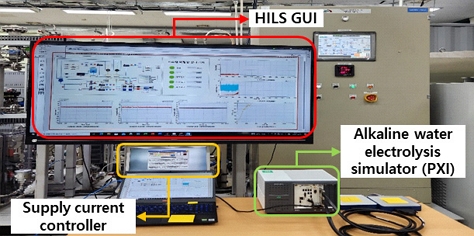
Fig. 8은 HILS 기반 실시간 알카라인 수전해 시스템의 상태 진단 시스템을 보여준다. 본 연구에서 개발된 동특성 시뮬레이션 모델은 PXI에 내장되어 실시간으로 알칼라인 수전해 시스템의 운용 데이터를 수신받아 시스템의 비정상 상태 진단을 수행하였다.
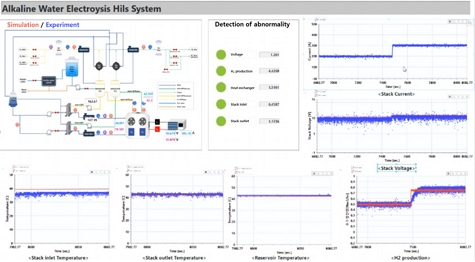
Fig. 9는 알카라인 수전해 시스템의 상태 진단용 시스템의 graphic user interface (GUI)를 보여준다. HILS 기반 실시간 알카라인 수전해 시스템의 상태 진단을 통해 도출할 수 있는 주요 결과는 시스템 성능 분석과 최적화, 고장 예측 및 예방, 동적 응답 평가, 제어 알고리즘 검증, 시스템 모델의 정확도 확인, 안정성 및 신뢰성 평가 그리고 최적 운영 조건 도출 등이 있다. 이를 통해 수전해 시스템의 전반적인 성능을 향상시키고 운영 중 발생할 수 있는 문제를 조기에 감지하여 대응할 수 있으며 장기적인 안정성과 효율성을 높이는 데 기여할 수 있다. Fig. 9와 같이 본 연구에서 구축한 알카라인 수전해 시스템의 운용 데이터를 수신하여 시뮬레이션 결과의 비교 후 잔차 분석을 통해 시스템의 고장 등의 비정상 상태를 실시간으로 감지함을 확인하였다.
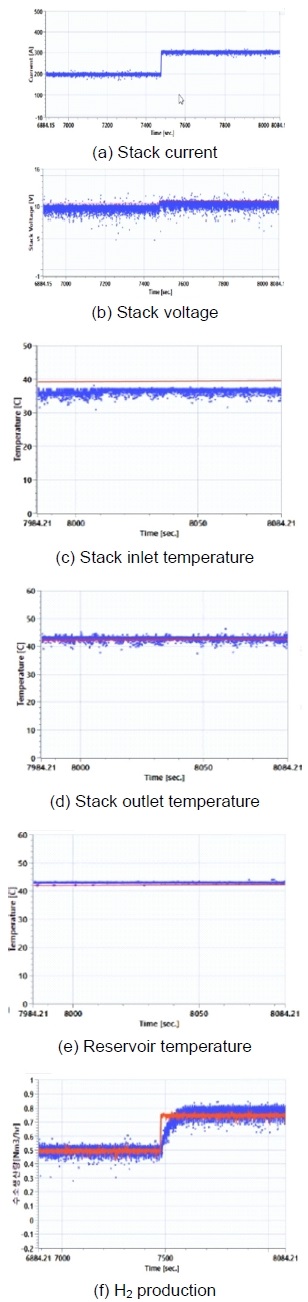
Fig. 10은 본 연구에서 개발한 GUI에서 측정되는 그래프를 확대한 것이다. 본 연구에서 구축한 알카라인 수전해 시스템은 스택의 전류 및 전압, 스택의 입구 및 출구 온도, 레저버 온도 및 수소 생산량 등을 감지하여 측정 데이터의 도출이 가능하며 시뮬레이션 결과와 실시간으로 동시에 비교가 가능하다. 따라서 향후 알카라인 수전해 시스템의 다양한 주요 구성품에서 발생하는 고장 현상들을 고려하여 시스템의 고장 진단 여부와 함께 이를 개선하고 전체 성능을 평가하는 연구 등을 수행할 예정이다.
5. 결 론
본 연구에서는 알카라인 수전해 시스템을 구축하여 시스템으로부터 데이터를 전달받아 동특성 모사 및 고장 진단을 위해 실시간으로 실험 장치와 시스템 시뮬레이터를 동시에 운용할 수 있는 HILS 프로그램을 개발하였다. 본 연구에서는 알카라인 수전해 시스템의 동특성을 분석하기 위하여 스택의 부하에 따른 온도 과도 현상이 지배적인 것을 고려하여 전기화학 반응 모델과 열적 모델이 결합된 동특성 모델의 개발을 수행하였다. 또한 실제 실험 장치와 시스템의 동특성을 모사할 수 있는 수전해 시스템 시뮬레이터를 연동하여 실시간으로 장비와 시스템 시뮬레이터를 운용하기 위한 HILS 시스템을 구성하였다. 다양한 수학적 모델을 적용한 알카라인 수전해 시뮬레이션은 실험 결과와 오차 범위에서 매우 잘 일치하였으며 수전해 시스템의 고장 진단을 하기 위한 분석을 합리적인 정확도로 수행할 수 있음을 알 수 있었다. 본 연구에서는 알카라인 수전해 시스템의 운용 데이터를 수신하여 시뮬레이션 결과의 비교 후 잔차 분석을 통해 시스템의 고장 진단에 대해 실시간으로 비정상 상태를 감지함을 확인하였다.
Acknowledgments
이 연구는 2024년도 정부(과학기술정보통신부)의 재원으로 국가과학기술연구회의 지원을 받아 수행된 한국전기연구원 기본 사업임(No. 24A01070). 이 연구는 2024년도 산업통상자원부 및 산업기술평가관리원(KEIT) 연구비 지원에 의한 연구임(24A02148).
References
-
F. Marangio, M. Santarelli, and M. Calì, “Theoretical model and experimental analysis of a high pressure PEM water electrolyser for hydrogen production”, International Journal of Hydrogen Energy, Vol. 34, No. 3, 2009, pp. 1143-1158.
[https://doi.org/10.1016/j.ijhydene.2008.11.083]

-
S. A. Grigoriev, V. I. Porembsky, and V. N. Fateev, “Pure hydrogen production by PEM electrolysis for hydrogen energy”, International Journal of Hydrogen Energy, Vol. 31, No. 2, 2006, pp. 171-175.
[https://doi.org/10.1016/j.ijhydene.2005.04.038]

-
H. Kojima, K. Nagasawa, N. Todoroki, Y. Ito, T. Matsui, and R. Nakajima, “Influence of renewable energy power fluctuations on water electrolysis for green hydrogen production”, International Journal of Hydrogen Energy, Vol. 48, No. 12, 2023, pp. 4572-4593.
[https://doi.org/10.1016/j.ijhydene.2022.11.018]

-
S. S. Kumar and V. Himabindu, “Hydrogen production by PEM water electrolysis - a review”, Materials Science for Energy Technologies, Vol. 2, No. 3, 2019, pp. 442-454.
[https://doi.org/10.1016/j.mset.2019.03.002]

-
A. Kovač, D. Marciuš, and L. Budin, “Solar hydrogen production via alkaline water electrolysis”, International Journal of Hydrogen Energy, Vol. 44, No. 20, 2019, pp. 9841-9848.
[https://doi.org/10.1016/j.ijhydene.2018.11.007]

-
Y. Yang, B. De La Torre, K. Stewart, L. Lair, N. L. Phan, R. Das, D. Gonzalez, and R. C. Lo, “The scheduling of alkaline water electrolysis for hydrogen production using hybrid energy sources”, Energy Conversion and Management, Vol. 257, 2022, pp. 115408.
[https://doi.org/10.1016/j.enconman.2022.115408]

-
M. El-Shafie, “Hydrogen production by water electrolysis technologies: a review”, Results in Engineering, Vol. 20, 2023, pp. 101426.
[https://doi.org/10.1016/j.rineng.2023.101426]

-
K. Zeng and D. Zhang, “Recent progress in alkaline water electrolysis for hydrogen production and applications”, Progress in Energy and Combustion Science, Vol. 36, No. 3, 2010, pp. 307-326.
[https://doi.org/10.1016/j.pecs.2009.11.002]

-
S. Hu, B. Guo, S. Ding, F. Yang, J. Dang, B. Liu, J. Gu, J. Ma, and M. Ouyang, “A comprehensive review of alkaline water electrolysis mathematical modeling”, Applied Energy, Vol. 327, 2022, pp. 120099.
[https://doi.org/10.1016/j.apenergy.2022.120099]

-
M. H. A. A. da Cruz, M. Etancelin, F. Marias, J. M. Reneaume, S. Sochard-Reneaume, and S. Serra, “Dynamic modelling of an alkaline water electrolysis system and optimization of its operating parameters for hydrogen production”, International Journal of Hydrogen Energy, Vol. 48, No. 35, 2023, pp. 12982-12999.
[https://doi.org/10.1016/j.ijhydene.2022.12.130]

-
J. H. Kim, E. K. Lee, M. W. Kim G. W. Oh, J. W. Lee, and W. S. Kim, “A study on the analysis of safety standard and evaluation of safety performance for the 5 Nm3/hr class alkaline water electrolysis system”, Journal of the Korean Institute of Gas, Vol. 22, No. 6, 2018, pp. 65-75.
[https://doi.org/10.7842/kigas.2018.22.6.65]

-
H. J. Kim H. Guo, and S. Y. Kim, “A study on active ion transport technology to improve water electrolysis system performance”, Journal of Hydrogen and New Energy, Vol. 34, No. 2, 2023, pp. 132-140.
[https://doi.org/10.7316/JHNE.2023.34.2.132]

-
S. A. Park, E. K. Lee, J. W. Lee, S. K. Lee, J. S. Moon, T. W. Kim, and Y. K. Cheon, “A study on performance characteristic and safety of alkaline water electrolysis system”, Journal of Hydrogen and New Energy, Vol. 28, No. 6, 2017, pp. 601-609.
[https://doi.org/10.7316/KHNES.2017.28.6.601]

-
J. Han, Y. Bae, Y. Seo, S. Kim, and Y. Jung, “A study on numerical analysis using the two phase flow in alkaline water electrolysis stacks”, Journal of Hydrogen and New Energy, Vol. 29, No. 2, 2018, pp. 155-162.
[https://doi.org/10.7316/KHNES.2018.29.2.155]

-
H. S. Choi, D. S. Yim, C. H. Rhyu, J. C. Kim, and G. J. Hwang, “Study on the electrode characteristics for the alkaline water electrolysis”, Journal of Hydrogen and New Energy, Vol. 23, No. 2, 2012, pp. 117-124.
[https://doi.org/10.7316/KHNES.2012.23.2.117]

-
T. Koo, R. Ko, D. Ha, and J. Han, “Development of model-based PEM water electrolysis HILS (hardware-in-the-loop simulation) system for state evaluation and fault detection”, Energies, Vol. 16, No. 8, 2023, pp. 3379.
[https://doi.org/10.3390/en16083379]

-
Z. Abdin, C. J. Webb, and E. M. Gray, “PEM fuel cell model and simulation in Matlab–Simulink based on physical parameters”, Energy, Vol. 116, Pt. 1, 2016, pp. 1131-1144.
[https://doi.org/10.1016/j.energy.2016.10.033]

-
D. Jang, W. Choi, H. S. Cho, W. C. Cho, C. H. Kim, and S. Kang, “Numerical modeling and analysis of the temperature effect on the performance of an alkaline water electrolysis system”, Journal of Power Sources, Vol. 506, 2021, pp. 230106.
[https://doi.org/10.1016/j.jpowsour.2021.230106]

-
X. Tang, L. Xiao, C. Yang, J. Lu, and L. Zhuang, “Noble fabrication of Ni-Mo cathod for alkaline water electrolysis and alkaline polymer electrolyte water electrolysis”, International Journal of Hydrogen Energy, Vol. 39, 2014, pp. 3055-3060.
[https://doi.org/10.1016/j.ijhydene.2013.12.053]

-
Y. Qi, B. Huang, and K. T. Chuang, “Dynamic modeling of solid oxide fuel cell: The effect of diffusion and inherent impedance”, Journal of Power Sources, Vol. 150, 2005, pp. 32-47.
[https://doi.org/10.1016/j.jpowsour.2005.02.080]

-
M. Pan, C. Li, J. Liao, H. Lei, C. Pan, X. Meng, and H. Huang, “Design and modeling of PEM fuel cell based on different flow fields”, Energy, Vol. 207, 2020, pp. 118331.
[https://doi.org/10.1016/j.energy.2020.118331]

-
K. Priya, K. Sathishkumar, and N. Rajasekar, “A comprehensive review on parameter estimation techniques for proton exchange membrane fuel cell modelling”, Renewable and Sustainable Energy Reviews, Vol. 93, 2018, pp. 121-144.
[https://doi.org/10.1016/j.rser.2018.05.017]

-
Y. Sahli, H. B. Moussa, and B. Zitouni, “Optimization study of the produced electric power by SOFCs”, International Journal of Hydrogen Energy, Vol. 44, No. 39, 2019, pp. 22445-22454.
[https://doi.org/10.1016/j.ijhydene.2018.08.162]

-
M. D. Lukas, K. Y. Lee, and H. Ghezel-Ayagh, “Development of a stack simulation model for control study on direct reforming molten carbonate fuel cell power plant”, IEEE Transactions on Energy Conversion, Vol. 14, No. 4, 1999, pp. 1651-1657.
[https://doi.org/10.1109/60.815119]

-
M. D. Lukas, K. Y. Lee, and H. Ghezel-Ayagh, “An explicit dynamic model for direct reforming carbonate fuel cell stack”, IEEE Transactions on Energy Conversion, Vol. 16, No. 3, 2001, pp. 289-295.
[https://doi.org/10.1109/60.937210]