암모니아/메탄 예혼합 대향류 대칭 화염에 관한 수치 해석적 연구: Part II 화염의 구조 및 반응 경로 해석
2023 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
Numerical analysis was conducted to confirm the characteristics of extinction behavior in NH3/CH4 counterflow symmetrical flames. Numerical simulations were run on CHEMKIN-PRO, using the OPPDIF code, with Okafor’s mechanisms, which had the lowest error rate compared to Colson's experimental data in the our previous part I study. The chemical interactions of merged flames were examined by analyzing the production rate of major chemical species and key radicals with the volume fractional percentage of ammonia and global strain rate. The interaction phenomenon of the flames could be identified by observing the main chemical reaction path of the merged flames at the stagnation plane.
Keywords:
Symmetric flame, Extinction behavior, Counter flow flame, Ammonia, Interaction키워드:
대칭 화염, 소화거동, 대향류 화염, 암모니아, 상호작용1. 서 론
최근 온실가스 배출로 인한 기후 변화에 대응하기 위해 전 세계적으로 다양한 노력을 기울이고 있다. 그로 인해 지구온난화와 환경 문제의 원인이 되는 온실가스를 감축하기 위해 기존 발전 분야 및 가스터빈 등에서 사용하는 에너지원을 이산화탄소를 배출하지 않는 무탄소 연료 및 신재생에너지로 대체하는 노력이 요구된다1). 이에 따라 무탄소 연료를 활용한 연소 기술 및 연소기 운영 등에 관한 다양한 연구가 진행 중이며, 무탄소 연료로 대체하였을 때 운전 조건의 제약을 극복하고 연소기의 효율적인 운영을 위한 노력이 지속해서 이루어지고 있다2). 대표적인 무탄소 연료로는 수소(H2)와 암모니아(NH3)가 있다. 수소는 탄소를 포함하고 있지 않아 연소 시 이산화탄소를 배출하지 않는 연료 중 하나로 수소 화염의 기초 특성이나 수소 가스터빈 연소 기술 개발 등의 연구가 활발히 진행되고 있다3). 이러한 수소는 부생 수소, 추출 수소, 수전해 등 다양한 방식으로 생산되며, 에너지 공급, 운송, 산업 및 에너지 수출 등 산업 전반에 걸쳐 폭넓은 영향을 끼치고 있다4). 수소는 다른 연료에 비해 넓은 가연 한계를 가지며, 단위 질량 당 발열량이 높아 효율적인 에너지원으로써 장점이 있다5). 그러나 수소의 높은 반응성과 빠른 연소 속도로 인해 역화 및 폭발의 위험이 있으며 대기압 조건에서 수소의 액화 온도가 -253℃이므로 액체 상태로 저장 및 운송하는 데 어려움이 있다6). 이러한 문제점은 암모니아(NH3)를 활용하여 해결할 수 있는데, 암모니아는 수소와 같은 무탄소 연료 중 하나로 낮은 반응성과 높은 자연 발화 온도 특성이 있으나, 수소가 질량 기준 17.8% 포함되어 있어 수소 에너지원의 저장 및 캐리어로 이용이 가능하다7). 또한 암모니아를 가열 및 열분해 공정(크래킹 공정)을 통해 배기가스 배출 없이 친환경적으로 수소와 질소를 얻을 수 있다는 이점이 있다8,9). 그러나 암모니아는 연료로써 매우 낮은 가연 한계를 가지고 있고, 연료 내 질소 성분이 포함되어 있어 NOx 배출량이 많다는 문제점이 있다10). 또한 기존 탄화수소 연료와 비교하면 연소 속도가 낮아 연소 성능이 떨어지는 단점이 있다. 이러한 낮은 연소 성능을 개선하기 위해서 암모니아와 수소나 메탄 등 다른 연료를 혼합하여 연소시키는 방법이 고려되었다11-13). 암모니아가 주요 무탄소 에너지원으로써 자리매김하기 위해서는 다른 연료와 혼합하여 연소(co-firing) 시 연소 특성에 대한 파악이 필요하다. Lhuillier 등14)은 암모니아에 수소를 혼합하여 수소의 혼합률에 따른 연소 성능 및 효율에 대하여 파악하였으며, Richter 등15)은 암모니아 크래킹 공정을 통해 얻은 NH3/H2/N2 혼합 연료를 이용하여 대향류 예혼합 화염에서의 소화거동 특성을 파악하였다. 본 연구에서는 대향류 반응장에서 생성되는 메탄/암모니아 예혼합 화염의 소화거동과 화염의 구조를 파악하여 화염의 상호작용 특성을 연구하고자 한다. 대향류 화염에서 생성되는 평면 화염은 일차원적으로 해석이 용이하여 화염 구조 및 소화거동의 특성을 연구하는 데 많이 이용된다. Ishizuka와 Law16)는 메탄(CH4), 프로판(C3H8) 연료를 이용하여 대향류 예혼합 화염에서 화염의 스트레치에 따른 소화거동 및 가연 한계 특성을 파악하였다. 대향류 화염의 구조 및 소화거동에 영향을 미치는 인자로는 크게 유동장의 영향, 화염의 열 손실(heat loss), 연료의 선호 확산(preferential diffusion) 등이 있다17). 유동장의 영향은 화염의 신장률로 정의할 수 있는데, 상하 노즐 간의 거리와 노즐 출구 속도로 정의되는 신장률은 대향류 화염의 구조와 소화거동의 특성을 제어한다18,19). 화염의 소화거동은 열 확산도(thermal diffusivity, α)와 질량 확산도(mass diffusivity, Di)의 비로 정의되는 루이스 수(Lewis number, Le)가 중요한 인자로 작용하는데, 루이스 수의 경향에 따라 화염 간의 상호작용 강도에 차이를 보인다. Le>1인 경우 열 확산도(α)가 질량 확산도(Di)에 비해 크기 때문에 두 화염이 정체면(stagnation plane, SP)으로부터 일정한 거리를 가지며 화염 간의 상호작용이 약하게 나타나고, Le<1인 경우 질량 확산도(Di)가 열 확산도(α)에 비해 크기 때문에 화염이 SP 근처에서 발생하며 화염 간의 상호작용이 증가하는 것으로 알려져 있다.
본 연구에서는 이전 연구20)에서 논의한 암모니아/메탄 예혼합 대향류 화염의 소화거동 특성에 연이어 주요 화학종, 핵심 활성기의 생성률을 관찰하고, 주요 화학반응을 통해 화염의 구조 및 반응 경로를 해석하여 화염의 상호작용 및 소화 체계를 더 세밀하게 분석하고자 한다.
2. 수치해석 방법 및 조건
2.1 수치해석 모델
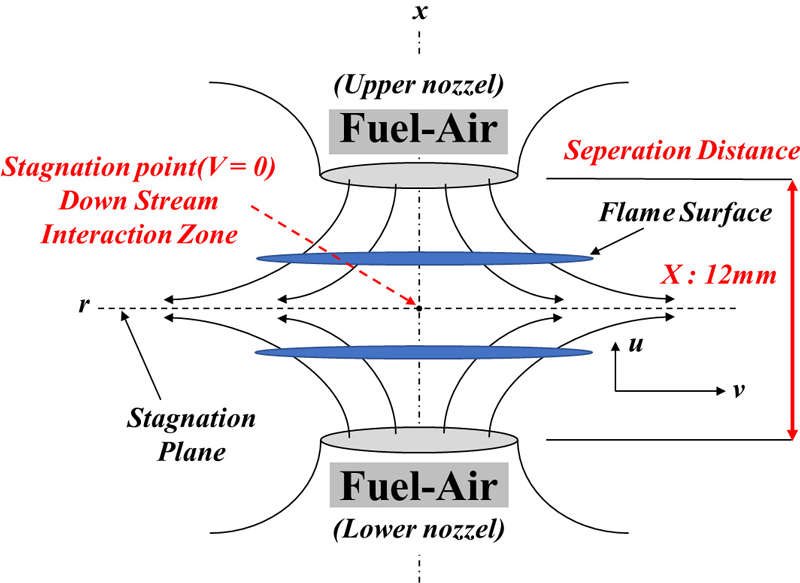
본 연구에서 대향류 화염 사이의 후류 상호작용을 수치상으로 해석하기 위해 ANSYS Chemkin Pro (ANSYS, Canonsburg, PA, USA)의 OPPDIF code를 이용하여 화학적 상호작용에 대한 계산을 진행하였다. 수치해석 시 사용된 대향류 화염의 형상을 Fig. 1에 나타내었다. OPPDIF code는 대향류 유동장에서 SP 주위 유동의 상사성(similarity)을 이용하여 화염의 구조를 일차원으로 가정함으로써 수학적으로 간단하게 해석할 수 있으며, Kee 등21)에 의해 개발되었고 Lutz 등22)에 의해 확장되었다. 수치해석 시 주위 조건은 1 atm, 298 K로 고정하였으며, 노즐 간의 거리는 12 mm로 설정하였다. 화염 간의 상호작용 현상을 세밀하게 관찰하기 위하여 격자(grid)는 600개 이상으로 설정하여 계산을 진행하였다23). 또한 실제 화염과 근접하게 모사하기 위하여 광학적으로 얇은 모델(optical thin model)을 적용하여 화염의 복사열 손실을 고려하였다23). 정확한 수치해석을 위해 이전 연구20)에서는 Colson 등24)이 수행한 암모니아/메탄 예혼합 연료의 실험적 소화경계와 다양한 화학 반응 기구들을 비교하여 가장 적은 오차율을 가진 Okafor’s mechanism25)을 선정하여 수치해석을 진행하였다. 이에 본 연구에서도 동일한 반응 기구를 사용하여 계산을 수행하였다.
2.2 주요 변수 정의
예혼합 대향류 화염에서 암모니아/메탄의 혼합률은 연료별 저위 발열량을 고려하여 열량비(heating value ratio, ENH3)로 정의하였으며, 이를 식 (1)에 나타내었다. 여기서 LHV는 연료별 저위 발열량(lower heating value)을 의미하며, 메탄과 암모니아의 LHV 값은 각각 802.30, 316.84 kJ/mol이다. 본 연구에서 열량비는 Colson 등24)이 보고한 연구와 동일하게 ENH3=15% 조건으로 선정하였다.
| (1) |
소화거동의 주요 변수 조건인 전체 신장률(global strain rate, ag)과 암모니아의 체적 분율(volume fractional percentage of NH3, ΩNH3)은 각각 식 (2)와 (3)을 통하여 정의하였다.
| (2) |
| (3) |
식 (2)에서 V는 상하부 각 노즐의 출구에서 분사되는 혼합물의 축 방향 속도(axial velocity), X는 상하부 노즐 간의 거리로 본 연구에서는 12 mm로 설정하였다. 이 경우 하첨자 U, L은 각각 상부 노즐(upper nozzle)과 하부 노즐(lower nozzle)을 의미한다. 식 (3)에서 Yi는 화학종 i의 몰분율을 나타내며, 암모니아의 ΩNH3은 전체 화학종의 몰수와 NH3의 몰분율(YNH3)의 비로 나타내었다. 또한 예혼합 화염에서 암모니아/메탄의 연료 혼합물의 반응식은 식 (4)로 정의한다.
| (4) |
그리고 본 연구의 수치해석에 사용된 메탄/암모니아의 혼합률 및 전체 신장률의 조건들을 Table 1에 정리하여 나타내었다.
3. 결과 및 고찰
3.1 소화지점 내 주요 화학종과 핵심 활성기 거동
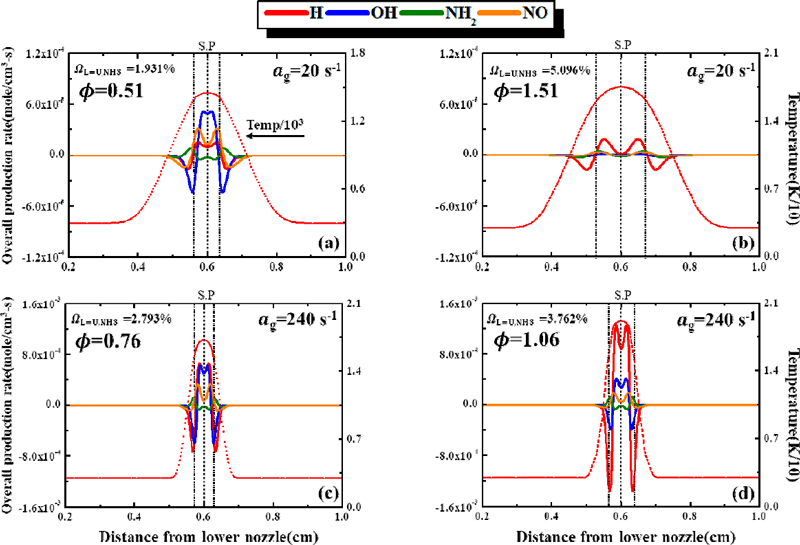
이전 연구20)에서는 루이스 수의 정의를 통해 희박조건과 과농 조건의 차이를 구분하고, 암모니아의 ΩNH3와 신장률에 따른 소화거동 시 화염의 위치, OH 활성기의 생성률 등을 통해 화염의 상호작용 및 병합 현상을 확인하였다. 이러한 현상들을 통해 화염의 희박 조건과 과농 조건에서 소화거동이 각각 상이하게 나타나는 것을 확인하였고, 소화거동에 영향을 미치는 주요 변수인 암모니아의 ΩNH3와 화염의 신장률에 따른 경향을 파악하여 상호작용의 현상을 분석하였다. 그러나 이 현상들만으로 병합 화염에서 일어나는 화학 반응적 상호작용의 메커니즘을 파악하기에는 다소 부족하다고 판단된다. 따라서 본 연구에서 소화지점 내 화염의 주요 화학종과 핵심 활성기의 생성을 비교하고 반응 경로를 통해 화염의 상호작용 메커니즘을 파악하고자 한다. Fig. 2는 이전 연구20)에서 관찰된 소화지점 내 신장률(ag)이 20, 240/s일 때 희박 및 과농 조건에 따른 화염의 주요 화학종(major species)의 생성률과 온도를 나타내었다. 조건은 당량비(equivalence ratio, ϕ) 1에 해당하는 ΩNH3=3.573%를 기준으로 희박 및 과농 조건에 따른 화염의 소화거동 특성을 분석하였다. 이 경우 희박 조건과 과농 조건의 ΩNH3은 이전 연구20)에서 작성한 안정화 선도 내 희박 소화경계(lean extinction boundary)와 과농 소화경계(rich extinction boundary)에서 소화지점에 해당하는 ΩNH3이다. 따라서 대향류 화염의 상세한 화학 반응적 상호작용을 파악하기 위해서는 암모니아/메탄 예혼합 화염의 소화지점 내 주요 화학종의 생성 반응을 확인해 볼 필요가 있다.
Overall production rate for major species. (a) Lean case, (b) rich case for αg=20/s, and (c) lean case, (d) rich case for αg=240/s
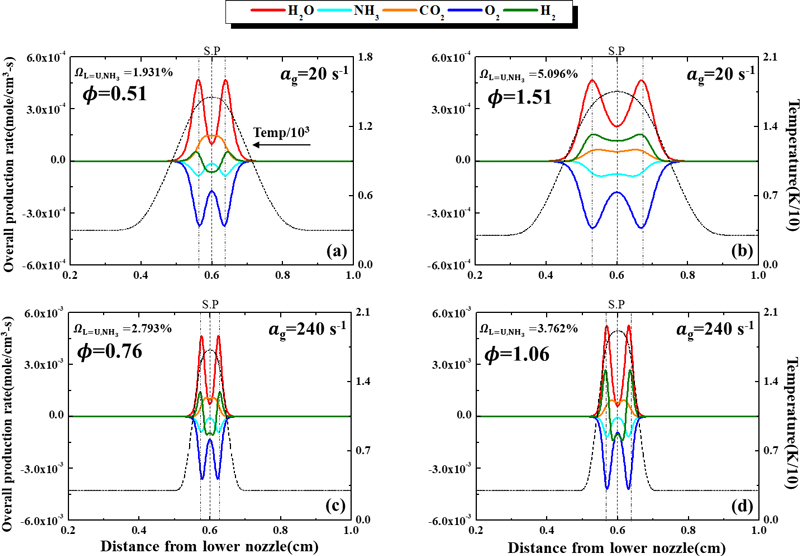
Fig. 2에서 화염대 위치는 열 방출량(heat prodcution rate, HPR)이 가장 높은 지점으로 정의되며 점선으로 표시하였다. 이 경우 보이는 것과 같이 점선의 위치가 H2O가 최대로 생성하는 지점과 거의 일치하는 것처럼 나타났는데, H2O의 생성과 HPR의 관계를 파악하기 위해 상하부 두 화염의 화염대와 H2O가 최대로 생성되는 지점의 오차율을 비교하였다. Fig. 2(a), (b)의 신장률 ag=20/s조건에서 화염대와 H2O의 최대 생성 지점 간의 거리 차이는 각각 희박 조건에서는 0 mm, 과농 조건에서는 0.12 mm이며, 0%, 0.3%의 오차를 가진다. Fig. 2(c), (d)의 ag=240/s 조건에서는 화염대와 H2O의 최대 생성 지점 간의 거리 차이는 희박 조건에서는 0.08 mm, 과농 조건에서는 0.1 mm로 두 조건 모두 1.4%의 오차를 보였다. 이처럼 두 신장률의 희박 조건과 과농 조건 모두에서 매우 작은 오차를 보여 H2O의 최대 생성 지점과 화염대가 거의 일치하고 있음을 파악하였다. 이를 통해 H2O의 생성이 화염의 열 방출을 만들어 내는 화학 반응식에서 주요한 화학종이라는 것을 알 수 있었다. 한편 NH3/air 및 NH3/CH4/air 조건의 선행 연구에서는 H2O를 생성하는 반응식인 NH3+OH <=> NH2+H2O가 열 방출에 주요한 영향을 끼친다고 보고된 바 있다24,26). 따라서 Fig. 2의 NH3, O2또한 H2O의 최대 생성 지점에서 가장 많이 소모되는 것을 확인할 수 있다. Fig. 2(a), (b)의 ag=20/s인 경우, 상하부 두 화염의 H2O 최대 생성 지점 간의 거리가 희박 조건(ϕ=0.51)에서 과농 조건(ϕ=1.51)보다 더 좁아 희박 조건일 때는 정체점 근처에서 화학 반응이 활발하게 일어나는 것을 알 수 있으며, 과농 조건에서는 두 화염 간에 일정한 거리를 두는 것을 알 수 있다. 반면에, Fig. 2(c), (d)의 ag=240/s의 경우, 희박 조건(ϕ=0.76), 과농 조건(ϕ=1.06)과 상관없이 두 화염이 정체점 근처에서 주요 화학종들의 생성과 소모 반응이 활발하게 일어나는 것을 확인할 수 있다. 또 다른 주요 화학종인 H2의 생성률을 보면 화염대 이전부터 증가하는 것을 볼 수 있는데, 이는 CH4가 저온 산화 반응인 CH4 -> CH3 -> CH2O -> HCO -> H2 반응을 통하여 화염대 이전에서 H2가 생성되기 때문으로 이해된다26). 전체적으로 H2의 생성률은 화염대에 가까워질수록 계속 증가하다가 최댓값을 보인 후 정체점에 가까워질수록 감소하는 경향을 보인다. 그러나 Fig. 2(b)의 경우 H2는 정체점에서도 계속 생성률이 양의 값을 유지하는 것으로 나타났다. 화염대 직후에서 Fig. 2(b)에서만 H2의 생성 반응이 일어나는 것에 대해서는 이후 3.2절에서 주요 화학 반응 경로의 반응식을 분석하여 현상을 명확히 규명할 것이다. 이처럼 Fig. 2에서 나타난 주요 화학종들의 생성률을 통해 화염대 내에서 일어나는 화학반응의 척도를 파악할 수 있었다. 그리고 주요 화학종들의 생성률에 대한 메커니즘을 파악하기 위해 화학적 반응을 촉발하는 핵심 활성기의 생성률을 관찰하여 암모니아/메탄 혼합 연료의 대향류 병합 화염 내에서 일어나는 화염의 상호작용을 분석하였다.
일반적으로 연소 반응에서 OH, H 활성기는 화학반응 내 생성되는 중간 생성물로 대부분의 화염에서 포함되어 화학적 상호작용에 관여하며, 연료의 산화 반응을 촉진한다. 따라서 암모니아가 연료로 혼합된 본 연구에서는 OH, H 활성기 외에 암모니아 연소의 주요 화학 반응식인 NH3+OH <=> NH2+H2O, NH2+NO <=> N2+H2O 등에서 화학종들의 생성과 소모 반응을 일으키는 암모니아 산화 반응과 관련된 NH2, NO 활성기가 화염의 상호작용에 기여하는 메커니즘을 파악할 필요가 있다. Fig. 3은 본 연구에서의 핵심 활성기의 생성률을 보여주고 있다. 암모니아 연소에서 NO 활성기 생성 반응은 암모니아 연소에서 점화 지연 시간, 소화거동, 층류 연소 속도 등에 영향을 주는 것으로 보고되었다24). 또한 NH2 활성기는 화염의 후류 내 NH3 산화 반응에서 주요하게 생성되는 활성기로 화염의 반응 영역에서 NH 활성기나 다른 중간 생성물들의 생성 반응을 촉진하여 N2의 형성을 이끄는 것으로 알려져 있다27). Fig. 3에서 먼저 화염 전체 반응물의 척도인 OH 활성기의 생성률을 살펴보면 Fig. 3(a), (b)의 신장률이 낮은 경우 Fig. 3(b)의 과농 조건에서 Fig. 3(a)의 희박 조건보다 매우 낮은 생성률을 가진다. 이는 과농 조건에서는 OH 활성기 간 공유가 활발하지 않아 화염 간에 상호작용이 약해져 소화하는 것으로 사료된다. Fig. 3(c), (d)의 신장률이 낮은 경우도 과농 조건에서 희박 조건보다 더 낮은 OH 활성기 생성률을 보였다. 그러나 낮은 신장률과 비교하면 희박 조건, 과농 조건의 생성률 차이는 크지 않음을 볼 수 있다. 이는 높은 신장률 조건에서는 화염의 높은 스트레치에 의해 희박, 과농 조건에 상관없이 화염이 정체점 근처에서 화염 간의 활성기 공유로 생성률을 유지하기 때문인 것으로 이해된다. NO 활성기의 생성률인 경우 신장률 ag=20, 240/s 두 경우 모두 과농 조건보다 희박 조건에서 생성 반응과 소모 반응이 더 활발히 일어나는 것을 확인할 수 있었다. 특히 낮은 신장률 과농 조건에서는 다른 조건에 비해 낮은 생성률의 값을 가지는 것을 알 수 있다. NH2의 생성률은 화염대 근처에서 최댓값을 가지는데, NH3+OH <=> NH2+H2O의 반응식에서 NH3의 소모로 인하여 NH2가 형성되기 때문인 것으로 파악되었다. 이는 Fig. 2의 NH3의 소모율의 경향과 동일하게 나타났다. 이에 비해 H 활성기는 이전 활성기들과는 반대로 과농 조건에서 더 활발히 생성되는 것으로 분석되었다.
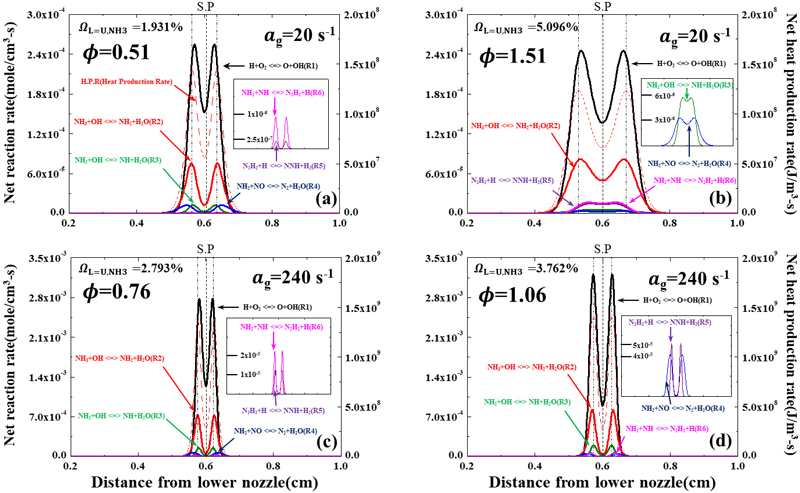
3.2 소화지점 내 화학 반응 경로
지금까지 주요 화학종과 핵심 반응기들의 생성률을 비교하여 화염의 상호작용 특성을 파악하였다. 즉, 화염의 상세 화학적 상호작용에 영향을 미치는 활성기의 생성 반응을 통해서 화염의 반응 척도를 확인할 수 있었다. 그러나 이런 핵심 활성기들이 생성하는 주요 화학적 메커니즘에 대해서는 파악되지 않아 주요 화학종과 핵심 활성기의 주요 반응 경로를 관찰하여 상호작용에 대해 더 검토해 볼 필요성이 있다. Fig. 4는 앞에서의 각 4가지 조건 내 암모니아 연소에서 주요한 화학 반응 경로를 보여주고 있다. 이때 화염대 영역은 HPR이 최대가 되는 지점으로 정의하였으며, 이를 점선으로 표기하였다. Fig. 4 내 화학 반응식은 화염 내 OH 활성기의 생성을 지배하는 반응식인 H+O2 <=> O+OH (R1)과 NH3/air 연소에서 각각 희박 조건과 과농 조건에서 열 방출에 주요한 영향을 미치는 반응식 R2, R3, R4, R5, R6을 보여주고 있다. 이들 반응 결과를 통해서 H+O2<=> O+OH (R1) 반응이 지배적인 반응식으로 작용하고 있는 것을 알 수 있다. 이러한 거동은 Fig. 3에서 H의 최대 소모 지점과 비교하였을 때 R1 반응과 경향이 거의 일치하는 것을 확인할 수 있다. Fig. 3의 화염대 이전에 NO 활성기의 소모율과 Fig. 4의 같은 지점에서 NH2+NO <=> N2+H2O (R4) 반응 경로를 통해 NH2가 NO를 소모하는 데 영향을 미치는 것으로 확인된다. 이는 Fig. 3에서 화염대 이전의 NO 소모율의 경향과 비슷하게 나타난다. 또한 NH2의 생성 반응은 NH3+OH <=> NH2+H2O (R2) 반응 경로를 통해 영향을 받고 있음을 알 수 있다. NH2+OH <=> NH+H2O (R3) 반응식도 R2와 마찬가지로 OH 활성기와 반응을 하여 NH2의 산화 과정을 통해 NH 활성기의 생성을 유도하고 있음을 볼 수 있다. ag=20/s과농 조건에서는 R3 반응에 의한 NH2 소모율이 다른 조건에 비해 낮은 값을 가지는데, 이를 통해 화염대 내에서 NH2 활성기와 OH 활성기 간의 화학적 공유가 적어 화염 간의 약한 상호작용이 나타나는 것으로 해석할 수 있다. ag=240/s에서는 높은 스트레치로 인해 희박 조건, 과농 조건 둘 다 활성기 간의 활발한 공유로 R3 반응에 의한 NH2 소모율이 일정값에 도달한 후 정체점에 가까워지면서 0에 수렴하는 것을 알 수 있다. 희박 조건에서는 불완전 연소로 활성기들 간의 추가 화학 반응이 일어나며 정체점 근처에서 소화하고, 과농 조건에서는 완전 연소 후 활성기들 간의 약한 상호작용으로 화염이 정체점에서 일정한 거리를 유지하며 소화하게 된다. 그러나 신장률이 높을 때는 화염의 스트레치로 인해 과농 조건에도 불구하고 활성기들 간의 공유가 활발한 것을 파악할 수 있었다. 마지막으로 N2H2+H <=> NNH+H2(R5), NH2+NH <=> N2H2+H (R6) 반응들은 희박 조건보다 과농 조건에서 활발히 반응하는 반응식으로 낮은 신장률의 과농 조건에서는 정체점에서 둘 다 생성률이 약간 증가하다가 평면으로 유지되는 것으로 확인되었다. 이를 통해 낮은 신장률의 과농 조건에서 R5 반응을 통해 H2를 생성하며, Fig. 2의 낮은 신장률 과농 조건의 정체점에서 H2의 생성률이 양의 값을 유지하는 현상에 대해서 이해할 수 있었다.
4. 결 론
본 연구에서 NH3/CH4 대향류 예혼합 화염의 소화거동 특성과 화염의 구조를 ANSYS Chemkin Pro의 OPPDIF-code를 사용하여 대향류 반응장의 예혼합 화염을 모사하여 후류 상호작용에 대해 파악하였다. 소화 신장률에 영향을 미치는 대표적인 변수로 ΩNH3과 상하 노즐 간의 거리와 노즐 출구 속도로 정의되는 화염 신장률에 따른 화염 내 주요 화학종, 핵심 활성기와 화학 반응 경로를 수치해석하여 다음과 같은 결론을 얻었다.
1) 주요 화학종의 생성 반응을 관찰하였는데, 가장 높은 열 발생량을 갖는 지점을 화염대로 정의하였으며, H2O의 생성률이 최대인 지점과 거의 일치하는 것을 확인하였다. NH3와 O2 또한 화염대에서 소모율이 가장 높게 나타났다. H2 생성률을 보면 화염대 이전에서 저온 산화반응을 통해 H2의 생성률이 증가하는 것을 관찰할 수 있었다.
2) 화학 반응에 기여하는 핵심 활성기 OH, H, NO, NH2의 생성 반응을 분석하였으며, 점화 발달과 소화거동에 주요한 영향을 미치고 있는 NO 활성기도 분석하였다. 화염대 이전에서 NO의 생성률이 음의 값을 보이는데, 이는 NH2+NO <=> N2+H2O (R4) 반응 경로의 생성 반응을 통한 영향으로 보이며, 높은 신장률에서는 OH 활성기와 함께 병합 화염 내에서 활성기 간의 공유를 통해 상호작용이 이루어지는 것을 확인하였다. 이때 NH2의 생성률은 NH3+OH <=> NH2+H2O (R2) 반응 경로의 생성 반응에 지배적으로 영향을 받는 것으로 분석되었다.
3) 암모니아 연소에서 열 방출에 주요한 영향을 끼치는 반응 경로인 NH3+OH <=> NH2+H2O (R2), NH2+OH <=> NH+H2O (R3) 등을 살펴보았다. 화염대 영역의 주요 화학 반응식을 관찰하고 4가지 조건에서 화염의 상호작용을 세부적으로 관찰하였는데, R2와 R3 반응에서 OH 활성기에 의한 산화반응으로 대부분의 열 방출이 발생하며 활성기의 생성을 유도하는 것으로 나타났다. R4 반응의 경우 높은 신장률 조건보다 낮은 신장률 조건에서의 생성률이 더 활발하며 NO의 소모율이 증가하게 되는데, 이로 인해 높은 신장률일 때 화염대 직전의 NO 소모율이 낮은 신장률일 때보다 낮은 것으로 파악되었다.
Acknowledgments
본 연구는 2023년도 정부(산업통상자원부)의 재원으로 한국에너지기술평가원의 지원을 받아 수행된 연구입니다(20206710100060, 분산발전 가스터빈용 수소전소 저 NOx 연소기 개발). 본 연구는 산업통상자원부(MOTIE)와 한국산업기술평가관리원의 지원을 받아 수행한 연구 과제이며 이에 감사드립니다(RS-2022-00155547).
References
-
R. Banihabib and M. Assadi, “A hydrogen-fueled micro gas turbine unit for carbon-free heat and power generation”, Sustainability, Vol. 14, No. 20, 2022, pp. 13305.
[https://doi.org/10.3390/su142013305]

-
H. L. Yip, A. Srna, A. C. Y. Yuen, S. Kook, R. A. Taylor, G. H. Yeoh, P. R. Medwell, and Q. N. Chan, “A review of hydrogen direct injection for internal combustion engines: towards carbon-free combustion”, Applied Sciences, Vol. 9, No. 22, 2019, pp. 4842.
[https://doi.org/10.3390/app9224842]

-
H. H. W. Funke, N. Beckmann, and S. Abanteriba, “An overview on dry low NOx micromix combustor development for hydrogen-rich gas turbine applications”, International Journal of Hydrogen Energy, Vol. 44, No. 13, 2019, pp. 6978-6990.
[https://doi.org/10.1016/j.ijhydene.2019.01.161]

-
F. Dawood, M. Anda, and G. M. Shafiullah, “Hydrogen production for energy: an overview”, International Journal of Hydrogen Energy, Vol. 45, No. 7, 2020, pp. 3847-3869.
[https://doi.org/10.1016/j.ijhydene.2019.12.059]

-
S. Verhelst and T. Wallner, “Hydrogen-fueled internal combustion engines”, Progress in Energy and Combustion Science, Vol. 35, No. 6, 2009, pp. 490-527.
[https://doi.org/10.1016/j.pecs.2009.08.001]

-
J. Jeon and S. J. Kim, “Recent progress in hydrogen flammability prediction for the safe energy systems”, Energies, Vol. 13, No. 23, pp. 6263.
[https://doi.org/10.3390/en13236263]

-
Z. Wan, Y. Tao, J. Shao, Y. Zhang, and H. You, “Ammonia as an effective hydrogen carrier and a clean fuel for solid oxide fuel cells”, Energy Conversion and Management, Vol. 228, 2021, pp. 113729.
[https://doi.org/10.1016/j.enconman.2020.113729]

-
B. Mei, J. Zhang, X. Shi, Z. Xi, and Y. Li, “Enhancement of ammonia combustion with partial fuel cracking strategy: laminar flame propagation and kinetic modeling investigation of NH3/H2/N2/air mixtures up to 10 atm”, Combustion and Flame, Vol. 231, 2021, pp. 111472.
[https://doi.org/10.1016/j.combustflame.2021.111472]

-
S. Lee, Y. Choi, C. Park, H. Kim, Y. D. Lee, and Y. S. Kim, “A study on ammonia reforming catalyst and reactor design for 10 kW class ammonia-hydrogen dual-fuel engine”, Journal of Hydrogen and New Energy, Vol. 31, No. 4, 2020, pp. 372-379.
[https://doi.org/10.7316/KHNES.2020.31.4.372]

-
H. Kobayashi, A. Hayakawa, K. D. K. A. Somarathne, and E. C. Okafor, “Science and technology of ammonia combustion”, Proceedings of the Combustion Institute, Vol. 37, No. 1, 2019, pp. 109-133.
[https://doi.org/10.1016/j.proci.2018.09.029]

-
W. S. Chai, Y. Bao, P. Jin, G. Tang, and L. Zhou, “A review on ammonia, ammonia-hydrogen and ammonia-methane fuels”, Renewable and Sustainable Energy Reviews, Vol. 147, 2021, pp. 111254.
[https://doi.org/10.1016/j.rser.2021.111254]

-
H. Xiao, M. Howard, A. Valera-Medina, S. Dooley, and P. J. Bowen, “Study on reduced chemical mechanisms of ammonia/methane combustion under gas turbine conditions”, Energy & Fuels, Vol. 30, No. 10, 2016, pp. 8701-8710.
[https://doi.org/10.1021/acs.energyfuels.6b01556]

-
G. B. Ariemma, G. Sorrentino, R. Ragucci, M. de Joannon b, and P. Sabia, “Ammonia/methane combustion: stability and NOx emissions”, Combustion and Flame, Vol. 241, 2022, pp. 112071.
[https://doi.org/10.1016/j.combustflame.2022.112071]

-
C. Lhuillier, P. Brequigny, F. Contino, and C. Mounaïm-Rousselle, “Experimental study on ammonia/hydrogen/air combustion in spark ignition engine conditions”, Fuel, Vol. 269, 2020, pp. 117448.
[https://doi.org/10.1016/j.fuel.2020.117448]

-
M. Richter, R. Schultheis, J. R. Dawson, A. Gruber, R. S. Barlow, A. Dreizler, and D. Geyer, “Extinction strain rates of premixed ammonia/hydrogen/nitrogen-air counterflow flames”, Proceedings of the Combustion Institute, Vol. 39, No. 2, 2023, pp. 2027-2035.
[https://doi.org/10.1016/j.proci.2022.09.011]

-
S. Ishizuka and C. K. Law, “An experimental study on extinction and stability of stretched premixed flames”, Symposium (International) on Combustion, Vol. 19, No. 1, 1982, pp. 327-335.
[https://doi.org/10.1016/S0082-0784(82)80204-X]

-
S. K. Choi, E. S. Cho, and S. H. Chung, “Quantification of extinction mechanism in counterflow premixed flames”, Journal of Mechanical Science and Technology, Vol. 28, No. 9, 2014, pp. 3863-3871.
[https://doi.org/10.1007/s12206-014-0850-7]

-
C. J. Sung, J. B. Liu, and C. K. Law, “Structural response of counterflow diffusion flames to strain rate variations”, Combustion and Flame, Vol. 102, No. 4, 1995, pp. 481-492.
[https://doi.org/10.1016/0010-2180(95)00041-4]

-
H. G. Im, C. K. Law, J. S. Kim, and F. A. Williams, “Response of counterflow diffusion flames to oscillating strain rates”, Combustion and Flame, Vol. 100, No. 1-2, 1995, pp. 21-30.
[https://doi.org/10.1016/0010-2180(94)00059-2]

-
E. Jin and K. Lee, “Numerical study on the NH3/CH4 symmetric premixed counterflow flames: part I characteristics of extinction behavior”, Journal of Hydrogen and New Energy, Vol. 34, No. 1, 2023, pp. 47-58.
[https://doi.org/10.7316/KHNES.2023.34.1.47]

-
R. J. Kee, J. A. Miller, G. H. Evans, and G. Dixon-Lewis, “A computational model of the structure and extinction of strained, opposed flow, premixed methane-air flames”, Symposium (International) on Combustion, Vol. 22, No. 1, 1989, pp. 1479-1494.
[https://doi.org/10.1016/S0082-0784(89)80158-4]

-
A. E. Lutz, R. J. Kee, J. F. Grcar, and F. M. Rupley, “OPPDIF: a fortran program for computing opposed-flow diffusion flames”, Sandia Report, 1997.
[https://doi.org/10.2172/568983]

-
X. Li, L. Jia, T. Onishi, P. Grajetzki, H. Nakamura, T. Tezuka, S. Hasegawa, and K. Maruta, “Study on stretch extinction limits of CH4/CO2 versus high temperature O2/CO2 counterflow non-premixed flames”, Combustion and Flame, Vol. 161, No. 6, 2014, pp. 1526-1536.
[https://doi.org/10.1016/j.combustflame.2013.12.004]

-
S. Colson, Y. Hirano, A. Hayakawa, T. Kudo, H. Kobayashi, C. Galizzi, and D. Escudié, “Experimental and numerical study of NH3/CH4 counterflow premixed and non-premixed flames for various NH3 mixing ratios”, Combustion Scien-ce and Technology, Vol. 193, No. 16, 2021, pp. 2872-2889.
[https://doi.org/10.1080/00102202.2020.1763326]

-
E. C. Okafor, Y. Naito, S. Colson, A. Ichikawa, T. Kudo, A. Hayakawa, and H. Kobayashi, “Experimental and numerical study of the laminar burning velocity of CH4-NH3-air premixed flames”, Combustion and Flame, Vol. 187, 2018, pp. 185-198.
[https://doi.org/10.1016/j.combustflame.2017.09.002]

-
H. Xiao, S. Lai, A. Valera-Medina, J. Li, J. Liu, and H. Fu, “Study on counterflow premixed flames using high concentration ammonia mixed with methane”, Fuel, Vol. 275, 2020, pp. 117902.
[https://doi.org/10.1016/j.fuel.2020.117902]

-
S. Colson, A. Hayakawa, T. Kudo, and H. Kobayashi, “Extinction characteristics of ammonia/air counterflow premixed flames at various pressures”, Journal of Thermal Science and Technology, Vol. 11, No. 3, 2016, pp. JTST0048.
[https://doi.org/10.1299/jtst.2016jtst0048]