암모니아로부터 수소 제조를 위한 다양한 촉매 활성 테스트에 관한 연구
2023 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
This research project focused on the production of hydrogen through ammonia decomposition reactions while investigating how the reactivity of this process varies when employing different catalysts. Several metal oxide supports (Al2O3, La2O3, CeO2) were utilized as catalysts, with active metals from both the transition metal group (Co, Ni, Fe, Cr, Cu) and the noble metal group (Ru, Rh, Pd, Pt) impregnated onto these supports. Furthermore, the study examined how the reactivity evolves with changes in reaction temperature when employing the prepared catalysts. Additionally, the research delved into the distinctive activation energies associated with each of the catalysts. In this research, In the noble metal catalyst system, the order of high activity for ammonia decomposition reaction to produce hydrogen is Ru > Rh > Pt ≈ Pd. In the transition metal catalyst system, the order of high activity is Co > Ni > Fe > Cr > Cu.
Keywords:
Ammonia, Decomposition, Hydrogen, Transition metal, Noble metal키워드:
암모니아, 분해 반응, 수소, 전이금속, 귀금속1. 서 론
현재의 에너지 시스템의 주요 문제는 화석연료를 이용한 에너지 생산이 환경에 부정적인 영향을 미치고 있다는 것이다. 시간이 흐름에 따라 화석연료 대체 기술이 도입되었고 기존 기술도 개선되었지만, 에너지 전환이라 불리는 에너지 시스템의 첨단적인 변화는 아직 완벽하게 이루어지지 않고 있다. 깨끗하고 효율적인 새로운 시스템으로의 에너지 전환 프레임워크 안에서 태양 및 풍력 기술의 비용이 크게 감소하고, 이제는 에너지 저장 기술의 비용도 줄어들고 있어 제안된 급격한 변화를 촉진하는 강력한 동기가 필요하다. 이를 위해 에너지 전환이 기술적인 측면뿐만 아니라 경제, 정치, 제도, 사회문화적 변화의 조합으로 이루어져야 하며, 도덕적 가치와 지속 가능성을 기반으로 진행되어야 한다1-3).
수소 에너지는 실제로 많은 주목을 받고 있는 청정한 대체 에너지원으로 미래의 에너지와 관련된 여러 문제를 해결하는 데 기여하고 있다. 전 세계적으로 화석연료의 고갈 문제로 인해 대체 에너지 개발이 매우 중요한데, 수소는 환경 친화적인 에너지로 환경오염과 지구 온난화를 줄이는데 매우 적합하다고 생각된다. 수소 에너지는 높은 에너지 효율성과 청정성을 갖추고 있어 21세기에 예상되는 에너지 자원 고갈과 환경오염과 관련된 문제를 동시에 해결할 수 있는 잠재력을 가지고 있다. 수소를 이용한 연료전지 기술을 사용하면 전기와 열을 생성하는 동안 물 증발만이 발생하며, 이로써 대기 중의 온실가스 배출을 줄일 수 있다. 또한 수소는 에너지 저장 및 운송에도 활용될 수 있어 에너지 공급의 안정성을 향상시키는 데 도움을 준다. 따라서 수소 에너지는 지속 가능한 에너지 미래를 위한 중요한 요소 중 하나로 간주되며, 환경 문제와 에너지 고령화 문제를 해결하는 데 큰 역할을 할 것으로 기대된다4-6).
암모니아는 황산에 이어 두 번째로 많이 생산되는 화학 물질로, 주로 비료 제조에 사용된다. 실제로 비료 생산이 암모니아 수요의 주요 부분을 차지하며, 총 암모니아 생산량의 88%를 차지한다. 암모니아의 총 생산량 중 90% 이상은 하버-보슈 공정이라고 불리는 암모니아 분해의 역반응을 통해 이루어진다. 이 공정은 원래 Fritz Haber와 Carl Bosch에 의해 개발되었으며, 철 촉매와 약 400-600℃의 온도, 그리고 100-400 bar의 압력을 사용한다. 1990년 이후 루테늄이 촉매로 도입되어 반응 압력을 낮출 수 있었지만, 높은 비용으로 인해 일부 공장에서만 사용되고 있다. 암모니아 합성 과정에서 H2와 N2 혼합물을 생산하는 과정이 공정의 총 비용에 가장 큰 영향을 미치며, 화석연료 에너지는 주로 H2 생산(천연가스의 스팀 리포밍)과 공기로부터 N2의 분리에 많은 비용이 사용된다. 암모니아 생산은 전 세계 에너지 공급의 약 2%를 소비하며, 약 400 Mt의 이산화탄소를 방출하여 전 세계 총 배출량의 1.6%를 차지한다. 따라서 블루 암모니아(탄소 포집 시스템 사용) 및 그린 암모니아(물의 전해로 생산된 수소 사용) 등의 개념을 사용하여 암모니아 생산 과정의 탄소 배출을 줄이려는 몇 가지 시도가 있었다.
현재 암모니아 분해 반응은 주로 금속 단열 및 아연 도금과 같은 산업적 용도로 활용되고 있으며, 이를 위해 암모니아 분해 장치가 사용되고 있다. 이 장치는 외부 에너지원을 활용하고 있는데 이 과정에서는 니켈이 알루미늄 산화물 촉매로 사용되고 850-950℃의 고온에서 운전되고 있다. 이러한 기술은 암모니아 분해 반응을 통해 전력을 생성하는 방식으로 발전시켜 나가고 있으며, 이는 암모니아를 전력으로 변환하여 에너지를 생산하는 혁신적인 방법 중 하나이다. 동시에, 이러한 과정에서 배기되는 암모니아의 존재를 최소화하는 것이 주요 목표이다7-10).
암모니아 분해는 그 합성 반응의 역반응이다. 이 반응은 표준 압력에서, 상대적으로 높은 온도에서 약간의 열을 소모하는 흡열 반응이다. NH3의 엔탈피 변화는 다음과 같은 반응식으로 나타낼 수 있다.
| (1) |
실제로 이 전환은 반응 온도와 촉매에 따라 달라지며, 열역학을 활용하여 계산된 온도보다 높은 온도(550-750℃)에서 수행될 수 있다. 열역학적으로 암모니아의 분해는 425℃의 온도에서 가능하지만, 반응속도는 굉장히 느리다. 촉매를 사용하면 450℃ 미만의 반응 온도에서 더 높은 암모니아 전환율을 얻을 수 있다. 그러나 평형 상태와 다르게 암모니아는 완전히 수소로 분해되지 않으며, 전환율은 100% 미만이다. 따라서 높은 암모니아 전환율을 얻으려면 이론적으로 가능한 암모니아 분해 반응 온도 범위인 250-700℃ 사이의 비교적 높은 온도가 필요하다11,12).
본 연구에서는 암모니아 분해 반응을 이용하여 수소를 제조함에 있어서 다양한 지지체 및 활성금속을 사용하여 여러 가지 반응 온도 변화 실험을 수행하고, 이를 통해 암모니아 분해 반응의 특성을 파악하고자 하였다. 각 활성금속의 온도별 실험을 수행하였고 반응 속도식 모델은 power-law 모델을 사용해 활성화 에너지를 도출하였다. 실험에는 쿼츠 고정층 반응기를 사용하였으며, 암모니아 분해 반응의 온도를 고려하여 400-700℃의 온도 범위에서 반응을 수행하였다.
2. 실 험
2.1 촉매 제조
본 연구에서는 Al2O3, La2O3, CeO2를 지지체로 사용하였고, 전이금속(Co, Ni, Fe, Cr, Cu) 및 귀금속(Ru, Rh, Pd, Pt)을 활성금속으로 하여 촉매를 제조하였다. 촉매는 함침법으로 제조되었으며, 활성금속의 햠량은 귀금속의 경우 2 wt%, 전이금속의 경우 5 wt%로 설정하였다. 지지체는 함침 전에 수분 제거를 위하여 약 120℃에서 1시간 동안 전처리를 하였으며, 정량된 전구체를 일정량의 증류수에 녹인 용액을 지지체에 함침과 건조를 반복 수행하여 촉매를 제조하였다. 용액을 지지체에 완전히 함침시킨 후 일정 시간 건조 후에 소성로에서 200, 300, 400℃에서 각각 1시간 동안 유지시키면서 총 3시간 동안 소성하였다.
2.2 촉매 특성 분석
지지체 및 제조된 촉매는 입자상 및 입자의 크기측정을 위하여 다음과 같이 X선 회절 분석기(X-ray diffraction, XRD)를 사용하여 분석되었다. 분석은 Cu-Kα (λ=1.5404 Å) 회절기를 사용하여 40 kV의 전압과 30 mA의 전류 조건에서 측정하였다.
그리고 제조된 촉매의 표면 모형을 분석하기 위해 scanning electron microscope (SEM) 분석 장비를 이용하여 측정하였다. JSM-7610F Plus (JEOL Ltd., Akishima, Japan)를 사용하여 표면의 상태를 확인하였으며, energy dispersive x-ray spectrometer (EDS) 결과를 통하여 촉매의 성분을 확인하였다.
2.3 촉매 반응성 테스트
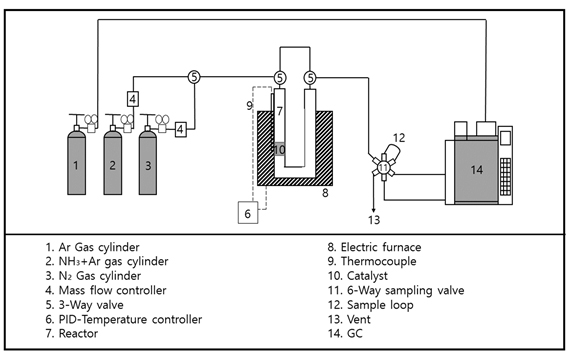
촉매의 반응성 테스트를 위하여 Fig. 1과 같이 반응 시스템을 구성하였다. 온도 400-700℃, 상압 조건에서 반응을 수행하였으며, 암모니아와 아르곤을 1:1의 몰비로 투입하면서 반응을 수행하고, 생성물 분석을 위하여 Carboxen (Supelco®, Bellefonte, PA, USA) 컬럼 및 thermal conductivity detector (TCD)가 장착되어 있는 가스 크로마토그래피(Shimadzu, Kyoto, Japan)를 사용하여 생성물을 분리하였다.
2.4 공정 모사
암모니아 분해 반응의 온도, 압력에 따른 평형 전환율을 확인하기 위하여 공정 모사 프로그램인 Aspen Plus (Aspen Technology, Inc., Bedford, MA, USA)를 사용하였다. 반응기 모델은 Gibbs 반응기를 사용하여 반응 온도 및 압력에 따라 변환되는 암모니아 전환율을 확인하였다.
3. 결과 및 고찰
3.1 암모니아 분해 반응의 열역학적 특성
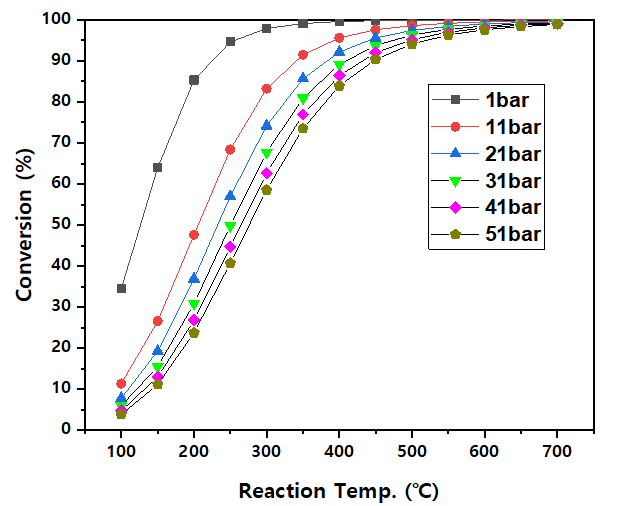
암모니아 분해 반응의 경우 식 (1)과 같이 흡열 반응으로 온도가 상승할수록 암모니아의 전환율이 높아진다. 또한 암모니아 1몰이 수소 1.5몰, 질소 0.5몰로 몰수가 증가하는 반응으로 르 샤틀리에의 원리에 따라서 반응 압력이 낮을수록 암모니아의 전환율이 높다고 할 수 있다. Fig. 2와 같이 Aspen Plus 공정 모사 결과와 같이 온도가 증가할수록 암모니아의 전환율이 높아지며 동일 온도 조건에서는 압력이 증가할수록 전환율이 낮아지는 결과가 나타난다. 특히나 반응 압력이 1 bar에서는 350℃ 이상에서 암모니아 전환율이 99% 이상 전환되며, 압력이 증가할수록 암모니아 전환율이 떨어지게 된다. 반응 압력이 51 bar에서는 반응 온도가 700℃에 도달하여도 암모니아 전환율이 98.8%로 나타났다.
3.2 다양한 암모니아 분해 반응 촉매
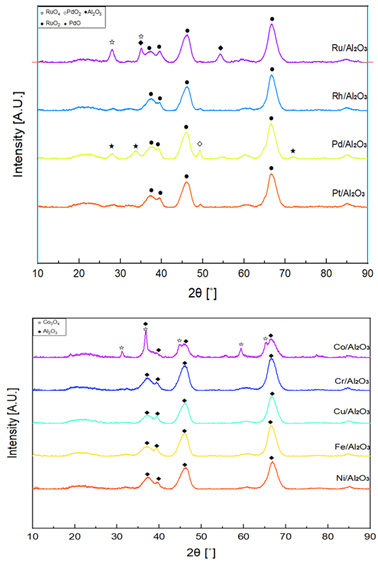
XRD 및 SEM 분석을 통하여 촉매가 제대로 제조되었음을 확인하였다. Figs. 3, 4는 제조된 촉매의 XRD와 SEM 분석 결과를 나타내고 있다.
암모니아 분해 반응에는 다양한 금속들이 촉매에 사용될 수 있다. 그중에서도 활성이 있는 금속으로는 Cr, Co, Cu, Fe, Ir, Ni, Pd, Pt, Rh, Ru, Se, Te, Ni, Ru 및 Pt와 함께 사용되는 알루미늄 산화물 합금, 그리고 다른 금속 산화물과의 합금으로 이루어진 Fe 합금이 암모니아 분해 반응에 사용될 수 있으며, 이외에도 Al, Ce, Si, Sr 및 Zr 등이 촉매로서 사용되는 경우가 있다13,14).
본 연구에서는 전이금속인 Co, Ni, Fe, Cr, Cu를 활성금속으로, Al2O3 지지체로 사용하여 촉매의 활성이 온도가 변함에 따라서 어떻게 되는지 관찰하였다. 이외에도 귀금속인 Ru, Rh, Pd, Pt를 활성금속으로 사용하여 암모니아 분해 반응 촉매의 활성에 대해서 연구를 수행하였다.
Fig. 5는 귀금속인 Ru, Rh, Pd, Pt를 활성금속으로 사용하여 암모니아 분해 반응 온도가 변화함에 따라서 촉매의 활성이 어떻게 달라지는지를 나타낸 것이다. Ru의 경우 Ru, Rh, Pd, Pt 활성금속중 가장 높은 촉매 활성을 보여주며, 두 번째로는 Rh이 높은 활성을 나타내었다. Kang 등15)은 루테늄의 경우 암모니아 분해 반응에서 주요한 활성점으로 알려진 것은 110면에 위치한 Ru 원자가 5개 모여 있는 B5-type site로 암모니아 분해 반응에 대한 높은 활성을 나타내는 것으로 알려져 있다고 하였다. 하지만 Pt나 Pd 의 경우 낮은 활성을 보이는 것으로 확인되었다. Papapolymerou와 Bontozoglou16)는 금속을 와이어나 다결정 박판 형태로 저압력에서 225-925℃ 사이의 온도에서 실험하여 암모니아 분해 반응의 반응 속도가 Ir > Rh > Pt > Pd 순서로 높은 활성을 가진다고 보고하였다.
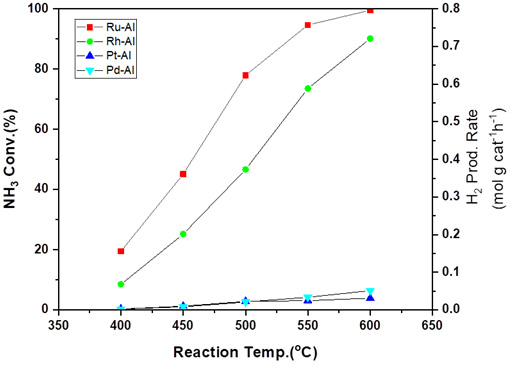
Catalytic activity results of ammonia decomposition reaction with different temperatures using Ru, Rh, Pd, and Pt catalysts
귀금속들 중에서 루테늄은 암모니아 분해 반응의 활성이 가장 큰 촉매로 알려져 있다. 그리고 본 연구에서도 마찬가지로 촉매의 활성이 Ru > Rh > Pt ≈ Pd 순서로 유사한 결과가 관찰되었다.
Fig. 6은 활성금속을 Ru으로 고정하고 지지체가 변화함에 따라서 온도별로 촉매의 활성이 달라지는 현상을 관찰하였다.
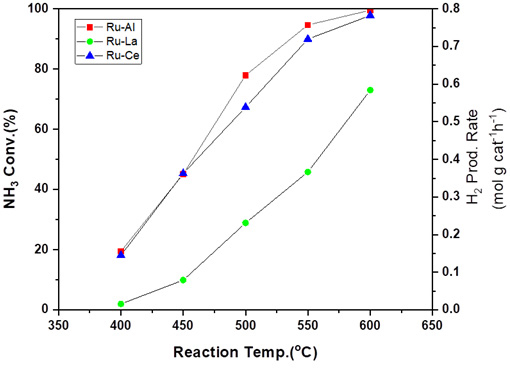
Catalytic activity results of ammonia decomposition reaction with different temperatures using Ru/Al2O3, La2O3, and CeO2 catalyst
Ru 촉매에서는 Al2O3> CeO2> La2O3 순서로 암모니아 분해 반응의 촉매 활성을 나타내었다. Ce나 La의 경우 증진제로서 암모니아 분해 반응에 사용되지만, La에서 반응성이 저하되는 것은 암모니아의 흡착 능력이 상대적으로 저하되어 전환율이 낮아졌기 때문인 것으로 추측된다.
또한 다양한 전이금속들을 지지체 및 증진제로 활용하여 귀금속들을 대체하기 위한 많은 연구가 수행되었다. 본 연구에서 전이금속 Co, Ni, Fe, Cr, Cu를 활성금속으로 하여 암모니아 분해 반응 촉매의 활성을 관찰하였다. Fig. 7은 Co, Ni, Fe, Cr, Cu를 활성금속으로 하여 암모니아 분해 반응 온도가 변화함에 따라서 촉매의 활성이 어떻게 달라지는지를 나타내고 있다.
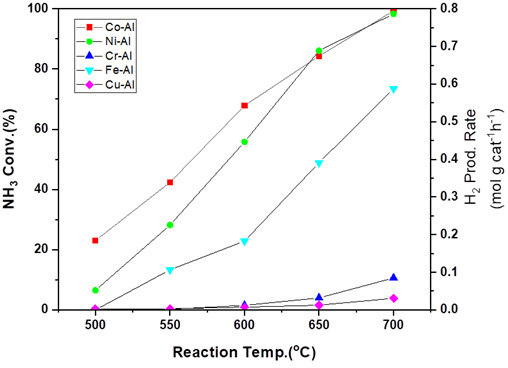
Catalytic activity results of ammonia decomposition reaction with different temperatures using Co, Ni, Fe, Cr, and Cu catalysts
Li 등17)에 따르면, Co, Ni, Fe 등의 전이금속은 높은 안정성을 가지며 그중에서도 Co의 경우 낮은 가격 및 질소의 흡착 능력으로 인하여 Ru를 대체할 수 있는 금속으로 여겨지고 있다.
Ganley 등18)은 알루미나 지지체 위에 있는 여러 단일 금속 촉매들의 결과를 비교하여 분해 반응성이 높은 순서대로 활성금속을 나열하였는데, Ru > Ni > Rh > Co > Ir > Fe≫ Pt > Cr > Pd > Cu ≫ Te, Se, Pb 순서로 암모니아 분해 반응성이 높다고 하였으나 지지체가 촉매 활동에 중요한 영향을 미치기 때문에 지지체에 따라 촉매의 활성이 상당히 다를 수 있다고 언급하였다.
본 연구에서는 전이금속계 암모니아 분해 반응 촉매의 활성이 Co > Ni > Fe > Cr > Cu 순으로 관찰되었으며, 이는 다른 연구 결과와 유사하다.
또한 Fig. 8의 Co계 촉매에서 지지체의 경우 Ru 촉매와는 다르게 La2O3 > Al2O3> CeO2 순서로 암모니아 전환율이 높은 것으로 관찰되었다. Pinzón 등19)은 La2O3에 Co를 함침할 경우 perovskite 구조가 형성되어 Ru 촉매를 대체할 수 있을 정도의 암모니아 전환율의 촉매 활성을 낼 수 있다고 언급하고 있다.
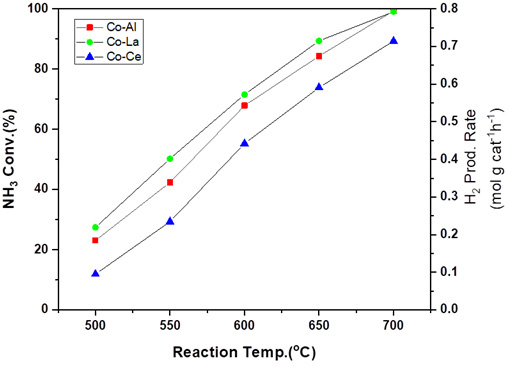
Catalytic activity results of ammonia decomposition reaction with different temperature using Co/Al2O3, La2O3, and CeO2 catalysts
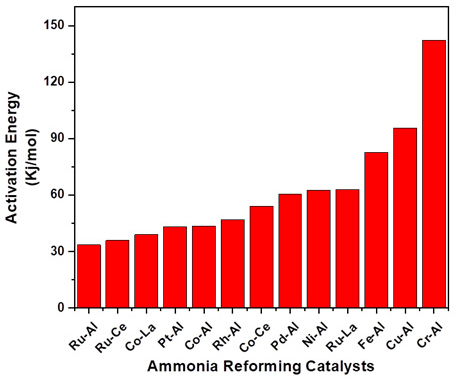
Fig. 9와 같이 각각의 촉매의 반응 온도별로 수행한 실험 데이터를 통해 겉보기 활성화 에너지를 구하였다. Ru/Al2O3 촉매의 경우 33.57 kJ/mol로 가장 낮은 활성화 에너지를 보여주었다. 그리고 Co/La2O3 촉매의 경우 38.9 kJ/mol, Cr/Al2O3 촉매의 경우 가장 높은 활성화 에너지인 142.4 kJ/mol로 나타났다.
4. 결 론
귀금속 및 전이금속을 활성금속으로 하여 각각의 지지체에 함침법을 통해 촉매가 성공적으로 제조되었음을 XRD 및 SEM-EDS를 통하여 확인하였다.
귀금속계 촉매에서는 Ru > Rh > Pt ≈ Pd 순서로 높은 활성을 보여주었으며 Ru을 활성금속으로 사용하였을 때 Al2O3> CeO2> La2O3 순서로 높은 암모니아 분해 반응성을 나타내었다. 전이금속계 촉매에서는 암모니아 분해 반응의 활성이 Co > Ni > Fe > Cr > Cu 순으로 관찰되었으며, Co를 활성금속으로 사용하였을 경우 Ru 촉매와는 다르게 La2O3 > Al2O3> CeO2 순서로 암모니아의 전환율이 높은 것으로 확인되었다. 이는 촉매의 활성과 지지체의 특성을 종합적으로 고려할 때 귀금속 및 전이금속을 사용한 활성금속과 지지체의 조합에 따라 암모니아 분해 반응의 활성이 다르게 나타날 수 있다는 것을 보여준다.
또한 활성금속의 종류에 따라 활성화 에너지가 달라진다. 촉매 활성은 반응 온도에 따라 특정 온도 범위에서 최고의 활성을 나타내고, 이를 통해 특정 활성금속이 어떤 환경에서 최적의 성능을 나타내는지 확인하였다.
Acknowledgments
본 과제(결과물)는 2023년도 교육부의 재원으로 한국연구재단의 지원을 받아 수행된 지자체-대학 협력기반 지역혁신 사업의 결과입니다(2021RIS-002).
References
-
R. York and S. E. Bell, “Energy transitions or additions?: why a transition from fossil fuels requires more than the growth of renewable energy”, Energy Research & Social Science, Vol. 51, 2019, pp. 40-43.
[https://doi.org/10.1016/j.erss.2019.01.008]

-
W. A. Braff, J. M. Mueller, and J. E. Trancik, “Value of storage technologies for wind and solar energy”, Nature Climate Change, Vol. 6, No. 10, 2016, pp. 964-969.
[https://doi.org/10.1038/nclimate3045]

-
J. Markard, “The next phase of the energy transition and its implications for research and policy”, Nature Energy, Vol. 3, No. 8, 2018, pp. 628-633.
[https://doi.org/10.1038/s41560-018-0171-7]

- International Energy Agency (IEA), “Renewables 2020: analysis and forecast to 2025”, IEA, 2020. Retrieved from https://www.iea.org/reports/renewables-2020, .
-
M. Balat, “Potential importance of hydrogen as a future solution to environmental and transportation problems”, International Journal of Hydrogen Energy, Vol. 33, No. 15, 2008, pp. 4013-4029.
[https://doi.org/10.1016/j.ijhydene.2008.05.047]

-
A. Demirbas and K. Dincer, “Sustainable green diesel: a futuristic view”, Energy Sources, Part A: Recovery, Utilization, and Environmental Effects, Vol. 30, No. 13, 2008, pp. 1233-1241.
[https://doi.org/10.1080/15567030601082829]

- V. Pattabathula and J. Richardson, “Introduction to ammonia production”, CEP Magazine, Vol. 112, No. 9, 2016, pp. 69-75. Retrieved from https://www.aiche.org/sites/default/files/cep/20160969.pdf, .
-
B. Elvers and G. Bellussi, “Ullmann's encyclopedia of industrial chemistry”, 7th ed, Vol. 3, 2011, pp. 1-88.
[https://doi.org/10.1002/14356007.o02_o11]

-
A. Barona, B. Etxebarria, A. Aleksanyan, G. Gallastegui, N. Rojo, and E. Diaz-Tena, “A unique historical case to understand the present sustainable development”, Science and Engineering Ethics, Vol. 24, 2018, pp. 261-274.
[https://doi.org/10.1007/s11948-017-9891-5]

- The Royal Society, “Ammonia: zero-carbon fertiliser, fuel and energy store”, The Royal Society, 2020. Retrieved from https://royalsociety.org/-/media/policy/projects/green-ammonia/green-ammonia-policy-briefing.pdf, .
-
D. K. Lim, A. B. Plymill, H. Paik, X. Qian, S. Zecevic, C. R. I. Chisholm, and S. M. Haile, “Solid acid electrochemical cell for the production of hydrogen from ammonia”, Joule, Vol. 4, No. 11, 2020, pp. 2338-2347.
[https://doi.org/10.1016/j.joule.2020.10.006]

-
S. Chiuta, R. C. Everson, H. W. J. P. Neomagus, P. van der Gryp, and D. G. Bessarabov, “Reactor technology options for distributed hydrogen generation via ammonia decomposition: a review”, International Journal of Hydrogen Energy, Vol. 38, No. 35, 2013, pp. 14968-14991.
[https://doi.org/10.1016/j.ijhydene.2013.09.067]

-
C. Chen, K. Wu, H. Ren, C. Zhou, Y. Luo, L. Lin, C. Au, and L. Jiang, “Ru-based catalysts for ammonia decomposition: a mini-review”, Energy & Fuels, Vol. 35, No. 15, 2021, pp. 11693-11706.
[https://doi.org/10.1021/acs.energyfuels.1c01261]

-
J. Woo, T. Kim, J. E. Kim, B. Cho, S. Jung, S. Park, S. Lee, and J. Kim, “Ni catalyst properties for ammonia reforming: comparison of Ni content and space velocity”, Journal of Hydrogen and New Energy, Vol. 32, No. 6, 2021, pp. 464-469.
[https://doi.org/10.7316/KHNES.2021.32.6.464]

-
S. Kang, J. Cha, Y. S. Jo, Y. J. Lee, H. Sohn, Y. Kim, C. K. Song, Y. Kim, D. H. Lim, J. Park, and C. W. Yoon, “Heteroepitaxial growth of B5-site-rich Ru nanoparticles guided by hexagonal boron nitride for low-temperature ammonia dehydrogenation”, Advanced Materials, Vol. 35, No. 4, 2023, pp. 2203364.
[https://doi.org/10.1002/adma.202203364]

-
G. Papapolymerou and V. Bontozoglou, “Decomposition of NH3 on Pd and Ir comparison with Pt and Rh”, Journal of Molecular Catalysis A: Chemical, Vol. 120, No. 1-3, 1997, pp. 165-171.
[https://doi.org/10.1016/S1381-1169(96)00428-1]

-
G. Li, X. Yu, F. Yin, Z. Lei, H. Zhang, and X. He, “Production of hydrogen by ammonia decomposition over supported Co3O4 catalysts”, Catalysis Today, Vol. 402, 2022, pp, 45-51.
[https://doi.org/10.1016/j.cattod.2022.02.020]

-
J. C. Ganley, F. S. Thomas, E. G. Seebauer, and R. I. Masel, “A priori catalytic activity correlations: the difficult case of hydrogen production from ammonia”, Catalysis Letters, Vol. 96, No. 3-4, 2004, pp. 117-122.
[https://doi.org/10.1023/B:CATL.0000030108.50691.d4]

-
M. Pinzón, A. Sánchez-Sánchez, P. Sánchez, A. R. de la Osa, and A. Romero, “Ammonia as a carrier for hydrogen production by using lanthanum based perovskites”, Energy Conversion and Management, Vol. 246, 2021, pp. 114681.
[https://doi.org/10.1016/j.enconman.2021.114681]