H2-O2 재결합 반응을 통한 M/γ-Al2O3 촉매의 산소 제거 성능과 산소 결손이 촉매에 미치는 영향
2023 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
The intermittent nature of renewable energy is a challenge to overcome for safety and stable performance in water electrolysis systems linked to renewable energy. Oxygen removal using the catalyst is suitable for maintaining the oxygen concentration in hydrogen below the explosive level (4%) even in intermittent power supply. Metals such as Pd, Pt, and Ni are expected to be effective materials due to their hydrogen affinity. The oxygen removal performance was compared under high hydrogen concentration conditions by loading on γ-Al2O3 with high reactivity and large surface area. The characteristics of the catalyst before and after the reaction were analyzed through X-ray diffraction, transmission electron microscope, H2-temperature programmed reduction, X-ray photoelectron spectroscope, etc. The Pd catalyst that showed the best performance was able to lower 2% oxygen to less than 5 ppm. Changes in catalyst characteristics after the reaction indicate that oxygen vacancies are related to oxygen removal performance and catalyst deactivation.
Keywords:
Hydrogen purification, H2 safety, Deoxo-catalyst, H2-O2 recombination, Oxygen vacancy키워드:
수소 정제, 수소 안전, 산소 제거 촉매, 수소-산소 재결합 반응, 산소 결손1. 서 론
지난 수십년간 화석연료 기반의 에너지 사용은 대기오염, 지역별 에너지 공급의 불균형, 과도한 미세먼지 배출 등의 기후 변화를 가속화시켰다1-5). 이로 인해 전 세계적으로 기후 변화의 주된 원인인 탄소 배출을 저감하기 위한 규제들도 강화되는 추세이다. 탄소 배출의 저감과 함께 탄소를 배출하지 않는 친환경 에너지원에 대한 관심 역시 높아졌다. 수소는 물을 전기분해하여 쉽게 얻을 수 있고, 생산 과정 중 탄소를 배출하지 않으며, 특정 지역에 국한되지 않기 때문에 가장 각광받는 에너지원 중 하나이다6-8). 특히 재생에너지와 연계된 수전해 수소 생산은 완전한 그린수소 생산 기술로 주목을 받고 있으며, 전 세계적으로 관련 연구 개발이 활발히 진행되고 있다9-12).
재생에너지의 간헐적 특성은 재생에너지와 연계된 수전해 시스템의 안전성과 장기적인 안정성을 위해 극복해야 할 과제 중 하나이다13-17). 대표적인 예는 2019년 강릉 산업단지에서 발생한 수소 저장 탱크 폭발 사건이다18). 간헐적인 전원으로 인해 정격 운전 전류밀도보다 낮은 전압과 전류의 전기가 공급되어 수소의 순도가 떨어졌고, 이로 인해 수소 저장 탱크로 산소가 혼입된 것이 폭발의 원인으로 여겨지며, 산소 농도를 폭발 한계(4%) 이하로 유지하는 산소 제거 장치가 부족했던 것으로 알려졌다19). 따라서 재생에너지를 활용한 수소 생산의 안전성과 상용화를 위해선 간헐적인 특성을 극복하기 위한 기술 개발이 필요하다.
촉매를 통한 수소 정제 기술은 수전해 시스템 전체의 안정성을 확보하고 안정적인 수소 농도를 유지하기 적합한 방법 중 하나이다.20,21) 촉매는 외부 요인(전기 부하의 변동, 압력 변화 등)에 크게 영향을 받지 않기 때문에, 간헐적인 에너지원에서도 안정적인 수소 농도를 유지할 수 있다22). 촉매는 H2-O2 재결합 반응을 통해 수소 내 산소와 결합해 물을 형성한다. 이 반응은 전기분해의 역반응이며 자발적인 반응이기 때문에 추가적인 에너지원이 필요하지 않다.
일반적으로 H2-O2 재결합 반응에 사용되는 촉매 물질은 Pd와 Pt이다. Pd, Pt 촉매는 H2-O2 재결합 반응에 높은 활성을 나타내지만, 비활성화로 인한 성능의 감소가 문제점으로 지적되고 있다. Pd 또는 Pt 기반 촉매는 탄소질 물질의 형성 및 침전과 비가역적인 황 중독으로 인해 쉽게 비활성화된다. Pd는 저온에서 H2와 반응하여 취화되고, 재결합 반응에서 생성되는 물에 의해 비활성화된다. 따라서 촉매의 안정성을 향상시키기 위해서는 비활성화의 원인을 이해하는 것이 필요하다.
본 연구에서는 고농도의 H2 스트림에서 O2 제거를 위한 M/Al2O3 (M=Pd, Pt, Cu, Ni) 촉매를 합성하여 촉매 물질에 따른 촉매의 성능 평가를 진행했다. 촉매는 X-ray photoelectron spectroscope (XPS), X-ray diffraction (XRD), H2-temperature programmed reduction (H2-TPR), 화학 흡착 분석 등을 통해 성능 변화를 관찰하였으며, 촉매의 물성 분석을 통해 성능 변화의 원인을 분석했다. 특히 반응으로 인한 촉매 표면의 변화와 비활성화 결과 비교를 통해 촉매의 비활성화에 영향을 미치는 요소를 분석하였다.
2. 실 험
2.1 산소 제거용 M/Al2O3 촉매 제조
본 연구에서 사용된 산소 제거용 촉매는 다음과 같은 물질들과 합성 방법을 통해 제조되었다. 촉매의 지지체로는 기공 구조, 넓은 비표면적, 우수한 흡착 성능, 산성 및 우수한 열 안정성 등 촉매 작용의 필수 특성을 가지고 있는 Gamma alumina powder (Sasol, Johannesburg, Republic of South Africa)가 사용되었다. 촉매 물질로는 Pd, Pt, Cu, Ni를 선택하였다. Pd와 Pt는 높은 수소 흡착 능력으로 인해 수소 관련 반응에 빠지지 않는 촉매 물질로, 수소 흡착을 통한 빠른 H2-O2 재결합 반응으로 높은 산소 제거 성능이 기대되는 촉매 물질이다. Cu는 높은 산소 흡착 능력을 통해 고농도의 H2 스트림에서 반응의 한계 물질인 O2의 원활한 흡착을 통한 높은 산소 제거 성능이 예상되어 선택되었다. Ni은 수소의 산화반응 효율성을 높이는 촉매 물질로 사용되며, 상용 수소가스 검출 센서에 Pd-Ni 합금으로 사용되어 센서의 내구성과 반응 속도를 향상시키는 역할을 한다. 이런 특징은 H2-O2 재결합 반응에서 높은 산소 제거 성능과 촉매의 내구성 향상에 기여할 것으로 예상된다. 금속들의 전구체는 Palladium (II) nitrate (Pd[NO3]2, 95-100%; Sigma aldrich, St. Louis, MS, USA), Platinum (IV) chloride (PtCl4, 99%; Sigma aldrich), Copper (II) nitrate (Cu[NO3]2, 98%; Sigma aldrich), Nickel (II) nitrate (Ni[NO3]2, 98%; Sigma aldrich)가 사용되었으며, 지지체에 Pd, Pt, Cu, Ni 금속 전구체를 함침하여 제조되었다. 그리고 증류수에 지지체와 전구체를 용해시켜 합성하는 습식 함침법(wet-impregnation)을 통해 촉매를 제조하였다. 함침 후 생성물은 상온에서 12시간 동안 건조되었으며, 이후 110℃ 오븐에서 2시간 동안 추가로 건조되었다. 건조 후 얻어진 생성물은 400℃에서 20% H2/N2를 사용하여 2시간의 환원 과정을 통해 촉매로 제조되었다. 촉매는 0.1-10 wt.%의 금속 함량(이후 xM/Al2O3로 표기; x는 금속 함량, M은 금속 종류)으로 제조되었다.
2.2 촉매 특성화
제작된 촉매는 다양한 방식을 통해 특성화되었다. XRD 패턴 분석은 제작된 촉매의 결정 및 결정 크기 분석을 위해 진행되었다. 15-80°의 2θ 범위에서 Cu Ka1 (λ=1.5406 Å) 방사선을 사용하여 (MiniFlex II, Rigaku, Tokyo, Japan) 기기를 통해 측정되었다. 고해상도 투과 전자 현미경(high-resolution transmission electron microscopy, HR-TEM) 이미지는 300 kV에서 Tecnai G2 F30 기기 (FEI Co., Hillsboro, OR, USA)를 통해 얻었다. XPS 분석은 Al Ka X-ray 방사선(K-alpha+; Thermo scientific, Waltham, MA, USA)을 사용해 측정되었다. 표면 원소의 결합에너지(bond energy, BE)는 C1s BE 284.6 eV를 기준으로 보정되었다. 금속의 함량은 유도 결합 플라즈마 방출 분광기(ICP-AES, OPTIMA 7300DV, Perkin-Elmer Co., Waltham, MA, USA)를 통해 측정되었다.
2.3 촉매의 산소 제거 성능 측정
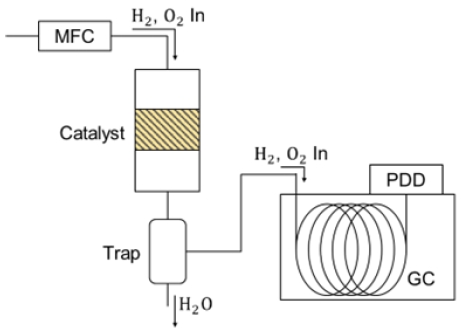
수소-산소 재결합 반응을 통한 산소 제거 실험 방법의 개략도는 Fig. 1에 나타냈다. 촉매 반응기는 38 cm의 길이와 4 mm의 내경을 지니는 석영 재질의 원통 수직관형으로 내부에 촉매가 고정층으로 충진 될 수 있도록 제작되었다. 촉매 반응기 하단에는 반응의 생성물인 H2O이 액화되어 배출될 수 있도록 트랩을 설치하였다. 트랩은 칠러를 통해 4℃로 유지하였다. 반응 후 남아있는 H2와 O2는 가스 분석기(YL-6500, YONGIN Chromass, Anyang, Korea)로 유입되기 전에 제습제(≥98% CaSO4, <2% CoCl2)를 지나며 남아있는 H2O(g)를 제거하였다. H2와 O2의 농도는 pulsed discharge detector (PDD)가 장착된 가스분석기와 ppm 단위까지 측정 가능한 산소 측정기(series 3000 Trace Oxygen analyzer; ALPHA OMEGA INSTRUMENTS TM, Houstan, TX USA)를 통해 측정되었다.
수소-산소 재결합 반응은 상온(25℃), 상압(1기압)에서 진행되었다. 기체는 mass flow controller (MFC)를 사용하여 98% H2 + 2% O2 혼합물을 100 mL/min의 유량으로 흘려주었다. 반응기 내부에는 250-600 µm의 크기를 가진 촉매를 0.025 g 충진하였다. 가스 분석기 내부에는 CP-Molsieve 5A 컬럼(50 m/0.32 mm; Agilent J&W, Santa Clara, CA, USA)이 장착되었으며, 초고순도의 He 기체(99.999%)가 운반 기체로 사용되었다. 컬럼이 장착된 오븐 온도는 80℃로 유지되었다. 산소의 농도는 초고순도(99.999%) O2 및 N2 기체의 분율을 조절하여, PDD로부터 얻어진 가스 크로마토그래프 피크 면적을 통해 검량선을 그려 계산하였다.
3. 결과 및 고찰
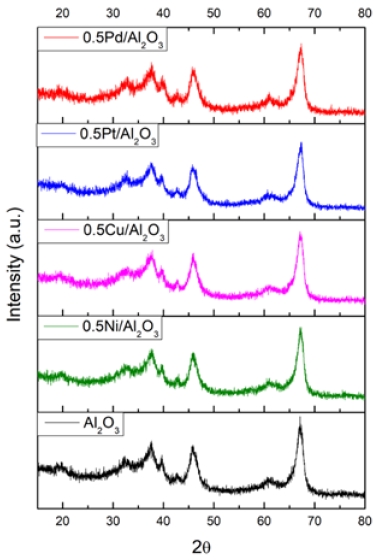
일반적으로 불균일 촉매 반응은 금속의 특정 활성점에서 진행되기 때문에 XRD를 이용한 결정 구조 분석을 통해 반응이 주로 일어나는 결정면을 예측하는 것이 가능하다23). Fig. 2는 제작된 0.5M/Al2O3 (M=Pd, Pt, Cu, Ni) 촉매의 XRD 패턴을 나타낸 것이다. γ-Al2O3의 회절 패턴은 주로 정방정계 및 입방정의 결정상을 나타냈다. 입방정의 (222), (400), (440) 평면은 각각 2θ=39.5°, 45.8°, 66.7°에서 나타났으며, 정방정계 (113), (112), (211), (103), (220), (004), (400), (224) 평면은 2θ=19.8°, 31.8°, 37.3°, 37.7°, 45.6°, 46.2°, 66.1°, 67.1° 에서 나타났다24-26). 0.5 wt.%의 낮은 금속 함유량으로 인해 금속에 해당하는 회절 피크는 관찰되지 않았다.
명확한 회절 패턴을 얻기 위해 5 wt.% 금속 함량의 촉매를 합성하여 XRD 분석을 진행하였다(Fig. 3). 5Pd/Al2O3 촉매는 40.1°에서 하나의 회절 피크를 나타냈고, 이는 Pd 금속의 (111) 평면에 해당한다. Pt 결정의 (111), (200), (220) 평면은 각각 2θ=39.9°, 46.3°, 67.5° 에서 나타났다27,28). 5Cu/Al2O3는 2θ=43.2°, 50.4°, 73.9° 에서 3개의 낮은 강도의 회절 피크를 나타냈고, 이는 각각 Cu (face centered cubic [FCC] 구조)의 (111), (200), (220) 평면에 해당한다29). 5Ni/Al2O3에서는 눈에 띄는 결정 구조가 나타나지 않았다. Cu와 Ni 촉매는 나노 크기의 결정으로 이루어진 크고 작은 클러스터를 형성할 것으로 예상되었으나, 비정질 구조를 가지는 것으로 보인다. Cu는 낮은 강도의 FCC 특성 피크를 나타내었고, Pd와 Pt는 뚜렷한 FCC 구조의 피크를 나타내는 것을 확인했다. Pd와 Ni 촉매에서는 2θ=19.4°에서 나타나는 γ-Al2O3의 (111) 회절 피크의 강도가 증가하고 넓어지는 것을 확인할 수 있다(Fig. 3[a], [d]). 회절 피크의 강도 증가는 결정성의 증가를 의미한다. 피크 면적이 넓어지는 것은 결정 크기의 감소, 적층 결함(stacking fault), 결정구조의 결함 등에 의해 발생한다. 해당 결과는 Pd와 Ni가 γ-Al2O3 (111)면에 특정 부위에 결함을 발생시켜 결정면의 크기는 감소하지만(peak broadening), 결함으로 인해 나누어진 (111)면이 증가하는 것으로(peak intensity) 보인다.
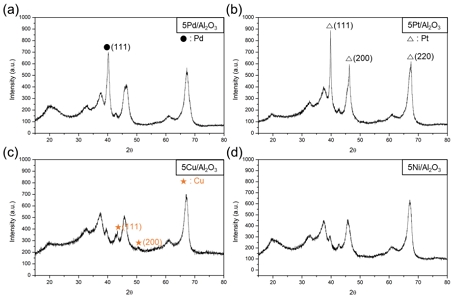
XRD patterns of 5M/Al2O3 (M-Pd, Pt, Cu and Ni) catalysts (a) 5Pd/Al2O3, (b) 5Pt/Al2O3, (c) 5Cu/Al2O3, (d) 5Ni/Al2O3 catalyst
0.5Pd/Al2O3 촉매에서 Pd 입자의 크기와 형태는 HR-TEM을 통해 분석했다. Fig. 4에서 Al2O3 지지체 위에 불규칙한 모양으로 잘 분산된 Pd입자를 확인할 수 있다(Fig. 4[a]). Pd는 약 4 nm와 10 nm의 결정을 형성하는 것을 확인할 수 있었다. d-spacing 값은 4 nm 결정의 경우 0.229 nm이고 10 nm 결정은 0.226 nm였다(Fig. 4[c], [d]). γ-Al2O3 위에 성장한 Pd는 왜곡된 형태를 보였다. 이 구조는 촉매 내에서 코너 부위와 같은 배위적으로 불포화된 부위의 비율을 높아지게 한다. 이러한 불포화된 Pd는 촉매의 반응성을 증가시키게 된다. Pd 입자의 평균 크기 측정을 위해 다양한 영역 및 배율로 HR-TEM 이미지를 수집하였다(Fig. 5). 평균 입자 크기는 200개 이상의 입자 수로 측정되었으며, 0.5Pd/Al2O3 촉매에서 Pd는 평균 7.7 nm를 형성하는 것을 확인할 수 있었다.

TEM image of 0.5Pd/Al2O3 catalyst with different magnifications. (a) 200 nm, (b) 50 nm and (c) & (d) 5 nm
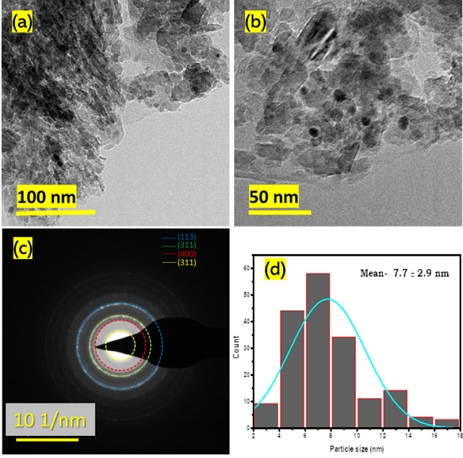
(a, b) HR-TEM images of 0.5Pd/Al2O3 with different magnifications. (c) SAED pattern 0.5Pd/Al2O3. (d) Histogram of 0.5Pd/Al2O3 (counted more than 200 particles from various images)
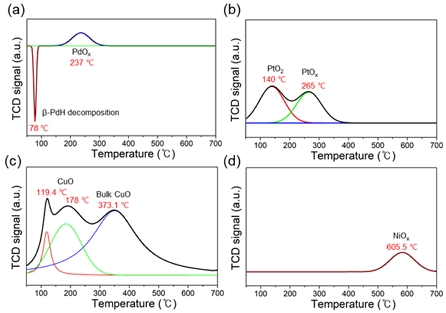
H2-TPR 분석은 촉매의 환원성과 금속 산화물의 성질 연구를 위해 진행되었다(Fig. 6). 0.5Pd/Al2O3 촉매의 78℃에서 관찰된 음의 피크는 Pd의 특성으로 인한 β-PdH 분해에 의해 발생한다. 이러한 Pd의 H2를 활성화하고 저장하는 특성은 다양한 분야에서 활용되고 있으며, 주변 조건에서 촉매의 환원반응을 향상시킨다. 산화된 Pd는 온도가 상승함에 따라 흡착된 H2를 방출하며, 이 피크의 강도와 위치는 주로 Pd의 크기와 분산에 따라 달라진다. 더 큰 Pd 입자는 더 많은 H2를 저장하는 반면, 더 작은 Pd 입자는 더 높은 온도에서 H2 분해가 일어난다. 237℃에서 나타난 양의 피크는 PdOx의 감소로 인해 발생한다30). H2는 표면 하이드록실기와 반응하여 PdO를 감소시킨다24). 0.5Pt/Al2O3의 경우 140℃와 265℃에서 환원 피크를 확인할 수 있었다. 낮은 온도에서 발생하는 피크는 잘 분산되고 지지체와 약하게 상호작용하는 Pt입자와 γ-Al2O3 (PtO2-Al2O3 복합체)에 의해 발생하며31,32), 높은 온도에서는 지지체와 강하게 상호작용하는 벌크 PtOx의 감소로 인해 발생한다33-35). 0.5Cu/Al2O3의 경우 작은 크기의 2차원 및 3차원 클러스터에 해당하는 피크를 119℃와 178℃에서 확인할 수 있었다. 저온 피크는 Cu2+에서 Cu+로의 환원에 해당하고, 고온 피크는 Cu+에서 Cu0로의 환원에 의해 나타난다. 373℃에서 벌크 CuO의 환원 피크 또한 확인되었다36). 일반적으로 Cu는 상온에서 공기 중의 O2와 반응하여 쉽게 산화되기 때문에 높은 산소 흡착을 기대할 수 있다. 하지만 상대적으로 낮은 온도에서 환원되기 때문에 반응 온도 및 H2-O2 재결합 과정 중 발생하는 발열로 인해 촉매가 변형될 수 있을 것으로 보인다. 0.5Ni/Al2O3의 경우 605℃에서 NiOx와 γ-Al2O3의 강한 상호작용에 의한 환원 피크를 확인할 수 있었다37-39). Pd, Pt, Cu 촉매는 산화 및 비활성화된 후 비교적 저온에서 환원 과정을 통해 재생될 수 있을 것으로 보인다. H2-O2 재결합 반응의 발열 특성을 고려하면 별도의 재생 공정이 필요하지 않을 수 있다.
촉매들의 H2, O2 흡착과 표면적 및 결정 크기 분석은 화학 흡착 분석을 통해 진행되었다. Pd, Pt, Cu 촉매는 금속 표면적과 결정 크기 분석에 CO-화학 흡착이 사용되었고. Ni 촉매는 H2-화학 흡착이 사용되었다. 결과는 Table 1에 나타내었다. 0.5Ni/Al2O3 촉매는 가장 높은 H2 흡착을 보였으며, Pd와 Pt 촉매가 그 뒤를 이었다. 이는 H2-TPR 분석에서 나타난 NiOx의 영향으로, NiOx의 표면에 노출된 다량의 산소 부위에서 H2 흡착이 일어나는 것으로 보인다. 그러나 표면 산소 부위의 존재는 화학적으로 O2의 흡착을 방해하게 되고, 결과적으로 Ni 촉매는 가장 낮은 O2 흡착을 보여주었다. 또한 가장 적은 금속 표면적과 12.11 nm 의 결정 크기를 통해 Ni이 다른 촉매들보다 밀집하여 촉매 표면에 존재한다는 것을 알 수 있다. 0.5Pd/Al2O3 촉매는 0.5Pt/Al2O3 촉매에 비해 H2를 2배 더 많이 흡착하였고, 이는 상온에서 β-PdH를 형성하는 특성과 일치한다. 또한 Cu 촉매를 제외하고는 0.5Pd/Al2O3 촉매가 가장 높은 O2 흡착을 나타냈는데, 이는 O2가 한계 반응물로 작용하는 실험 조건에서 H2-O2 재결합 반응에 유리하게 작용한다. Pd 촉매는 촉매 중 가장 높은 금속 표면적과 가장 작은 결정 크기를 가지고 있어 많은 촉매 활성 부위를 제공할 수 있다. 0.5Pt/Al2O3 촉매는 가장 낮은 H2 흡착과 금속 표면적(m2/gㆍsample)을 가지고 있어, 표면 활성점이 적을 것으로 보인다. 0.5Cu/Al2O3 촉매는 가장 높은 O2 흡착을 보였으며, 이는 상온에서 O2를 흡수하여 다양한 산화물을 형성하는 Cu의 특성과 일치한다.
합성된 촉매의 H2-O2 재결합 반응은 대기압과 상온 조건에서 진행되었으며, 반응 후 남아있는 산소의 농도는 Fig. 7과 Table 2에 나타내었다. Pd/Al2O3 촉매는 모든 금속 함량에서 우수한 산소 제거 성능을 보여주었다. 0.1Pd/Al2O3 촉매는 O2 농도를 2%에서 4 ppm까지 낮추었고, O2의 99.98%가 제거되었다. 반응 생성물인 물을 제거하면 수소의 순도는 99.9996%로 ISO-14687-2에 제시된 PEM 연료전지 도로 차량 시스템용 수소 가스 연료에 적합한 사양이다. Pd/Al2O3 촉매는 반응 시작 후 1시간 이내에 최대 성능에 도달하였으며, 13시간 동안의 연속반응 동안 성능을 유지하였다.
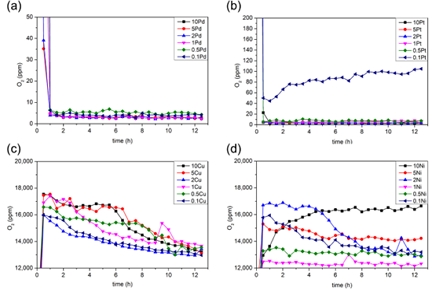
O2 concentration change in H2 stream with reaction time (measured every 0.5h through GC for 13 hours). Inlet gas: H2 98% and O2 2% 2,083 GHSV. Black: 10 wt.%, Red: 2 wt.%, Blue: 1 wt.%, Pink: 0.1 wt.% metal content. (a) Pd, (b) Pt, (c) Cu, (d) Ni- Al2O3 catalysts
Pt/Al2O3 촉매는 0.5-10 wt.%의 금속 함량에서 Pd 촉매와 유사한 높은 산소 제거 성능을 보였다. Pt 촉매는 30분 이내에 최대 성능에 도달했으며, Pd 촉매보다 빠르게 최대 성능에 도달하였다. 10Pt/Al2O3 촉매는 최대 성능에 도달하기에 더 많은 시간이 필요했으며, 이는 과도한 금속 함량으로 인한 활성점 감소(Pt 원자 간의 결합 증가 및 지지체와의 상호작용 감소)에 따른 것으로 예상된다. 0.1Pt/Al2O3 촉매는 1시간의 연속 반응 후 42 ppm의 O2 농도를 나타냈다. 이는 실험 조건이 촉매의 성능 한계와 가깝다는 것을 나타낸다. O2 농도는 반응 시간이 증가함에 따라 점차 증가했으며, 촉매가 비활성화 됨을 보였다. 촉매 성능의 감소는 H2-TPR에서 나타난 것처럼 PtOx의 형성으로 인한 활성 부위 감소가 원인일 수 있다.
Cu 촉매의 경우 모든 금속 함량에서 낮은 산소 제거 성능을 보였다. Cu 촉매는 반응이 진행될수록 산소 제거 성능이 증가하는 경향을 보였고, 연속반응 13시간 후에 약 1.3-1.4%의 O2 농도를 나타냈다. 이러한 현상은 H2-TPR에서 나타난 Cu 촉매의 환원에 의한 것으로 보인다. Cu 촉매는 상대적으로 낮은 온도에서 H2를 흡수하여 CuO의 환원반응이 진행된다. 그 결과, 촉매 활성 부위의 수가 증가하여 산소 제거 성능이 증가하는 것으로 보인다.
Ni/Al2O3 촉매는 Cu/Al2O3 촉매와 유사하게 반응이 진행될수록 산소 제거 성능이 상승하는 결과를 보였다. 앞선 촉매 특성화 과정을 통해 Cu 및 Ni 촉매는 클러스터 또는 벌크 형태의 특징을 보여주고 있으며, 이것이 유사한 산소 제거 경향을 가지는 원인으로 보인다. 10Ni/Al2O3 촉매의 경우 반응이 진행될수록 산소 제거 성능이 감소하는 것을 확인할 수 있다. 해당 현상은 과량의 Ni이 O2를 흡착하여 Ni-O 결합을 형성하여 촉매 활성점이 감소하는 것이 원인으로 보인다. 흡착된 O2는 H2와의 반응을 통해 H2O를 형성하면서 소모되어야 하지만, H2-TPR에서 나타난 것처럼 높은 온도에서 발생하는 NiOx의 환원반응은 실험 조건에서 추가적인 O2의 흡착을 억제하는 것으로 보인다.
Pd/Al2O3 촉매의 안정성과 성능 한계를 확인하기 위해 500시간의 연속반응을 진행했다(Fig. 8). 실험에는 0.05Pd/Al2O3 촉매를 0.025 g 사용하였다. 주입 기체는 H2 98%, O2 2%를 MFC를 통해 주입시켰으며 기체의 공간 속도는 2,083/h이다. 촉매는 반응 시작 후 200시간 동안 잔여 산소 농도를 5 ppm 미만으로 유지하였다. 200시간이 지난 후, 약 100시간 동안 8 ppm의 잔여 산소 농도까지 천천히 성능이 감소했다. 촉매 성능의 감소는 다양한 요인으로 발생할 수 있다. 첫 번째는 금속의 산화로 인한 촉매 활성점의 감소이다. 이러한 화학적 변화는 촉매의 영구적인 비활성화를 초래할 수 있기 때문에 면밀하게 조사되어야 한다. 두 번째는 H2-O2 재결합 과정에서 발생하는 열로 인한 반응 속도의 감소이다. H2-O2 재결합 과정은 극도의 발열 반응이기 때문에, 금속 표면 온도가 상승하면 정반응의 속도가 감소할 수 있다. 흥미로운 점은 촉매의 비활성화가 영구적으로 지속되지 않았다는 것이다. 촉매는 300시간 이후 성능이 증가하는 모습을 보였으며, PdO의 비교적 낮은 환원 온도가 그 원인으로 보인다. Pd는 지속적으로 O2를 흡착하여 H2-O2 재결합 반응을 진행하고 그 과정에서 일부는 PdO로 산화될 것이다. 이때, 고농도의 H2와 재결합 반응으로 인한 온도의 상승은 PdO가 자발적으로 환원되는 환경을 만들 수 있다.
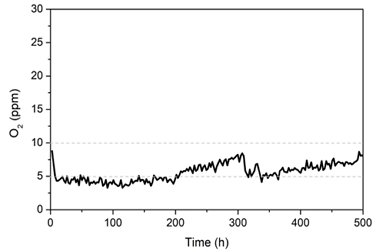
Stability of the 0.05Pd/Al2O3 catalyst for the H2-O2 recombination reaction with inlet gas composition of H2 98% and O2 2% and the GHSV of 2,083/h for 500 hours
앞선 500시간의 측정에서 산화는 촉매를 비활성화시키는 원인으로 예상되었고, 환원을 통한 금속의 산화수 감소는 촉매 성능을 증가시킬 것으로 보인다. 환원을 통한 촉매의 성능은 0.05Pd/Al2O3 촉매를 사용하여 비교되었다. 촉매는 H2-O2 재결합 반응 전에 추가적인 환원 과정을 진행하였으며, 결과는 Fig. 9에 나타내었다. 환원 조건은 촉매 제작에 사용한 것과 동일하게 진행되었다. 0.05Pd/Al2O3 촉매에 1번의 추가 환원을 진행한 촉매(Fig. 9, 사각형)는 10 ppm의 잔여 산소 농도를 나타냈으며, 기존 5 ppm의 잔여 산소 농도를 나타냈을 때보다 성능이 감소했다. 2번의 추가 환원을 진행한 촉매(Fig. 9, 원형)는 13시간의 연속반응 후 40 ppm의 잔여 산소 농도를 보여주었으며, 반응이 진행될수록 산소 제거 성능이 증가하는 경향을 보였다(Cu, Ni 촉매와 유사). 5번 이상의 추가 환원을 진행한 촉매(Fig. 9, 삼각형)는 14,669 ppm의 잔여 산소 농도를 보여주었으며, 대부분의 촉매 활성이 사라졌다. 추가적인 환원 과정은 오히려 촉매의 영구적인 비활성화를 유도하는 역할을 하였다. 반응 전후의 촉매의 표면 상태 변화를 확인하기 위한 XPS 분석을 진행하였다. XPS 분석에는 0.5M/Al2O3 (M-Pd, Pt, Cu, Ni) 촉매가 사용되었으며 결과는 Fig. 10에 나타내었다. 반응 전 모든 촉매는 Al (metal) 또는 M/Al2O3 (Fig. 10[a], red line)가 형성되는 것을 확인할 수 있었다. Bare γ-Al2O3에서 74.3 eV를 갖는 Al-O 결합(Fig. 10[a], blue line)은 금속과의 상호작용으로 인해 촉매에서 결합에너지가 감소하는 것을 확인할 수 있다. 촉매의 O 1s 스펙트럼에서는 지지체로 사용된 γ-Al2O3보다 결합에너지가 낮은 O-M (M-Pd, Pt, Cu, Ni) (Fig. 10[b], red line) 피크들을 확인할 수 있었다. 산소 결손 부위(Ov) (Fig. 10[b], green line)의 결합에너지는 γ-Al2O3보다 높게 나타났다. 이는 Ov 주변 분자의 전기음성도가 γ-Al2O3보다 높기 때문에 발생한다. γ-Al2O3에서 Ov 주변 화학종은 Al과 O이며 전기음성도는 각각 1.61, 3.44이다. Pd, Pt, Cu, Ni의 전기음성도는 각각 2.20, 2.28, 1.90, 1.91이다. Ov 주변에 O 대신 전기음성도가 낮은 금속이 존재하면 Ov의 결합에너지는 증가하고, 반대로 전기음성도가 높은 O가 존재하면 결합에너지가 감소한다. Pd와 Ni 촉매의 경우 Ov의 결합에너지가 528.9, 529.3 eV로 증가하는 것을 확인할 수 있었고, Pt와 Cu 촉매의 경우 결합에너지는 527.5, 527.6 eV로 큰 변화가 없었지만 Ov의 비율이 증가하는 것을 확인할 수 있었다. Pt와 Cu 촉매에서의 Ov 비율의 증가는 H2-TPR에서 Pt와 Cu 촉매가 다양한 환원 피크를 나타냈던 결과와 일치한다. Ni 촉매에서 나타나는 가장 강한 Ov 결합에너지 역시 H2-TPR 분석에서 가장 높은 온도에서 환원 피크를 나타낸 결과와 일치한다.
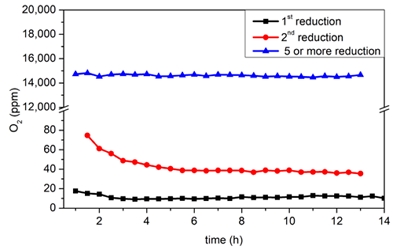
The effect of reduction on the deoxo performance of 0.05Pd/Al2O3. Inlet gas: H2 98% and O2 2% 2,083/h GHSV
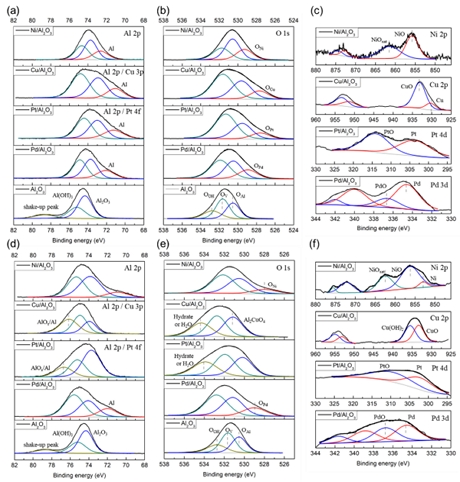
XPS results of 0.5M/Al2O3 catalysts (a) Al 2p, (b) O 1s, (c) metal peaks before reduction, and (d) Al 2p, (e) O 1s, (f) metal peaks after reduction
비활성화된 촉매에 대한 XPS 결과는 Fig. 10(d)-(f)에서 확인할 수 있다. Al 2p 스펙트럼(Fig. 10[d])에서 모든 촉매들은 Al2O3 및 Al(OH)3 결합에너지의 전반적인 증가를 보여주었다. 이는 Al 주변에서 O와 같이 높은 전기음성도를 가진 원소가 감소했음을 의미한다. Pd와 Ni 촉매에서는 여전히 금속의 피크가 확인 되었지만, Pt와 Cu 촉매에서는 해당 피크가 사라지고 AlOx/Al (metal)에 해당하는 피크가 나타났다. O 1s 스펙트럼(Fig. 10[e])에서 역시 Pd와 Ni 촉매는 금속산화물(Fig. 10[e], red line)에 해당하는 피크가 확인되었지만, Pt와 Cu 촉매에서는 해당 피크가 사라진 것을 확인할 수 있었다.
Pd 촉매에서는 환원이 진행됨에 따라 Pd와 결합된 Ov의 결합에너지가 증가하였고, 이는 H2로 인한 격자 O의 분해가 발생했음을 의미한다. 가장 가능성 있는 메커니즘은 수소와 산소의 결합으로 인한 분해이다. 이러한 분해 과정은 수소 친화성이 높은 Pd 주변에서 우선적으로 발생할 것으로 예상된다. Pd 주변 산소의 감소는 H2-O2 재결합 반응에 필요한 산소 결합 부위의 감소를 의미하며, 이는 촉매반응에 필요한 산소 전달의 감소를 야기한다. 또한 표면 산소의 분해는 지지체 표면 전하의 불균형을 유발하여 반응물 또는 생성물과의 결합을 발생시키게 된다. 이러한 촉매 표면의 변화는 영구적인 촉매의 비활성화를 유발할 수 있다.
Pt 촉매는 환원이 진행되면 γ-Al2O3와 상호작용하지 않고 강한 Pt-H 상호작용을 통해 나노미터 이하의 클러스터 형태로 존재한다40). 이는 지지체를 통한 반응물의 이동을 감소시키며, 지지체와 Pt의 상호작용 감소는 촉매의 안정성을 감소시킬 수 있다.
Cu 촉매는 높은 산소 친화성으로 인해 표면 Cu종의 82%가 CuO 형태로 존재한다. 환원이 진행되면 Cu는 γ-Al2O3의 격자 산소와 결합하여 Al2CuO4의 형태로 존재한다41). 환원 과정 동안 촉매 표면에 형성된 CuO에서 O가 비교적 쉽게 제거되고, 남아있는 Cu는 Al2O3의 격자 구조의 산소와 결합하여 Al2CuO4를 형성하는 것으로 보인다. Al2CuO4를 형성하면서 Cu는 보다 많은 산소와 결합하게 되고 이는 Fig. 10(c)에서 존재하던 Cu가 감소하고 Fig. 10(f)에서 CuO종이 증가하는 것을 통해 확인할 수 있다. O 1 s의 결과에 나타나는 Cu 촉매의 Ov의 감소와 OAl피크의 결합에너지 증가 역시 Al2CuO4 형성으로 인한 Ov의 감소, OAl 주변에 Al보다 전자 친화도가 높은 Cu, O의 증가가 원인으로 보인다. 격자 구조 내의 Al2CuO4 형성은 Ov와 유사하게 반응물과의 접촉을 감소시키게 되며 이는 촉매 성능의 감소로 이어지게 된다.
Ni 촉매는 Ni과 지지체 간의 강한 결합으로 인해 촉매에 높은 안정성을 제공한다. 그러나 강한 결합으로 인해 대부분의 Ni은 NiOx 형태로 존재한다. H2 및 O2 화학 흡착의 결과는 NiOx가 높은 H2 흡착과 매우 낮은 O2 흡착을 나타내는 것을 보여준다. 환원 과정은 촉매 표면 금속 Ni의 비율을 증가시키며 이는 환원을 통한 금속 Ni의 증가를 통해 촉매의 성능을 증가시킬 수 있어 보인다. 하지만 NiOsat 또한 증가하게 되며, 이는 Cu 촉매에서와 유사하게 표면 NiO에서 O가 제거된 후 Al2O3의 산소와 결합이 발생하는 것으로 보인다. 표면 NiOsat의 증가는 NiOsat 사이의 Ov의 증가와 함께 H2의 흡착은 증가하지만, 반응의 한계물질인 O2의 흡착은 더욱 줄어 촉매 성능이 감소하는 것으로 보인다.
정리하자면 Ov가 촉매에 미치는 영향은 다음과 같다. Pd에서는 주변 산소의 결함을 통한 반응물 전달 감소, Pt에서는 산소와의 결합 감소로 인한 Pt-H 형성과 이로 인한 반응물 전달 및 안정성 감소, Cu에서는 격자 산소의 분해로 Cu의 격자 내 이동으로 인한 반응물 전달 감소, Ni에서는 표면 Ni과 NiOsat가 증가를 통한 반응물 전달 감소를 발생시키며, 모든 촉매에서 반응물의 전달을 감소시키는 결과를 나타낼 것으로 예상된다.
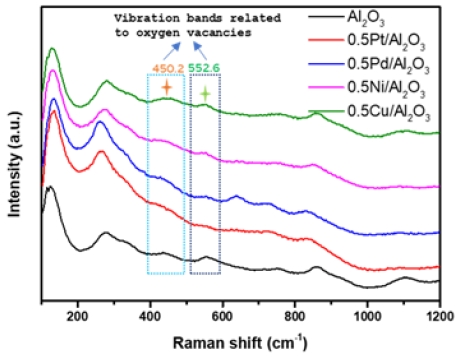
XPS 결과는 표면 Ov가 반응물의 흡착에 큰 영향을 미치며, Ov로 인해 촉매의 성능이 변화될 수 있음을 시사한다. 이러한 관찰을 뒷받침하기 위해 라만 분석을 통해 제작된 0.5M/Al2O3 촉매의 Ov를 비교했다(Fig. 11). 라만 분석은 90-1,250/cm 범위에서 측정되었다. 라만 스펙트럼에서는 γ-Al2O3의 Al-O-Al의 symmetric stretching vibration, bending mode와 산소의 vibration과 관련된 피크를 확인할 수 있다. Ov에 의한 vibration band는 450.2/cm와 552.6/cm 부근에서 나타난다42,43). Ov관련 vibration band는 낮은 산소 제거 성능을 보인 Cu, Ni 촉매에서 강하게 나타나는 것을 확인할 수 있었고, 높은 산소 제거 성능을 나타냈던 Pd, Pt 촉매에서는 약하게 나타나는 것을 확인할 수 있다.
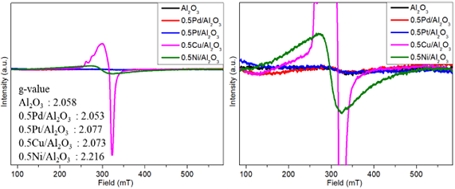
전자 스핀 공명(electron spin resonance, ESR) 분석은 상자성 물질의 자기 특성 변화를 확인하는 효과적인 방법이다. ESR 결과는 Fig. 12에 나타내었다. Al2O3, 0.5Pd/Al2O3, 0.5Pt/Al2O3, 0.5Cu/Al2O3, 0.5Ni/Al2O3에 대한 g-value는 각각 2.058, 2.077, 2.053, 2.073, 2.216로 관찰되었다. 일반적으로 Pd와 Pt종은 짝을 이루는 전자가 부족하기 때문에 다른 피크는 관찰되지 않았다. 0.5Ni/Al2O3 촉매에서는 Ni2+에 기인한 피크가 관찰되었다. 0.5Cu/Al2O3 촉매는 다양한 Cu종과 관련된 피크를 확인할 수 있었다. Cu2+ 이온은 약 2.1-2.3의 g-value를 나타내는 단일 선 스펙트럼을 생성하고, Cu+종은 2.0-2.4의 g-value를 갖는 여러 선 스펙트럼을 나타낼 수 있다.
ESR 분석 결과에서는 Pd 촉매는 Al2O3에 비해 g-value가 감소하였고, 다른 촉매들의 g-value는 증가하는 것을 확인할 수 있었다. g-value 값이 높을수록 짝을 이루지 않은 전자가 더 가벼운 원소에 가깝게 존재하거나, 더 비편재화되어 있음을 의미한다. Pd 촉매에서 나타난 g-value의 감소는 전자가 보다 무거운 원소인 Pd에 가깝게 존재함을 알 수 있다. Raman 분석에서 보다 많은 Ov를 보여준 Cu, Ni 촉매는 g-value가 증가했고, 이는 전자가 보다 가벼운 원소인 산소에 가깝거나 더욱 비편재화되어 존재함을 나타낸다. 해당 결과는 Ov의 존재가 주반응을 금속에서 지지체로 이동시키며, 원치 않는 부반응으로 인한 성능의 하락을 유발할 수 있다.
Chen 등44)은 density functional theory (DFT) 계산과 동역학 모델링을 사용하여 Pd 촉매에서 H2와 O2가 H2O2를 형성하는 반응 메커니즘 연구를 진행했다. PdH (111) 영역에 대한 O의 흡열 흡착과 달리 step site의 가장자리인 PdH (211) 영역은 O에 대해 발열 흡착을 제공한다. Fig. 13(a)에서처럼 일반적인 상태에서 산소는 금속 주변 step site 가장자리에 쉽게 흡착된다. Fig. 13(b)와 같이 금속 주변에 발생하는 Ov는 금속의 결정구조 변형을 유발하고 촉매 활성점으로 산소 전달을 감소시키게 된다. ESR 결과에서와 같이 Ov에서는 산소 부위에 주로 전자가 분포하게 되고, Fig. 13(c)-(e)에 나타난 것처럼 반응물 또는 생성물과 결합하여 새로운 표면을 형성할 수 있다. 이는 Fig. 13(a)의 표면 상태보다 더 안정적일 수 있으며, 촉매의 표면을 영구적으로 변형하고 활성점을 줄일 수 있다45).
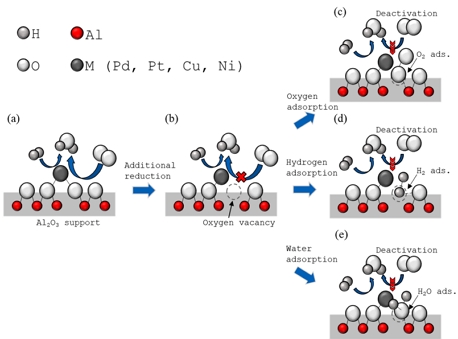
Catalyst deactivation process due to the formation of oxygen vacancy and decrease of the active sites (a) Typical surface adsorption phase (b) Formation of surface oxygen vacancies due to reduction. (c) adsorption of oxygen into oxygen vacancies. (d) adsorption of hydrogen into oxygen vacancies. (e) adsorption of water into oxygen vacancies.
4. 결 론
본 연구에서는 고농도의 H2 스트림 내에 존재하는 O2를 H2-O2 재결합 반응으로 제거하여 H2의 순도를 유지하기 위한 다양한 xM/Al2O3 촉매의 성능을 테스트 했다. Wet impregnation을 통해 합성된 촉매들은 2% 의 O2가 포함된 H2를 2083 GHSV로 주입시키며 잔여 산소의 농도를 가스 분석기-pulsed discharge detector (GC-PDD)로 분석하였다. 가장 좋은 성능을 나타낸 Pd/Al2O3 촉매는 0.1 wt.%의 낮은 금속 함량에서도 2%의 O2를 3-4 ppm으로 감소시켰다. 촉매는 0.05 wt.%의 금속 함량에서 500시간의 연속 반응에서도 10 ppm 이하의 산소 농도를 유지했다. 촉매의 산소 제거 성능에는 지지체 표면 산소의 영향이 크게 작용하는 것으로 보인다. 높은 산소 제거 성능을 보인 Pd, Pt 촉매와 달리 Cu 촉매는 높은 산소 친화성으로 인해 표면에서 CuO종을 형성하는데, 이는 촉매 표면 금속 부위를 감소시키게 된다. Ni 촉매는 강한 NiO 결합 형성을 통해 표면 산소가 증가하고, 이로 인한 산소 흡착의 감소가 낮은 성능의 원인으로 보인다. 이러한 촉매들은 Ov의 비율 역시 높게 나타났다. Ov는 전자를 산소 주변에 주로 존재하게 하며, 주반응을 금속에서 산소로 이동시키는 것으로 보인다. 산소에서의 반응은 촉매 표면을 변형시켜 영구적인 비활성화를 유발할 수 있다. 따라서 촉매의 산소 제거 성능 향상과 촉매의 비활성화를 감소시키기 위해서는 표면 Ov의 감소가 필수적임을 확인할 수 있다. 본 연구 결과에서 Pd와 Pt 촉매는 ISO-14687-2에 제시된 PEM 연료전지 도로 차량 시스템용 기체 수소 연료에 적합한 O2 함량을 보여주었다. 하지만 높은 Pd와 Pt의 비용은 촉매의 상업화를 위한 걸림돌로 작용할 수 있다. 본 연구에서 밝혀진 H2-O2 재결합 촉매에서 Ov의 영향은 향후 촉매의 귀금속 함량을 줄일 수 있고, 보다 저렴한 촉매 제조에 유용할 것으로 사료된다.
Acknowledgments
본 연구는 2023년도 중소벤처기업부의 기술개발사업(RS-2023-00257435)과 2021년도 교육부의 재원으로 한국연구재단의 지자체-대학 협력기반 지역혁신 사업의(2021RIS-004) 지원을 받아 진행되었으며 이에 감사드립니다.
References
-
A. Buttler and H. Spliethoff, “Current status of water electrolysis for energy storage, grid balancing and sector coupling via power-to-gas and power-to-liquids: a review”, Renewable and Sustainable Energy Reviews, Vol. 82, Pt. 3, 2018, pp. 2440-2454.
[https://doi.org/10.1016/j.rser.2017.09.003]

-
A. Klerke, C. H. Christensen, J. K. Nørskov, and T. Vegge, “Ammonia for hydrogen storage: challenges and opportunities”, Journal of Materials Chemistry, Vol. 18, No. 20, 2008, pp. 2304-2310.
[https://doi.org/10.1039/B720020J]

-
A. Marshall, B. Børresen, G. Hagen, M. Tsypkin, and R. Tunold, “Hydrogen production by advanced proton exchange membrane (PEM) water electrolysers-reduced energy consumption by improved electrocatalysis”, Energy, Vol. 32, No. 4, 2007, pp. 431-436.
[https://doi.org/10.1016/j.energy.2006.07.014]

-
W. Tong, M. Forster, F. Dionigi, S. Dresp, R. S. Erami, P. Strasser, A. J. Cowan, and P. Farràs, “Electrolysis of low-grade and saline surface water”, Nature Energy, Vol. 5, 2020, pp. 367-377.
[https://doi.org/10.1038/s41560-020-0550-8]

-
O. Schmidt, A. Gambhir, I. Staffell, A. Hawkes, J. Nelson, and S. Few, “Future cost and performance of water electrolysis: an expert elicitation study”, International Journal of Hydrogen Energy, Vol. 42, No. 52, 2017, pp. 30470-30492.
[https://doi.org/10.1016/j.ijhydene.2017.10.045]

-
J. D. Holladay, J. Hu, D. L. King, and Y. Wang, “An overview of hydrogen production technologies”, Catalysis Today, Vol. 139, No. 4, 2009, pp. 244-260.
[https://doi.org/10.1016/j.cattod.2008.08.039]

-
P. Nikolaidis and A. Poullikkas, “A comparative overview of hydrogen production processes”, Renewable and Sustainable Energy Reviews, Vol. 67, 2017, pp. 597-611.
[https://doi.org/10.1016/j.rser.2016.09.044]

-
C. Kim, G. Kim, and H. Kim, “Analysis of domestic and foreign policy and technology trends for hydrogen industry development”, Journal of Hydrogen and New Energy, Vol. 34, No. 2, 2023, pp. 122-131.
[https://doi.org/10.7316/JHNE.2023.34.2.122]

-
H. Lee, B. Lee, M. Byun, and H. Lim, “Economic and environmental analysis for PEM water electrolysis based on replacement moment and renewable electricity resources”, Energy Conversion and Management, Vol. 224, 2020, pp. 113477.
[https://doi.org/10.1016/j.enconman.2020.113477]

-
A. Li, Y. Sun, T. Yao, and H. Han, “Earth-abundant transition-metal-based electrocatalysts for water electrolysis to produce renewable hydrogen”, Chemistry: A European Journal, Vol. 24, No. 69, 2018, pp. 18334-18355.
[https://doi.org/10.1002/chem.201803749]

-
F. Barbir, “PEM electrolysis for production of hydrogen from renewable energy sources”, Solar Energy, Vol. 78, No. 5, 2005, pp. 661-669.
[https://doi.org/10.1016/j.solener.2004.09.003]

-
J. Chi and H. Yu, “Water electrolysis based on renewable energy for hydrogen production”, Chinese Journal of Catalysis, Vol. 39, No. 3, 2018, pp. 390-394.
[https://doi.org/10.1016/S1872-2067(17)62949-8]

-
S. Lee, H. S. Cho, W. C. Cho, S. K. Kim, Y. Cho, and C. H. Kim, “Operational durability of three-dimensional Ni-Fe layered double hydroxide electrocatalyst for water oxidation”, Electrochimica Acta, Vol. 315, 2019, pp. 94-101.
[https://doi.org/10.1016/j.electacta.2019.05.088]

-
C. Spöri, J. T. H. Kwan, A. Bonakdarpour, D. P. Wilkinson, and P. Strasser, “The stability challenges of oxygen evolving catalysts: towards a common fundamental understanding and mitigation of catalyst degradation”, Angewandte Chemie, Vol. 56, No. 22, 2017, pp. 5994-6021.
[https://doi.org/10.1002/anie.201608601]

-
G. Li, L. Anderson, Y. Chen, M. Pan, and P. Y. A. Chuang, “New insights into evaluating catalyst activity and stability for oxygen evolution reactions in alkaline media”, Sustainable Energy & Fuels, Vol. 2, No. 1, 2018, pp. 237-251.
[https://doi.org/10.1039/C7SE00337D]

-
S. Geiger, O. Kasian, A. M. Mingers, S. S. Nicley, K. Haenen, K. J. J. Mayrhofer, and S. Cherevko, “Catalyst stability benchmarking for the oxygen evolution reaction: the importance of backing electrode material and dissolution in accelerated aging studies”, ChemSusChem, Vol. 10, No. 21, 2017, pp. 4140-4143.
[https://doi.org/10.1002/cssc.201701523]

-
J. Brauns and T. Turek, “Alkaline water electrolysis powered by renewable energy: a review”, Processes, Vol. 8, No. 2, 2020, pp. 248.
[https://doi.org/10.3390/pr8020248]

- Y. S. Park, “Hydrogen tank explosion kills 2 in Gangneung”, The Korea Herald, 2019. Retrieved from https://www.koreaherald.com/view.php?ud=20190523000739#, .
-
V. Schröder, B. Emonts, H. Janßen, and H. P. Schulze, “Explosion limits of hydrogen/oxygen mixtures at initial pressures up to 200 bar”, Chemical Engineering & Technology, Vol. 27, No. 8, 2004, pp. 847-851.
[https://doi.org/10.1002/ceat.200403174]

-
E. Moretti, M. Lenarda, L. Storaro, A. Talon, R. Frattini, S. Polizzi, E. Rodríguez-Castellón, and A. Jiménez-López, “Catalytic purification of hydrogen streams by PROX on Cu supported on an organized mesoporous ceria-modified alumina”, Applied Catalysis B: Environmental, Vol. 72, No. 1-2, 2007, pp. 149-156.
[https://doi.org/10.1016/j.apcatb.2006.10.020]

-
A. Martínez-Arias, A. B. Hungría, M. Fernández-García, J. C. Conesa, and G. Munuera, “Preferential oxidation of CO in a H2-rich stream over CuO/CeO2 and CuO/(Ce,M)Ox (M = Zr, Tb) catalysts”, Journal of Power Sources, Vol. 151, 2005, pp. 32-42.
[https://doi.org/10.1016/j.jpowsour.2005.02.078]

-
P. K. Cheekatamarla, W. S. Epling, and A. M. Lane, “Selective low-temperature removal of carbon monoxide from hydrogen-rich fuels over Cu-Ce-Al catalysts”, Journal of Power Sources, Vol. 147, No. 1-2, 2005, pp. 178-183.
[https://doi.org/10.1016/j.jpowsour.2005.01.027]

-
Y. Pan, X. Shen, L. Yao, A. Bentalib, and Z. Peng, “Active sites in heterogeneous catalytic reaction on metal and metal oxide: theory and practice”, Catalysts, Vol. 8, No. 10, 2018, pp. 478.
[https://doi.org/10.3390/catal8100478]

-
L. Yang, C. Shi, X. He, and J. Cai, “Catalytic combustion of methane over PdO supported on Mg-modified alumina”, Applied Catalysis B: Environmental, Vol. 38, No. 2, 2002, pp. 117-125.
[https://doi.org/10.1016/S0926-3373(02)00034-6]

-
A. Barrera, M. Viniegra, P. Bosch, V. H. Lara, and S. Fuentes, “Pd/Al2O3-La2O3 catalysts prepared by sol-180gel: characterization and catalytic activity in the NO reduction by H2”, Applied Catalysis B: Environmental, Vol. 34, No. 2, 2001, pp. 97-111.
[https://doi.org/10.1016/S0926-3373(01)00206-5]

-
J. M. Kanervo, M. E. Harlin, A. O. I. Krause, and M. A. Bañares, “Characterisation of alumina-supported vanadium oxide catalysts by kinetic analysis of H2-TPR data”, Catalysis Today, Vol. 78, No. 1-4, 2003, pp. 171-180.
[https://doi.org/10.1016/S0920-5861(02)00326-7]

-
M. N. Kumar, B. Govindh, and N. Annapurna, “Green synthesis and characterization of platinum nanoparticles using sapindus mukorossi gaertn. Fruit pericarp”, Asian Journal of Chemistry, Vol. 29, No. 11, 2017, pp. 2541-2544.
[https://doi.org/10.14233/ajchem.2017.20842A]

-
R. Venu, T. S. Ramulu, S. Anandakumar, V. S. Rani, and C. G. Kim, “Bio-directed synthesis of platinum nanoparticles using aqueous honey solutions and their catalytic applications”, Colloids and Surfaces A: Physicochemical and Engineering Aspects, Vol. 384, No. 1-3, 2011, pp. 733-738.
[https://doi.org/10.1016/j.colsurfa.2011.05.045]

-
M. Raffi, S. Mehrwan, T. M. Bhatti, J. I. Akhter, A. Hameed, W. Yawar, and M. M. ul Hasan, “Investigations into the antibacterial behavior of copper nanoparticles against Escherichia coli”, Annals of Microbiology, Vol. 60, 2010, pp. 75-80.
[https://doi.org/10.1007/s13213-010-0015-6]

-
K. Narui, K. Furuta, H. Yata, A. Nishida, Y. Kohtoku, and T. Matsuzaki, “Catalytic activity of PdO/ZrO2 catalyst for methane combustion”, Catalysis Today, Vol. 45, No. 1-4, 1998, pp. 173-178.
[https://doi.org/10.1016/S0920-5861(98)00274-0]

-
M. Sun, J. Liu, C. Song, Y. Ogata, H. Rao, X. Zhao, H. Xu, and Y. Q. Chen, “Different reaction mechanisms of ammonia oxidation reaction on Pt/Al2O3 and Pt/CeZrO2 with various Pt states”, ACS Applied Materials & Interfaces, Vol. 11, No. 26, 2019, pp. 23102-23111.
[https://doi.org/10.1021/acsami.9b02128]

-
H. Pan, J. Li, J. Lu, G. Wang, W. Xie, P. Wu, and X. Li, “Selective hydrogenation of cinnamaldehyde with PtFex/Al2O3@ SBA-15 catalyst: enhancement in activity and selectivity to unsaturated alcohol by Pt-FeOx and Pt-Al2O3@SBA-15 interaction”, Journal of Catalysis, Vol. 354, 2017, pp. 24-36.
[https://doi.org/10.1016/j.jcat.2017.07.026]

-
N. E. Nuñez, H. P. Bideberripe, M. Mizrahi, J. M. Ramallo-López, M. L. Casella, and G. J. Siri, “CO selective oxidation using Co-promoted Pt/γ-Al2O3 catalysts”, International Journal of Hydrogen Energy, Vol. 41, No. 42, 2016, pp. 19005-19013.
[https://doi.org/10.1016/j.ijhydene.2016.08.170]

-
J. Z. Shyu and K. Otto, “Characterization of Pt/γ-alumina catalysts containing ceria”, Journal of Catalysis, Vol. 115, No. 1, 1989, pp. 16-23.
[https://doi.org/10.1016/0021-9517(89)90003-1]

-
I. Contreras, G. Pérez, and T. Viveros, “The influence of the support on the deactivation behaviour of Pt-Sn reforming catalysts”, International Journal of Chemical Reactor Engineering, Vol. 3, No. 1, 2005, pp. 1-14.
[https://doi.org/10.2202/1542-6580.1257]

-
W. P. Dow, Y. P. Wang, and T. J. Huang, “TPR and XRD studies of yttria-doped ceria/γ-alumina-supported copper oxide catalyst”, Applied Catalysis A: General, Vol. 190, No. 1-2, 2000, pp. 25-34.
[https://doi.org/10.1016/S0926-860X(99)00286-0]

-
Z. Yaakob, A. Bshish, A. Ebshish, S. M. Tasirin, and F. H. Alhasan, “Hydrogen production by steam reforming of ethanol over nickel catalysts supported on sol gel made alumina: influence of calcination temperature on supports”, Materials, Vol. 6, No. 6, 2013, pp. 2229-2239.
[https://doi.org/10.3390/ma6062229]

-
F. Negrier, É. Marceau, M. Che, and D. de Caro, “Role of ethylenediamine in the preparation of alumina-supported Ni catalysts from [Ni(en)2(H2O)2](NO3)2: from solution properties to nickel particles”, Comptes Rendus Chimie, Vol. 6, No. 2, 2003, pp. 231-240.
[https://doi.org/10.1016/S1631-0748(03)00026-2]

-
K. Zhao, Z. Li, and L. Bian, “CO2 methanation and co-methanation of CO and CO2 over Mn-promoted Ni/Al2O3 catalysts”, Frontiers of Chemical Science and Engineering, Vol. 10, 2016, pp. 273-280.
[https://doi.org/10.1007/s11705-016-1563-5]

-
C. Dessal, A. Sangnier, C. Chizallet, C. Dujardin, F. Morfin, J. L. Rousset, M. Aouine, M. Bugnet, P. Afanasiev, and L. Piccolo, “Atmosphere-dependent stability and mobility of ca-talytic Pt single atoms and clusters on γ-Al2O3”, Nanoscale, Vol. 11, No. 14, 2019, pp. 6897-6904.
[https://doi.org/10.1039/C9NR01641D]

-
I. S. Zhidkov, A. A. Belik, A. I. Kukharenko, S. O. Cholakh, L. S. Taran, A. Fujimori, S. V. Streltsov, and E. Z. Kurmaev, “Cu-site disorder in CuAl2O4 as studied by XPS spectroscopy”, JETP Letters, Vol. 114, 2021, pp. 556-560.
[https://doi.org/10.1134/S0021364021210062]

-
L. Zhang, S. Wang, L. Lv, Y. Ding, D. Tian, and S. Wang, “Insights into the reactive and deactivation mechanisms of manganese oxides for ozone elimination: the roles of surface oxygen species”, Langmuir, Vol. 37, No. 4, 2021, pp. 1410-1419.
[https://doi.org/10.1021/acs.langmuir.0c02841]

-
N. Magg, B. Immaraporn, J. B. Giorgi, T. Schroeder, M. Bäumer, J. Döbler, Z. Wu, E. Kondratenko, M. Cherian, M. Baerns, P. C. Stair, J. Sauer, and H. J. Freund, “Vibrational spectra of alumina- and silica-supported vanadia revisited: an experimental and theoretical model catalyst study”, Journal of Catalysis, Vol. 226, No. 1, 2004, pp. 88-100.
[https://doi.org/10.1016/j.jcat.2004.04.021]

-
L. Chen, J. W. Medlin, and H. Grönbeck, “On the reaction mechanism of direct H2O2 formation over Pd catalysts”, ACS Catalysis, Vol. 11, No. 5, 2021, pp. 2735-2745.
[https://doi.org/10.1021/acscatal.0c05548]

-
S. A. Acharya, V. M. Gaikwad, V. Sathe, and S. K. Kulkarni, “Influence of gadolinium doping on the structure and defects of ceria under fuel cell operating temperature”, Applied Physics Letters, Vol. 104, No. 11, 2014, pp. 113508.
[https://doi.org/10.1063/1.4869116]