암모니아/메탄 예혼합 대향류 대칭화염에 관한 수치해석적 연구 : PartⅠ 소화거동의 특성
2023 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
Experimental data conducted by Colson et al. and numerical data conducted in this study were compared through counterflow flames to understand of the characteristic of basic flame about mixture of ammonia/methane. In order to use the suitable numerical mechanism, the validation was performed using total four mechanisms and the Okafor’s mechanism showed satisfactory experimental results. The extinction boundary of the stability map could be explained through the effective Lewis number and the trend of LeD. The extinction behavior of the flame was different under the lean and rich symmetric conditions and it was investigated by the major variables, global strain rate (αg) and mole fraction of ammonia (ΩNH3).
Keywords:
Symmetric flame, Ammonia, Extinction boundary, Extinction behavior, Interaction키워드:
대칭화염, 암모니아, 소화경계, 소화거동, 상호작용1. 서 론
온실가스에 의한 지구 온난화와 기후 변화에 대응하기 위해 전 세계적으로 다양한 노력이 요구되고 있다. 이를 해결하기 위해 2015년 파리협정의 국제조약이 진행되었으며 우리나라도 2030년 온실가스 감축 목표로써 2018년 대비 40% 감축1)하는 것을 설정함에 따라 기존 발전 및 에너지원이 수소경제와 지속 가능한 신재생에너지를 비롯한 무탄소 에너지원으로 대체되는 것이 필수적이다2). 온실가스(CO2)의 총 배출량 저감을 위해 기존 고탄소 계열의 연료를 대체하기 위한 많은 연구가 진행되고 있다. 특히 수소(H2)는 탄소 성분이 없어 연소시켰을 때 이산화탄소(CO2)를 배출하지 않는 무탄소 연료로, 수송과 연료전지 그리고 기초 연소 등 다양한 방법으로 활용하는 연구가 진행되고 있다. 그러나 수소의 특징인 높은 반응성과 낮은 자연발화 온도로 인해 폭발의 위험이 있으며 액화 시 어려움이 있어 저장과 이송이 용이하지 않다는 문제점이 제기되어 왔다3).
수소와 같은 무탄소 친환경 연료로 암모니아(NH3)는 낮은 반응성과 높은 자연발화 온도로 폭발의 위험이 적으며 비교적 높은 온도에서도 액화가 용이하여 저장과 이송에 있어 수소보다 경제적으로 저렴하다. 또한, 암모니아는 단위 부피당 수소 저장 밀도가 높으며 수소 함량이 질량 기준으로 17.8%이기 때문에 수소 에너지 캐리어4,5)는 물론 직접 연료로도 적용이 가능해 미래의 유망한 대체 연료로 주목받고 있다. 그러나 암모니아는 기존 탄화수소 연료에 비해 연소 속도가 상대적으로 낮으며, 가연성 범위가 좁고 최소 점화 에너지가 높다는 단점이 있다6). 이러한 암모니아의 연소 성능을 향상시키기 위한 방안으로 암모니아에 수소나7,8) 메탄9-15) 등 다른 연료를 혼합하여 연소시키거나 산소부하 및 순산소15,16)로 연소시키는 방법이 고려되었다. 이와 같이 암모니아가 무탄소 연료로써 자리매김하기 위해서는 암모니아가 포함된 연료들의 기초 연소 특성을 파악하는 연구들이 반드시 선행되어야 한다.
본 연구에서는 화염의 구조 및 소화거동을 연구하기 위하여 대향류 유동장에서 생성되는 평면화염을 이용하였다. 대향류 유동장에서 생성되는 층류 예혼합 화염의 화염 구조(flame structure)와 소화거동에 영향을 미치는 인자는 크게 3가지로, 유동장(flow)의 영향, 연료의 확산도(diffusivity), 화염의 열손실(heat loss)로 분류될 수 있다17). 이 중에서 화염의 소화거동은 연료의 열 확산도(thermal diffusivity, α)와 질량 확산도(mass diffusivity, Di)의 비로 정의되는 루이스 수(Lewis number, Le)가 중요한 인자로 작용하게 된다18). Law19)는 자유 전파하는 예혼합 화염에서 Le >1에 해당하는 과농 조건의 메탄(CH4)과 수소(H2), 희박 조건의 프로판(C3H8)인 경우 신장률이 증가함에 따라 화염 온도가 감소하고 화염이 정체면(stagnation plane, SP)으로부터 일정한 거리에서 발생하며, Le <1에 해당되는 희박 조건의 메탄(CH4)과 수소(H2), 과농 조건의 프로판(C3H8)인 경우는 화염 온도가 증가하다 감소하고 화염은 SP 근처에서 발생하는 특성이 있다고 보고하였다. 또한, 상호작용하는 화염에서 Le >1인 경우 열 확산도(α)가 물질 확산도(Di)에 비해 크기 때문에 두 화염이 SP로부터 일정한 거리를 가지며 화염 간의 상호작용이 약하게 나타나고, Le <1인 경우 물질 확산도가 열 확산도에 비해 크기 때문에 화염이 SP 근처에서 발생하며 화염 간의 상호작용이 강해진다. 심지어 대칭 조건(symmetry condition)에서도 화염대가 하나로 병합(merging)하는 특성이 나타난다고 보고하였다18,20,21).
이처럼 화염 간의 상호작용(interaction)은 연료와 조성비에 따라 매우 상이하게 나타나게 되는데, 암모니아와 메탄이 혼합된 혼합연료에서 화염의 소화거동과 상호작용에 관한 연구는 아직까지 매우 부족한 실정이다. 따라서 본 연구에서는 최근 무탄소 연료로 각광받고 있는 암모니아를 천연가스와 혼소(混燒)할 목적으로 기존 liquefied natural gas (LNG) 연료의 주성분인 메탄에 첨가하여 예혼합 화염 사이에서 발생하는 화염 간의 활발한 상호작용을 파악하고, 상호작용하는 화염의 소화거동과 소화체계를 수치해석적 연구를 통해 분석하고자 한다.
2. 수치해석 방법 및 조건
2.1 수치해석 모델
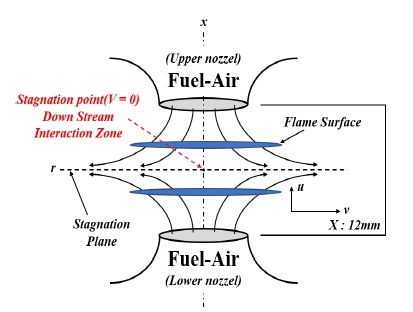
본 연구에서는 대향류 유동장에서 정체면(stagnation plane, SP) 기준으로 생성되는 두 개의 예혼합 화염을 모사하고 이들 화염 사이의 후류 상호작용에 대하여 알아보기 위해 ANSYS Chemkin Pro의 OPPDIF-code를 사용하여 수치해석을 수행하였다. 해석에 사용된 대향류 화염의 형상을 Fig. 1에 도시하였다. 수치해석 모델인 OPPDIF-code는 SP 주위에서 발생하는 유동장의 상사성(similarity)을 이용하여 화염의 구조를 수학적으로 간단하게 1차원으로 가정함으로써 해석이 용이하게 한 방법으로 Kee 등22)에 의해 개발되었고 Lutz 등23)에 의해 확장되었다.
해석에 필요한 지배방정식에는 에너지, 화학종, 질량, 운동량 보존방정식이 사용되었으며 이때 실제 화염을 모사하기 위하여 화염의 복사 열손실을 고려한 광학적으로 얇은 모델(optical thin model)을 적용하였다24). 또한 화학종 확산계수는 mixture-averaged diffusivity를 이용하여 계산을 수행하였다. 수치해석 시 주위 조건은 1 atm, 298 K로 고정하였으며, 상하부 노즐의 거리는 추후 암모니아 혼합률에 따른 실험을 진행하기에 적절한 거리인 12 mm로 설정하였다. 적응 격자(adaptive grid)는 노즐 사이에서 발생하는 화염 간의 상호작용 현상을 세밀하게 관찰하기 위하여 최소 600개 이상으로 수행하였다. 상세 화학반응기구는 암모니아/메탄 혼합물의 정확한 수치해석을 위하여 3.1절에서와 같이 다양한 화학반응기구를 비교하여 선정하였다.
2.2 주요 변수 정의
예혼합 화염에서 암모니아/메탄의 연료 혼합물은 식 (1)로 정의되며 ΩCH4, ΩNH3는 각각 메탄과 암모니아의 몰분율(mole fraction)을 의미한다. 암모니아의 혼합률은 연료별 발열량이 고려된 열 비(heat ratio, ENH3)로 정의되며 식 (2)에 나타내었다. 여기서 LHV는 연료별 저위 발열량(lower heating value)이며 메탄과 암모니아의 저위 발열량은 각각 802.30 kJ/mol, 316.84 kJ/mol이다.
| (1) |
| (2) |
본 연구에서 사용된 주요 변수 조건인 전체 신장률(global strain rate, ɑg)은 식 (3)을 통하여 정의된다.
| (3) |
여기서 V는 상하부 각 노즐 출구에서 분사되는 혼합물의 축방향 속도(axial velocity), X는 두 노즐 간의 거리로 본 연구에서는 12 mm로 설정하였으며, 하첨자 U, L은 각각 상부 노즐(upper nozzle)과 하부 노즐(lower nozzle)을 의미한다. 또 다른 변수 조건으로 암모니아의 몰분율(mole fraction of NH3, ΩNH3)이 사용되며, 이는 식 (4)로 정의된다. 여기서 Yi는 전체 화학종의 몰분율이며, 암모니아의 몰분율은 전체 화학종의 몰분율과 NH3의 몰분율의 비로 나타내었다.
| (4) |
수치해석에 사용되는 연료 혼합률 및 주요 변수 조건들을 Table 1에 정리하여 도시하였다.
3. 결과 및 고찰
3.1 반응기구 검증
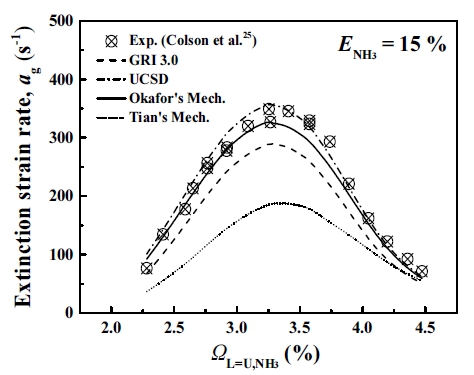
메탄에 암모니아가 첨가된 혼합연료의 특징으로 인하여 기존 단일연료에 맞추어진 화학반응기구를 그대로 적용하기에는 연구의 타당성에 문제가 제기된다. 따라서 본 연구에서는 혼합연료에 적절한 화학반응기구의 선정을 위하여, Colson 등25)이 수행한 암모니아와 메탄 혼합연료의 실험적 소화경계를 이용하였으며 본 연구에서 수행한 여러 가지 화학 반응기구별 수치적 소화경계와 오차율을 검증하는 것으로 수치해석의 타당성을 높였다. 메탄에 암모니아 소량 첨가에 대한 기초 화염의 특성을 파악하고자 암모니아 혼합률을 15%로 선정하였다. Fig. 2는 기존의 4개 상세 화학반응기구를 이용하여 암모니아 혼합률 15%에서 암모니아 몰분율(ΩNH3)에 따른 소화경계를 Colson 등이 수행한 실험값과 비교한 결과를 보여주고 있다. 수치해석에 사용된 화학 반응기구로는 순수 CH4 연소 해석에 적합하나 NH3 화학종 반응과 일부 질소 화학을 포함하고 있는 GRI 3.026), C1-C3 계열의 탄화수소 반응과 탄화수소-질소 반응을 포함하고 있는 University of California San Diego (UCSD) mechanism27), GRI 3.0을 기반으로 NH3/CH4 혼합물에 대한 Tian’s mechanism의 화학종과 반응식을 추가한 Okafor’s mechanism28)과 CH4/NH3/O2/Ar 화염해석을 위해 개발되어 C-N 상호작용 반응식을 포함하고 있는 Tian’s mechanism29)으로 총 4개의 반응기구들을 사용하여 비교하였다.
비교한 결과 암모니아가 혼합된 메탄 혼합연료에서 화염 간 상호작용을 해석하기에 적합한 화학반응기구로써 GRI 3.0은 NH3/Air 화염의 층류 연소속도를 적절하게 재현하지만30), Fig. 2에서 보는 바와 같이 NH3/CH4 화염의 소화경계는 모든 조건에서 적절하게 재현하지 못하며 상당한 오차율(25.343%)을 보였다. Tian’s mechnaism도 실험값보다 상당히 낮은 소화경계를 보였으며, 오차율이 81.182%로 실험 결과를 전혀 재현하지 못했다. Fig. 2를 보면 이론 당량비(stoichiometry) 조건(ΩL=U,NH3=3.573%)보다 낮은 조건에서는 Okafor’s mechanism이 실험 결과를 잘 추종하였으나 NH3의 몰분율이 높아질수록 UCSD mechanism이 실험적 소화신장률과 비교적 잘 일치함을 알 수 있다. 이들 2개의 반응기구별 전체적인 오차율을 보면 Okafor’s mechanism은 8.424%의 오차율을, UCSD mechanism은 8.748%의 오차율을 보였다. 따라서 Okafor’s mechanism이 가장 적은 오차율을 가지며 실험적 소화경계를 충분히 만족하는 것으로 판단하였고, 이후 Okafor’s mechanism을 이용하여 수치해석을 진행하였다.
3.2 화염의 안정화 선도
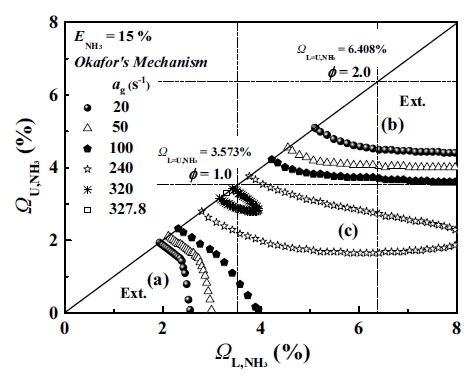
본 연구에서 주요 변수인 암모니아의 몰분율(ΩNH3)과 다양한 신장률(ɑg) 조건을 이용하여 암모니아/메탄 화염의 안정화 선도(stability map)를 Fig. 3에 나타내었다. Fig. 3에 표시된 소화경계는 앞서 검증된 Okafor’s mechanism을 이용하였으며 총 6가지의 신장률을 사용하였다. 이 경우 ΩU,NH3=0.03%의 간격으로 계산하여 화염이 생존하는 지점에서의 소화경계를 나타내었다. Fig. 3의 y축과 x축은 ΩU,NH3과 ΩL,NH3로 각각 상하부 노즐에서의 조건을 의미한다. 실선은 양단의 암모니아 몰분율이 동일한, 대칭화염의 조건(ΩL=U,NH3)이며, 점선은 이론 당량비 조건인 ϕ=1.0 (ΩL=U,NH3=3.573%)과 ϕ=2.0 (ΩL=U,NH3=6.408%)을 의미한다.
Fig. 3에서 보는 바와 같이 화염의 안정화 선도는 암모니아 연료의 혼합 조건(ΩNH3)에 따라 크게 3가지 화염으로 구분된다. Fig. 3에 도시된 안정화 선도에서 영역 (a)과 (b)는 ΩU,NH3 <3.573%, ΩL,NH3 <3.573%과 ΩU,NH3 >3.573%, ΩL,NH3 >3.573% 조건으로 각각 희박 및 과농 조건의 이중화염(double flame) 영역으로 구분된다. 영역 (c)는 ΩU,NH3 <3.573%, ΩL,NH3 >3.573%에 해당하는 조건으로 하부의 예혼합 연소 후 과잉된 산화제와 상부의 예혼합 연소 후 과잉된 연료로 인하여 두 화염 간 상호작용에 의해 화염 사이에서 확산화염(diffusion flame)을 형성하며 삼중화염(triple flame)의 구조가 나타나는 영역이다.
먼저, 안정화 선도에서 비교적 낮은 신장률인 20 s-1조건을 보면 희박 소화경계(lean extinction boundary, LEB)와 과농 소화경계(rich extinction boundary, REB)가 상이하게 나타나는 것을 볼 수 있다. LEB의 경우 REB에 비하여 선형적인 소화경계선을 형성하는 것이 아닌, 상당히 기울어진(slope) 소화경계선을 형성하고 있으며, 낮은 ΩU,NH3의 조건일수록 이러한 현상은 크게 나타나는 것을 알 수 있다. Chung 등31), Sim 등32), Kang 등33)의 연구에서도 동일한 현상이 관찰되었다. 이러한 현상을 이해하기 위해서는 루이스 수와 화염의 상호작용의 관계에 대해서 이해하여야 한다. 이전 연구에 따르면 상호작용하는 탄화수소 계열의 예혼합 화염은 부족반응물 루이스 수가 1보다 작은 조건인 경우(LeD <1) 기울어진 소화경계를 형성하며, 화염 간 강한 상호작용을 하는 것으로 보고되었다. 반면 1보다 큰 조건인 경우(LeD >1) 사각형 소화경계를 보여주며, 화염 간 약한 상호작용이 나타나는데, 이때 소화경계가 나타내는 기울기는 화염 간의 상호작용을 의미한다고 보고되고 있다. 또한 신장률의 증가로 LeD >1임에도 불구하고 좁아진 후류를 통하여 화염 간 활성 라디칼인 H, O, OH를 공유해 화학적 상호작용이 발생한다는 보고가 있다31-36).
일반적으로 단일연료가 아닌 다종연료의 루이스 수는 유효 루이스 수(Leeff)를 이용하여 해석해야 하므로 본 연구에서 혼합률 ENH3=15%의 유효 루이스 수는 체적 기준(volume based)으로 0.673≤ LeV,eff ≤1.179의 범위를 가지며, CH4의 부족반응물 루이스 수는 0.96≤ LeD ≤1.00, NH3는 0.95≤ LeD ≤1.01의 범위를 가진다. 따라서 Fig. 3에서 보는 바와 같이 안정화 선도의 LEB는 ΩL,NH3축의 수직선을 기준으로 기울어진 형상을 가지고, REB는 ΩU,NH3축에 대해 수직인 형상을 나타낸다. 이 경우 신장률 20 s-1의 LEB에서 단일화염(single flame)이 존재할 때 가연 한계는 ΩU,NH3=0, ΩL,NH3=2.56%로 나타났지만, 대칭화염 조건으로 ΩU,NH3이 증가함에 따라 가연 한계가 ΩL=U,NH3=1.93%로 확장되며 화염의 생존이 불가능한 조건에서 화염이 생존하는 것을 볼 수 있다. 또한 신장률이 20 s-1에서 100 s-1으로 증가함에 따라 단일화염의 조건과 대칭화염의 조건의 차이가 더 크게 벌어지는데 이는 신장률의 증가가 화염의 후류 간격을 감소시켜 화염 간의 상호작용을 증가시키는 것으로 볼 수 있다. REB도 단일화염 조건에서 대칭화염 조건으로 접근할수록 소화경계는 기울기를 가지며 확장하지만, 신장률의 증가는 평균적인 소화경계의 기울기를 감소시킨다. 이는 LEB와 달리, REB에서의 신장률의 증가는 화염의 상호작용을 약하게 만드는 것으로 이해할 수 있다. 또한 LEB와 REB에서 신장률의 증가로 화염의 소화경계 즉, 안정화 영역이 좁아지는 것을 볼 수 있는데, 지속적인 신장률의 증가는 LEB와 REB의 안정화 영역을 감소시켜 하나의 섬 모양의 형태를 보이며, 결국 신장률이 327.8 s-1에서 ϕ=1 즉, ΩL=U,NH3=3.573%보다 약간 낮은 대칭화염 조건인 ΩL=U,NH3=3.30%에서만 화염이 생존하게 된다. 이는 높은 신장률에서 LeV가 단일 수보다 작은 경우, 미연 혼합물들의 추가적인 반응을 통하여 약간 희박한 조건으로 내려온 것으로 보인다.
3.3 대칭화염의 소화거동
앞서 안정화 선도의 기울기는 체적 기준 루이스 수인 LeV를 통하여 희박 및 과농 조건에서의 화염의 소화거동을 설명할 수 있게 된다. LeV를 통한 화염거동에 대한 해석을 진행하기에 앞서 수치해석으로 화염의 위치를 조사하였다.
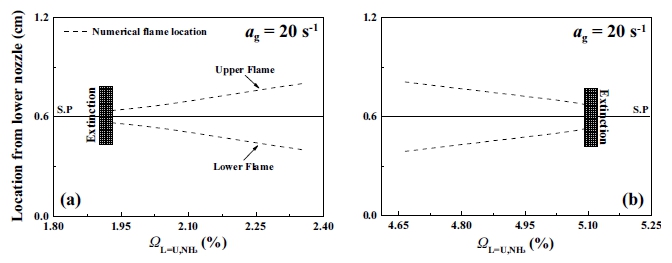
Fig. 4는 고정된 신장률 20 s-1에서 희박 및 과농 조건에서 상하부 노즐의 조건이 동일한 대칭화염의 위치를 보여주고 있다. 이 경우 화염의 위치는 열 방출률(heat release rate, HRR)이 최대인 지점을 화염대로 정의하였다. Fig. 4(a)의 희박 조건은 ΩL=U,NH3=2.351%에서 화염의 소화지점인 ΩL=U,NH3=1.896%까지 ΩL=U,NH3의 감소를 통하여, Fig. 4(b)의 과농 조건은 ΩL=U,NH3=4.753%에서 ΩL=U,NH3=5.124%까지 ΩL=U,NH3의 증가를 통하여 화염을 소화지점으로 유도하였으며, ΩL=U,NH3=0.01% 간격으로 계산을 수행하였다. 조사 결과, Fig. 4에서 나타난 바와 같이 소화지점에 가까울수록 희박 조건과 과농 조건 모두 층류 연소속도(laminar burning velocity, SL)의 감소로 화염 간의 위치가 가까워지는 것을 볼 수 있다. 희박 조건인 Fig. 4(a)의 경우 ΩL=U,NH3이 감소함에 따라 상부 화염과 하부 화염의 거리가 가까워지다 소화 직전에 화염 간 거리가 0.7 mm로 아주 가까워지며 소화된다. 반면 과농 조건인 Fig. 4(b)의 경우 ΩL=U,NH3가 증가함에 따라 희박 조건과 동일한 화염거동을 보이지만 소화 직전까지 화염 간 거리를 일정 이상 유지하면서 소화되는 것을 볼 수 있다. 화염의 위치를 통하여 희박 조건의 경우 ΩL=U,NH3의 감소로 인해 LeV 또한 지속적으로 감소하여 화염 간의 화학적 상호작용이 증가할 것으로 판단되며, 과농 조건의 경우 반대로 ΩL=U,NH3가 증가로 인해 LeV 또한 지속적으로 증가하여 화염 간 화학적 상호작용의 감소로 결국 화염의 소화를 이끄는 것으로 판단된다. 따라서 암모니아의 혼합률이 15%인 화염은 희박 조건일 때 LeV가 단일 수보다 낮아 높은 질량 확산도를 가지게 되며, 이는 미연 혼합기가 반응대로 빠르게 유입되어 두 화염 사이에서 발생하는 강한 화학적 공유를 통해 화염이 생존할 수 없는 몰분율을 넘어 새로운 소화경계를 형성하는 것을 보여준다. 반면 과농 조건일 때는 열 확산도가 질량 확산도보다 높아 신장률이 소화거동에 직접적으로 영향을 주는 것으로 보인다. 이러한 경향은 Fig. 3의 안정화 선도에서 보여지는 희박 및 과농 조건의 소화경계에서도 동일한 거동으로 확인할 수 있다. 그러나 화염 간의 거리 차이만으로 화염 내 화학적 상호작용의 유무를 판단하기에는 다소 부족하여 추가적인 분석이 요구된다.
본 절에서는 대칭화염의 후류 상호작용에 의한 화염의 소화거동을 주요 변수인 암모니아의 몰분율 ΩL=U,NH3의 변화와 신장률에 따른 영향을 관찰함으로써 대칭화염의 소화에 영향을 미치는 인자를 파악하고, 소화체계(extinctiom system)를 이해하고자 한다. Wilson and Fristrom37)에 따르면 OH 활성기의 생성률은 연소 시 전체 반응률(overall reaction rate)을 가늠할 수 있는 소위 척도 반응 활성기로 가정이 가능한 것으로 보고되었으므로 주요 변수 중 가장 먼저 신장률에 따른 OH 활성기의 생성률을 조사하였다. Fig. 5는 신장률 12 s-1에서 소화지점인 20 s-1까지 미세한 증가를 통하여 화염을 소화지점으로 유도하였을 때, 희박 소화경계와 과농 소화경계에서의 OH 활성기의 생성률을 보여준다. 여기서 화염의 후류 영역에서 유속이 0이 되는 지점인 SP를 dot 선으로 표시하였다. Fig. 5(a)의 희박 대칭 조건인 경우 OH 활성기의 생성률은 과농 조건보다 더 높게 나타나는 것을 볼 수 있다. 또한 신장률의 증가는 전체적인 OH 반응률의 증가를 유도하며 소화 직전 가장 큰 OH의 생성 반응과 소비 반응을 보인 후 소화하였고, OH의 생성 위치도 과농 조건에 비해 정체점에 가깝게 나타났다.
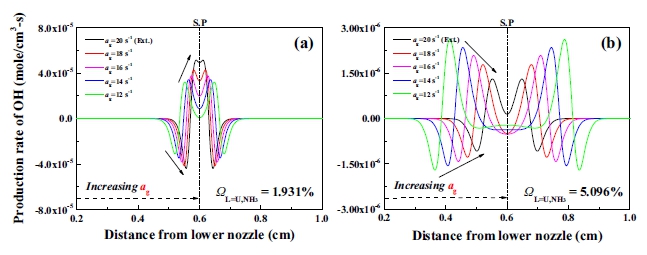
Extinction behavior of symmetric flames with increasing strain rate; (a) lean case and (b) rich case
희박 조건에서 신장률의 증가는 화염의 전체적인 연소 반응을 촉진시키며 대칭되는 화염에서도 화염의 화학적 상호작용이 활발하게 일어나고 있음을 보여주며, 이로 인해 Fig. 3의 희박 소화경계에서 단일화염에 해당하는 ΩU,NH3=0% 조건에서보다 대칭되는 이중화염 조건에서 화염의 안정화 영역이 넓게 나타나는 것으로 이해되었다. 반면 Fig. 5(b)의 과농 대칭 조건인 경우 점진적인 신장률의 증가는 OH 활성기의 생성 반응과 소비 반응이 감소하며 전체적으로 OH의 반응률이 감소하게 된다. 따라서 과농 대칭 조건의 화염에서는 신장률의 증가가 화염의 전체 반응을 감소시켜 소화체계의 직접적인 인자가 되는 것으로 이해할 수 있다.
또 다른 주요 변수인 몰분율 ΩL=U,NH3의 감소 및 증가함에 따른 희박 및 과농 대칭 조건의 소화거동을 낮은 신장률인 20 s-1과 비교적 높은 신장률인 240 s-1에서 비교한 것을 Fig. 6에 나타내었으며, 여기서 화염대를 의미하는 HRR과 소화지점에서 OH 활성기의 몰분율을 보여주고 있다. 이때 화염의 정확한 위치는 dash dot 선으로 표시하였고, 화염의 SP는 앞서 설명한 것과 같이 표시하였다. 신장률 20 s-1일 때 Fig. 6(a), (b)의 희박과 과농 대칭 조건은 같은 신장률 조건임에도 불구하고 희박 조건의 열 방출률은 과농 조건보다 더 높은 값을 가지며, 생성 위치 또한 SP에 가깝게 형성되었다. OH 활성기의 몰분율도 희박 조건에서 더 높은 생성률을 보였다. 반면, 신장률 240 s-1일 때 Fig. 6(c), (d)의 희박 및 과농 대칭 조건은 신장률 20 s-1에서 보인 소화거동과 다른 소화거동을 보였다. 신장률 240 s-1에서의 화염 간의 간격은 높은 신장률 조건하에 희박 및 과농 조건 모두 매우 좁지만 과농 조건의 열 방출률이 희박 조건보다 더 높은 값을 가졌으며, OH 활성기의 몰분율은 과농 조건보다 희박 조건에서 더 높은 생성률을 보였다.
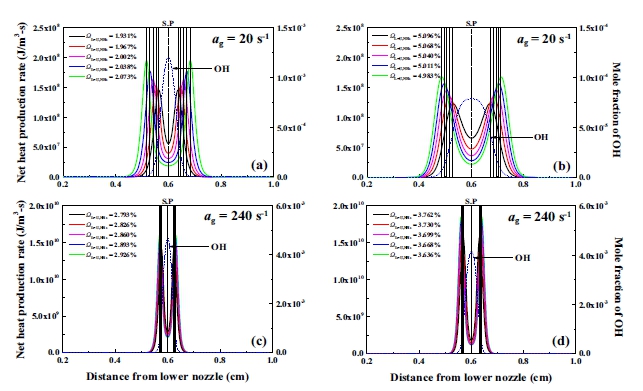
Heat production of extinction point and OH mole fraction. (a), (b) Lean case and rich case for ag=20 s-1, (c), (d) lean case and rich case for ɑg=240 s-1
Fig. 5과 Fig. 6을 통해서 희박 대칭 조건의 높은 OH 활성기는 화염의 후류 영역에서 추가적인 OH 활성기의 생성 반응을 통하여 만들어졌으며, 전체 반응률의 증가는 낮은 신장률의 희박 대칭 조건에서 소화경계의 특징이라고 생각할 수 있다. 높은 신장률의 과농 대칭 조건은 ΩL=U,NH3=3.762% 즉, 당량비가 1.06에 해당하므로 열 방출률은 희박 대칭 조건보다 높은 값을 가지나 과도한 스트레치 조건 아래 추가적인 OH 활성기의 생성에 있어 어려운 조건으로, 화염 간 라디칼 공유와 같은 화학적 상호작용이 약하게 나타나는 것으로 판단된다19,38).
본 절에서는 화염의 안정화 선도에서 나타낸 다양한 신장률 조건에서 OH 몰분율을 사용하여 화염의 소화거동을 분석하였다. Fig. 7은 대칭된 희박 조건(ΩL=U,NH3=2.793%)과 과농 조건(ΩL=U,NH3=3.762%)에서 신장률이 20 s-1에서 240 s-1까지 증가함에 따라 화염의 소화거동을 보여주고 있다. Fig. 7(a)의 희박 대칭 조건인 경우 신장률이 증가함에 따라 각각의 화염대의 거리는 감소하였으며, 이에 따라 OH 몰분율은 증가하여 신장률이 160 s-1에서 가장 높은 값을 나타내며 하나로 병합(merging)된 후 신장률이 증가함에 따라 OH 몰분율이 급속도로 감소하며 화염이 소화되었다. 반면 Fig. 7(b)의 과농 대칭 조건인 경우 신장률이 증가함에 따라 화염 간의 거리는 감소하지만, OH 몰분율도 지속적인 감소를 통하여 화염의 소화 조건인 신장률 240 s-1 직전까지 화염이 병합되지 못하였다. 이러한 경향들로 보아, 희박 조건에서는 신장률이 증가함에 따라 병합 현상 아래 주요 라디칼의 화학적 공유가 활발하여 화염 간의 상호작용이 활발히 일어나는 것으로 보이며, 과농 조건에서는 신장률의 증가가 화염의 소화에 직접적인 영향을 미치는 인자로 작용하며 희박 조건보다 화학적 상호작용이 비교적 약하게 일어나는 것으로 보인다.
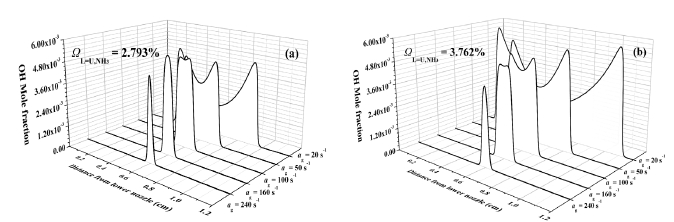
OH mole fraction of interacting NH3/CH4 premixed flames on symmetric condition with increasing strain rate in (a) lean case and (b) rich case
앞서 설명한 현상들을 보면, 루이스 수에 따라 화염의 소화거동이 희박 조건과 과농 조건으로 나누어져 상이하게 나타나는 것으로 확인되었다. 또한 주요 변수들을 통해서 화염 간 상호작용과 병합 현상에 대하여 살펴보았는데, 이러한 현상만으로 병합된 화염 내의 화학적 상호작용을 설명하기에는 다소 부족하다고 판단된다. 따라서 계속되는 Part Ⅱ 연구에서 소화지점 내 주요 화학종(major species)과 핵심 라디칼(key radicals)들의 생성률과 주요 반응 경로를 관찰하고자 한다.
4. 결 론
본 연구에서는 ANSYS Chemkin Pro의 OPPDIF-code를 사용하여 상호작용하는 암모니아/메탄 예혼합 화염의 소화거동을 수치해석적으로 관찰하였다. 대표적인 변수 조건으로는 노즐 간의 거리와 상하 노즐의 출구 속도를 통하여 정의되는 신장률(global strain rate, ɑg) 및 암모니아의 몰분율과 전체 예혼합 연료의 몰분율의 비로 나타낸 ΩNH3를 사용하여 다음과 같은 결론을 얻었다.
1) ENH3=15%에서 암모니아/메탄 혼합물의 소화경계는 다양한 상세 화학반응기구 중 Okafor’s mechnism이 가장 적은 오차율로 실험적 결과를 잘 예측하였다.
2) 안정화 선도에서 LEB와 REB를 통하여 화염 간의 상호작용이 상이하게 나타났으며, 이러한 거동은 LeV로 설명이 가능하였다.
3) 희박 조건과 과농 조건에서 화염의 위치는 소화 조건과 가까워질수록 두 조건 모두 감소하나, 희박 조건의 경우 화염 간의 거리가 상당히 가까워지며 과농 조건은 반대로 일정한 거리를 유지하며 소화되는 것을 확인하였다.
4) 화염의 전체 반응률을 가늠할 수 있는 척도 반응 활성기인 OH 활성기는 신장률이 증가함에 따라 희박 조건의 경우 신장률과 비례하는 경향을 보였으며, 과농 조건의 경우 반비례하는 경향을 보였다.
5) ɑg=20 s-1에서 열 방출률은 연료가 부족한 희박 조건에서 더 높은 수치와 OH 활성기의 몰분율을 가졌으며, 생성위치도 정체점에 가깝게 위치하였다. 반면 ɑg=240 s-1에서는 과농 조건이 더 높은 열 방출률이 나타났지만, OH 활성기의 몰분율은 희박 조건에서 더 높은 생성률을 보였다.
6) 다양한 신장률 조건에서 OH 활성기의 몰분율을 통하여 화염의 소화거동을 관찰하였다. 희박 조건에서 증가하는 신장률에 따라 OH 활성기의 몰분율 또한 증가하는 경향을 보이지만 ɑg=160 s-1인 조건에서 하나로 병합되는 현상을 보인 후 급속도로 감소한다. 반면 과농 조건에서 신장률의 증가에 따라 OH 활성기의 몰분율은 지속적인 감소를 통하여 화염의 소화를 이끄는 것으로 확인되었다.
Acknowledgments
본 논문은 순천대학교 교연비 사업에 의하여 연구되었음
References
- Presidential Commission on Carbon Neutrality and Green Growth, “2030 Nationally Determined Contributions (NDC)”, Presidential Commission on Carbon Neutrality and Green Growth, 2021. Retrieved from https://2050cnc.go.kr/base/contents/view?contentsNo=11&menuLevel=2&menuNo=13.
-
H. K. Lee, Y. M. Woo, and M. J. Lee, “The needs for R&D of amm-onia combustion technology for carbon neutrality - part Ⅰ background and economic feasibility of expanding the su-pply of fuel ammonia”, Journal of the Korean Society of Co-mbustion, Vol. 26, No. 1, 2021, pp. 59-83.
[https://doi.org/10.15231/jksc.2021.26.1.059]

-
C. K. Law and O. C. Kwon, “Effects of hydrocarbon substitution on atmospheric hydrogen–air flame propagation”, International Journal of Hydrogen Energy, Vol. 29, No. 8, 2004, pp. 867-879.
[https://doi.org/10.1016/j.ijhydene.2003.09.012]

-
H. Kobayashi, A. Hayakawa, K. D. K. A. Somarathne, and E. C. Okafor, “Science and technology of ammonia combustion”, Proceedings of the Combustion Institute, Vol. 37, No. 1, 2019, pp. 109-133.
[https://doi.org/10.1016/j.proci.2018.09.029]

-
A. T. Wijayanta, T. Oda, C. W. Purnomo, T. Kashiwagi, and M. Aziz, “Liquid hydrogen, methylcyclohexane, and ammonia as potential hydrogen storage: Comparison review”, International Journal of Hydrogen Energy, Vol. 44, No. 29, 2019, pp. 15026-15044.
[https://doi.org/10.1016/j.ijhydene.2019.04.112]

-
A. Valera-Medina, H. Xiao, M. Owen-Jones, W. I. F. David, and P. J. Bowen, “Ammonia for power”, Progress in Energy and Combustion Science, Vol. 69, 2018, pp. 63-102.
[https://doi.org/10.1016/j.pecs.2018.07.001]

-
J. Li, H. Huang, N. Kobayashi, Z. He, and Y. Nagai, “Study on using hydrogen and ammonia as fuels: combustion characteristics and NOx formation”, International Journal of Energy Research, Vol. 38, No. 9, 2014, pp. 1214-1223.
[https://doi.org/10.1002/er.3141]

-
H. Xiao, A. Valera-Medina, and P. J. Bowen, “Modeling combustion of ammonia/hydrogen fuel blends under gas turbine conditions”, Energy & Fuels, Vol. 31, No. 8, 2017, pp. 8631-8642.
[https://doi.org/10.1021/acs.energyfuels.7b00709]

-
Y. J. Ahn, J. W. Ku, S. Choi, J. Koo, and O. C. Kwon, “Design of a combustion chamber for studying the combustion characteristics of counterflow flames at elevated pressure”, Trans Korean Hydrogen New Energy Soc, Vol. 28, No. 3, 2017, pp. 315-321.
[https://doi.org/10.7316/KHNES.2017.28.3.315]

-
H. Xiao, M. Howard, A. Valera-Medina, S. Dooley, and P. J. Bowen, “Study on reduced chemical mechanisms of ammonia/methane combustion under gas turbine conditions”, Energy & Fuels, Vol. 30, No. 10, 2016, pp. 8701-8710.
[https://doi.org/10.1021/acs.energyfuels.6b01556]

-
H. Xiao, A. Valera-Medina, and P. J. Bowen, “Study on pre-mixed combustion characteristics of co-firing ammonia/methane fuels”, Energy, Vol. 140, Pt. 1, 2017, pp. 125-135.
[https://doi.org/10.1016/j.energy.2017.08.077]

-
H. Xiao, A. Valera-Medina, R. Marsh, and P. J. Bowen, “Numerical study assessing various ammonia/methane reaction models for use under gas turbine conditions”, Fuel, Vol. 196, 2017, pp. 344-351.
[https://doi.org/10.1016/j.fuel.2017.01.095]

-
A. Valera-Medina, R. Marsh, J. Runyon, D. Pugh, P. Beasley, T. Hughes, and P. Bowen, “Ammonia–methane combustion in tangential swirl burners for gas turbine power generation”, Applied Energy, Vol. 185, Pt. 2, 2017, pp. 1362-1371.
[https://doi.org/10.1016/j.apenergy.2016.02.073]

-
E. C. Okafor, Y. Naito, S. Colson, A. Ichikawa, T. Kudo, A. Hayakawa, and H. Kobayashi, “Measurement and modelling of the laminar burning velocity of methane-ammonia-air flames at high pressures using a reduced reaction mechanism”, Combustion and Flame, Vol. 204, 2019, pp. 162-175.
[https://doi.org/10.1016/j.combustflame.2019.03.008]

-
S. Liu, C. Zou, Y. Song, S. Cheng, and Q. Lin, “Experimental and numerical study of laminar flame speeds of CH4/NH3 mixtures under oxy-fuel combustion”, Energy, Vol. 175, 2019, pp. 250-258.
[https://doi.org/10.1016/j.energy.2019.03.040]

-
J. Li, H. Huang, N. Kobayashi, Z. He, Y. Osaka, and T. Zeng, “Numerical study on effect of oxygen content in combustion air on ammonia combustion”, Energy, Vol. 93, Pt. 2, 2015, pp. 2053-2068.
[https://doi.org/10.1016/j.energy.2015.10.060]

-
S. K. Choi, E. S. Cho, and S. H. Chung, “Quantification of extinction mechanism in counterflow premixed flames”, Journal of Mechanical Science and Technology, Vol. 28, 2014, pp. 3863-3871.
[https://doi.org/10.1007/s12206-014-0850-7]

-
J. Sato, “Effects of Lewis number on extinction behavior of premixed flames in a stagnation flow”, Symposium (International) on Combustion, Vol. 19, No. 1, 1982, pp. 1541-1548.
[https://doi.org/10.1016/S0082-0784(82)80331-7]

-
C. K. Law, “Combustion Physics”, Cambridge University Press, UK, 2006, pp. 410-434.
[https://doi.org/10.1017/CBO9780511754517]

-
C. K. Law, “Dynamics of stretched flames”, Symposium (International) on Combustion, Vol. 22, No. 1, 1989, pp. 1381-1402.
[https://doi.org/10.1016/S0082-0784(89)80149-3]

-
S. Ishizuka and C. K. Law, “An experimental study on extinction and stability of stretched premixed flames”, Symposium (International) on Combustion, Vol. 19, No. 1, 1982, pp. 327-335.
[https://doi.org/10.1016/S0082-0784(82)80204-X]

-
R. J. Kee, J. A. Miller, G. H. Evans, and G. Dixon-Lewis, “A com-putational model of the structure and extinction of strained, opposed flow, premixed methane-air flames”, Symposium (International) on Combustion, Vol. 22, No. 1, 1989, pp. 1479-1494.
[https://doi.org/10.1016/S0082-0784(89)80158-4]

-
A. E. Lutz, R. J. Kee, J. F. Grcar, and F. M. RupLey, “OPPDIF: a fortran program for computing opposed-flow diffusion flames (SAND-96-8243)”, Sandia National Lab Technical Report, 1997.
[https://doi.org/10.2172/568983]

-
X. Li, L. Jia, T. Onishi, P. Grajetzki, H. Nakamura, T. Tezuka, S. Hasegawa, and K. Maruta, “Study on stretch extinction limits of CH4/CO2 versus high temperature O2/CO2 counterflow non-premixed flames”, Combustion and Flame, Vol. 161, No. 6, 2014, pp. 1526-1536.
[https://doi.org/10.1016/j.combustflame.2013.12.004]

-
S. Colson, Y. Hirano, A. Hayakawa, T. Kudo, H. Kobayashi, C. Galizzi, and D. Escudié, “Experimental and numerical study of NH3/CH4 counterflow premixed and non-premixed flames for various NH3 mixing ratios”, Combustion Science and Technology, Vol. 193, No. 16, 2021, pp. 2872-2889.
[https://doi.org/10.1080/00102202.2020.1763326]

- G. P. Smith, D. M. Golden, M. Frenklach, N. W. Moriarty, B. Eiteneer, M. Goldenberg, C. T. Bowman, R. K. Hanson, S. Song, W. C. Gardiner Jr, V. V. Lissianski, and Z. Qin," GRI-Mech 3.0 detailed mechanism", 2023. Retrieved from http://combustion.berkeley.edu/gri-mech/, .
- University of California San Diego, “The San Diego Mechanis: Chemical-Kinetic Mechanisms for Combustion Applications”, University of California San Diego, 2014. Retrieved from http://combustion.ucsd.edu/, , 2014.
-
E. C. Okafor, Y. Naito, S. Colson, A. Ichikawa, T. Kudo, A. Hayakawa, and H. Kobayashi, “Experimental and numerical study of the laminar burning velocity of CH4–NH3–air premixed flames”, Combustion and Flame, Vol. 187, 2018, pp. 185-198.
[https://doi.org/10.1016/j.combustflame.2017.09.002]

-
Z. Tian, Y. Li, L. Zhang, P. Glarborg, and F. Qi, “An experimental and kinetic modeling study of premixed NH3/CH4/O2/Ar flames at low pressure”, Combustion and Flame, Vol. 156, No. 7, 2009, pp. 1413-1426.
[https://doi.org/10.1016/j.combustflame.2009.03.005]

-
A. Hayakawa, T. Goto, R. Mimoto, Y. Arakawa, T. Kudo, and H. Kobayashi, “Laminar burning velocity and Markstein length of ammonia/air premixed flames at various pressures”, Fuel, Vol. 159, 2015, pp. 98-106.
[https://doi.org/10.1016/j.fuel.2015.06.070]

-
S. H. Chung, J. S. Kim, and C. K. Law, “Extinction of interacting premixed flames: theory and experimental comparisons”, Symposium (International) on Combustion, Vol. 21, No. 1, 1988, pp. 1845-1851.
[https://doi.org/10.1016/S0082-0784(88)80419-3]

-
K. Sim, K. Lee, S. I. Keel, and J. Park, “Downstream interaction between SNG – air premixed flames”, Fuel, Vol. 210, 2017, pp. 545-556.
[https://doi.org/10.1016/j.fuel.2017.09.013]

-
Y. Kang, K. M. Lee, and J. Park, “Mutually interacting SNG-air premixed flames”, Fuel, Vol. 285, 2021, pp. 119065.
[https://doi.org/10.1016/j.fuel.2020.119065]

-
J. S. Ha, J. Park, T. M. Vu, O. B. Kwon, J. H. Yun, and S. I. Keel, “Effect of flame stretch in downstream Interaction between premixed syngas-air flames”, International Journal of Hydrogen Energy, Vol. 36, No. 20, 2011, pp. 13181-13193.
[https://doi.org/10.1016/j.ijhydene.2011.07.042]

-
T. H. Kim, J. Park, O. Fujita, O. B. Kwon, and J. H. Park, “Downstream interaction between stretched premixed syngas–air flames”, Fuel, Vol. 104, 2013, pp. 739-748.
[https://doi.org/10.1016/j.fuel.2012.07.038]

-
T. K. Kim, J. Park, S. H. Oh, O. B. Kwon, S. H. Baek, and S. Ko, “Important role of chemical interaction on flame extinction in downstream interaction between stretched premixed H2-air and CO-air flames”, International Journal of Hydrogen Energy, Vol. 38, No. 15, 2013, pp. 6537-6551.
[https://doi.org/10.1016/j.ijhydene.2013.03.009]

- W. E. Wilson Jr and R. M. Fristrom, “Radical in flames”, APL Technical Digest, 1963, Vol. 2, No. 6, pp. 2-7. Retrieved from https://www.jhuapl.edu/Content/techdigest/pdf/APL-V02-N06/APL-02-06-Wilson.pdf, .
-
J. Park, O. B. Kwon, E. J. Lee, J. H. Yun, and S. I. Keel, “A study on chemical effecta through preferential diffusion of H2 and H in CH4-H2 counterflow diffusion flames”, Transactions of the Korean Society of Mechanical Engineers B, Vol. 31, No. 12, 2007, pp. 1009-1016.
[https://doi.org/10.3795/KSME-B.2007.31.12.1009]