음이온교환막용 헤테로고리형 4차 암모늄 작용기를 갖는 폴리(아릴렌 이써)의 제조 및 특성 분석
2022 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
In this study, anion exchange membranes were prepared by synthesizing the main chain into a poly(arylene ether) (PAE) structure, and the structures capable of improving the physical and chemical stability of the membrane by introducing a heterocyclic quaternary ammonium functional groups were studied. The chemical structure and thermal properties of the prepared polymer were confirmed by 1H-NMR, FT-IR, TGA, and DSC, and surface analysis was performed through AFM measurement. Additionally, dimensional stability and chemical properties was studied by measuring water uptake and swelling ratio, IEC and ionic conductivity. At 90℃, the quaternized poly(arylene ether) (QPAE)/1-methylpiperidine (MP) membrane exhibited the highest ionic conductivity of 27.2 mS cm-1, while the QPAE/1-methylimidazole (MI) membrane and QPAE/1-methylmorpholine (MM) membrane exhibited values of 14.5 mS cm-1 and 11.5 mS cm-1, respectively. In addition, the prepared anion exchange membrane exhibited high chemical stability in alkaline solution.
Keywords:
Anion exchange membrane, Alkaline fuel cell, Chemical stability, Quaternary ammonium group키워드:
음이온교환막, 알칼리 연료전지, 화학적 안정성, 4차 암모늄 그룹1. 서 론
최근 지구상에서는 에너지의 수요 및 공급 비용이 급격히 증가함에 따라, 새로운 대체에너지 개발에 관한 관심과 높은 에너지 효율을 갖는 공정개발에 관한 관심이 높아지고 있어서 이에 관련된 연구들이 전 세계적으로 활발히 진행되고 있다. 석유, 석탄, 천연가스 같은 1차 에너지원은 온실가스의 배출로 인해 지구 환경에 큰 문제를 일으키며 자원 매장량도 불확실한 반면에, 수소는 지구의 깨끗한 환경을 보전할 수 있을 뿐만 아니라, 화석연료를 대체할 수 있는 신에너지원 중의 하나로 전 세계적으로 각광을 받고 있다. 이러한 수소는 화학적 활성이 높아 수소를 사용하는 연료전지에 최적의 연료로 사용되며, 에너지 변환 효율 또한 높아서 수소연료전지 자동차, 내연 기관, 그 밖의 운송기관 등 크고 작은 발전 장치의 연료로 광범위하게 이용할 수 있다. 이들 중에서 수소연료전지는 연료로부터 추출된 수소와 공기 중의 산소가 만나 화학에너지를 직접 전기에너지로 변환시키는 장치로써 수소(연료)가 끊임없이 공급된다면 계속해서 전기를 발생할 수 있는 획기적인 발전장치이다1-4).
연료전지는 연료의 종류, 작동 온도 및 구성에 따라 고분자전해질 연료전지(polymer electrolyte membrane fuel cell, PEMFC), 직접메탄올 연료전지(direct methanol fuel cell, DMFC), 알칼리 연료전지(alkaline fuel cell, AFC), 인산형 연료전지(phosphoric acid fuel cell, PAFC), 용융탄산염 연료전지(molten carbonate fuel cell, MCFC), 고체산화물 연료전지(solid oxide fuel cell, SOFC)로 분류된다. 이 중 이온을 통과시킬 수 있는 고분자막을 전해질로 사용하는 고분자전해질연료전지는 전해질의 종류에 따라 양이온교환막 연료전지(proton exchange membrane fuel cell, PEMFC)와 음이온교환막 연료전지(anion exchange membrane fuel cell, AEMFC)로 분류할 수 있다5-8).
PEMFC는 주로 수소를 연료로 사용하는 연료전지로써 산화전극에서 수소가 산화되어 수소이온과 전자가 발생하게 되는데, 이때 발생된 전자는 외부에 있는 도선을 통해 환원전극으로 이동하게 되며 이때 전기 에너지로 사용된다. 동시에 함께 발생된 수소이온은 고체전해질막을 통과하고 환원전극으로 이동하여 환원전극에서 환원된 산소와 반응하여 물을 발생시키게 된다9,10).
일반적으로 PEMFC는 높은 이온전도도, 우수한 화학적 특성 및 물리화학적 특성인 치수안정성 및 기계적 특성이 요구된다. 그러나 값비싼 귀금속 촉매의 사용으로 인한 높은 제조비용이 PEMFC의 단점으로 꼽히고 있다. 반면에 AEMFC는 비 백금촉매의 사용 및 빠른 산소환원반응 속도로 인하여 PEMFC를 대체할 수 있는 잠재력을 가지고 있다. 하지만 AEMFC의 중요한 구성요소 중 하나인 음이온교환막은 낮은 알칼라인 안정성과 낮은 이온전도도 문제로 AEMFC의 상용화를 지연시키고 있으며, 이러한 문제를 해결하기 위해 각 연구 그룹에서는 이온전달을 위한 작용기, 주사슬 및 곁사슬, 가교결합 및 유/무기 복합막 등을 사용하는 다양한 연구가 광범위하게 진행되고 있다11-16).
Chu 등17)은 quaternized poly(arylene ether) (QPAE) 고분자와 graphene oxide (GO)를 0, 0.1, 0.3, 0.5, 0.7 및 0.9 wt% 함량별로 각각 첨가하여 QPAE/GO 복합막을 제작하였다. 이 복합막들은 GO 함량이 증가함에 따라, QPAE 순수막보다 향상된 이온전도도와 낮은 팽창율을 보였으며, 특히 QPAE/GO 0.7wt% 복합막은 90℃에서 114.2 mS/cm-1의 최고 이온전도도와 70℃에서 135.8 mW cm-2의 최고 전력밀도를 보여주었다. 이는 소량의 GO를 포함하는 PAE가 막의 이온전도성 뿐만 아니라 물리적 특성을 강화하는 능력을 가지고 있음을 나타낸다18-20). 또한 Miyake 등21)과 Liu 등22)은 PAE에 구조가 다른 5종류의 4차 암모늄 작용기를 도입하여 작용기에 따른 이온전도도와 알칼라인 안정성을 조사하여, pyridinium-modified QPAE membrane이 이온전도도나 물 흡수도는 거의 같은 성능을 유지하면서 가장 좋은 알칼라인 안정성을 갖는다는 것을 밝혔다.
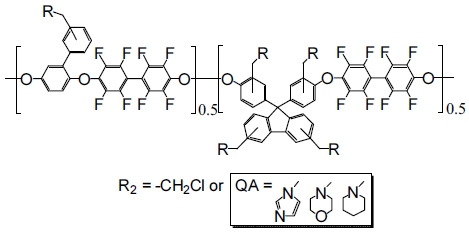
앞에서 소개한 두 논문을 고려하면, 제조한 PAE 랜덤 공중합체에 다양한 4차 암모늄 작용기를 도입하여 비교 연구를 함으로써 어떤 종류의 음이온교환막이 보다 실용화될 가능성이 있는지 파악할 수 있다. 따라서 우리는 이 개념을 바탕으로, 주로 PAE 랜덤 고분자 구조에 보다 큰(bulky) 구조를 갖는 다양한 헤테로고리형 4차 암모늄 작용기들, 즉, 1-methylimidazole (MI), 1-methylmorpholine (MM) 및 1-methylpiperidine (MP)기를 도입한 화학구조(Fig. 1)를 갖는 세 종류의 음이온교환막(QPAE/MI, QPAE/MM, QPAE/MP)을 제조하고, 이들 음이온교환막의 전기화학적 성질(이온전도도 및 활성화에너지) 및 물리/화학적 특성(열적특성, 합습률, 팽창율, IEC, 표면분석, 알칼리안정성)을 서로 비교하여 평가하고자 한다.
2. 실 험
2.1 시약 및 재료
2-Phenylhydroquinone (PHQ), dimethyl sulfoxide-d6, 4,4’-(9-fluorenylidene)diphenol (BPFL), N,N-dimethylacetamide (DMAc, anhydrous)는 Sigma-Aldrich (St. Louis, MO, USA)에서 구입하였고, 4-methylmorpholine, 1-methylimidazole, 1-methylpiperidine, decafluorobiphenyl (DFB)은 Tokyo Chemical Industry (Tokyo, Japan)에서 구매하여 사용하였다. 1,1,2,2-Tetrachloroethane (TCE), tetrahydrofuran (THF, 99%)은 Daejung Chemicals & Metals (Siheung, Korea)에서 구입하였고, chloromethyl methyl ether (CMME), zinc chloride (ZnCl2)는 KANTO Chemical (Tokyo, Japan)에서 구입하여 사용하였다. Acetone, methanol, potassium carbonate (anhydrous, 99.5%), potassium hydroxide (KOH, 95.0%)는 Samchyn Chemicals (Seoul, Korea)에서 구입하여 사용하였다.
2.2 Poly(arylene ether) (PAE) 랜덤공중합체의 합성
PAE 랜덤공중합체는 다음과 같은 과정으로 합성되었다. 딘-스타크 트랩(Dean Stark trap)과 환류냉각기(reflux condenser)가 장착된 100 mL 둥근 바닥 플라스크에 PHQ (0.35 g), BPFL (0.66 g), DFB (1.26 g), K2CO3 (1.04 g) 및 DMAc (10 mL)를 혼합하여 반응을 진행하였다. 혼합물은 질소 공급 하에 110℃에서 6시간 동안 반응을 유지하였다. 이후에 혼합물은 실온에서 냉각시킨 후, 재결정 용매(메탄올:아세톤:3차 증류수, 6:1:1, v/v/v, 600 mL)에 천천히 부어 침전시키는 방식으로 재결정하여 얻은 고체를 여과하여 회수하여 얻었다. 고분자는 60℃ 오븐에서 24시간 동안 건조하였다.
2.3 클로로메틸화된 poly(arylene ether) (CMPAE)의 합성
PAE 랜덤공중합체(1.3 g)와 TCE (20 mL)를 100 mL 둥근바닥플라스크에 넣고 적가 깔때기를 장착시킨 후 40℃까지 열을 가해 고분자를 용해시켰다. 고분자가 완전히 용해된 것을 확인한 후, THF (1 mL)에 ZnCl2 (0.23 g)를 용해시킨 후, 적가 깔때기를 사용하여 플라스크에 서서히 첨가하였다. 혼합물이 완전히 혼합된 후, CMME (10.03 mL)를 한 방울씩 천천히 떨어뜨리며 반응을 진행하였고 5일 동안 교반하면서 반응을 유지하였다. 반응 종료 후, 반응물을 메탄올 500 mL와 3차 증류수 20 mL에 부어 재결정을 진행하고, 재결정된 침전물은 필터과정에서 한 번 더 메탄올로 세척하여 수득하였다. 침전물은 60℃에서 24시간 동안 건조시켰다23).
2.3 Poly(arylene ether) (CMPAE)의 제막 및 4차화 반응
CM-PAE (0.2 g)를 TCE (10 mL)에 용해시킨다. 유리 페트리 접시에 캐스팅하여 70℃에서 15시간 동안 건조시킨 후, 3차 증류수를 사용하여 제조된 막을 분리하였다. 에탄올에 희석시킨 10 wt% (w/w) 1-methylimidazole (MI), 10 wt% (w/w) 1-methylmorpholine (MM), 10 wt% (w/w) 1-methylpiperidine (MP) 수용액에 들어있는 플라스크에 제조한 막을 50℃에서 3시간 동안 담가서 Cl 말단 작용기를 4차 암모늄그룹으로 치환시켰다. 음이온교환막의 특성평가를 진행하기 위해 1 M KOH 용액에 24시간 동안 담가 OH- 형태로 치환한 후 3차 증류수에 보관하였다. 제조된 각 막들의 두께는 20-30 μm였다.
2.4 특성 분석
준비된 고분자의 구조는 양성자핵자기공명분광법(proton nuclear magnetic resonance, 1H-NMR; JNM-ECA600)과 푸리에변환 적외선분광법(Fourier-transform infrared spectroscopy, FT-IR; PerkinElmer Frontier)을 이용하여 분석하였으며, 열적특성은 열중량분석법(thermogravimetric analysis, TGA; Q600), 시차주사열량측정법(differential scanning calorimetry, DSC; Q20)을 통해 분석하였다. 표면 분석은 원자힘현미경(atomic force microscope, AFM; anoscope V multimode 8)을 이용하여 분석하였다. 이들 분석기기는 주로 전북대학교 공동실험실습관(Center for University-Wide Research Facilities, Jeonbuk National University) 내의 장비를 이용하여 분석하였다.
준비된 막의 치수안정성을 분석하기 위해 함습률과 치수변화율을 측정하였고, 다음과 같은 식을 사용하여 계산하였다24-27).
Wdry와 Wwet은 각각 건조된 막의 중량과 젖은 막의 중량을 나타낸다.
Sdry와 Swet은 각각 건조된 막의 치수와 젖은 막의 치수를 나타낸다.
준비된 막의 이온교환용량(ion exchange capacity, IEC)은 역적정방법을 통해 측정하였다. 준비된 막을 60℃에서 완전히 건조시킨 뒤 막의 무게를 측정하였다. 이후 막을 1 M HCl 용액에 담지하여 OH- 형태를 Cl- 형태로 교환시키기 위해 48시간 동안 상온에 보관하였다. 소비된 HCl은 페놀프탈레인 지시약을 첨가하여 색이 변할 때까지 0.1 M NaOH를 사용하여 적정하였고, 이온교환용량은 다음과 같은 식을 이용하여 계산하였다24).
CHCl, VHCl, CNaOH, VNaOH는 HCl과 NaOH 용액의 몰농도와 부피를 나타내며 Wdry는 샘플의 건조무게를 나타낸다.
준비된 막의 이온전도도(ionic conductivity)는 4개의 전극-전도도 테스트 벤치에서 측정되었고, 분석 장비로는 PGZ 301 dynamic EIS voltammeter와 연동된 장비를 사용하였다. 막의 이온전도도(σ)는 다음과 같은 식을 이용하여 계산하였다.
L은 감지 전극 사이의 거리(이온 교차 길이, cm), R은 두 전극 사이의 저항(Ω)을 나타내며 A는 단면적(cm2)을 나타낸다.
준비된 막의 이온이동 메커니즘을 분석하기 위한 막의 활성화에너지(Ea)는 다음과 같은 식을 사용하여 계산하였다.
여기서 R과 T는 각각 기체상수와 절대온도를 나타낸다.
3. 결과 및 고찰
3.1 PAE의 구조분석
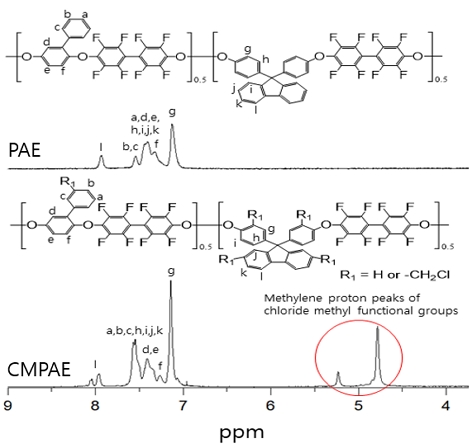
PAE 및 CMPAE의 화학적 구조는 1H-NMR 측정을 통해 확인하였다(Fig. 2). 합성된 PAE 랜덤공중합체 주사슬에 할당된 양성자 피크는 7.0-7.9 ppm 사이에서 검출되었고, 클로로메틸렌(-CH2Cl) 작용기에 해당하는 새로운 메틸렌 양성자 피크는 4.7-5.3 ppm에서 검출되었다.
CMPAE의 클로로메틸화 정도(degree of chloromethylation, DC)는 7.0-7.9 ppm과 4.7-5.3 ppm의 적분 면적비를 비교를 통해 계산하였으며, 이는 약 70%인 것으로 나타났다28).
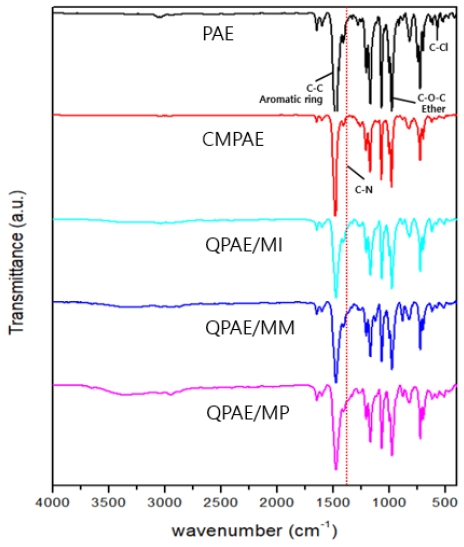
합성한 고분자의 구조분석은 FT-IR 측정을 통해 분석하였다(Fig. 3). Fig. 3에서 공통적으로 나타난 스펙트럼 1,474 cm-1, 1,068 cm-1 피크는 합성된 고분자의 방향족 C-C 결합과 C-O-C 결합에 해당한다. 또한 1,350-1,400 cm-1에 형성된 피크는 작용기의 도입으로 형성된 C-N 결합을 나타내며, 500-600 cm-1의 범위에 해당하는 피크는 C-Cl 결합과 관련이 있음을 확인하였다29-32).
3.2 열적 특성
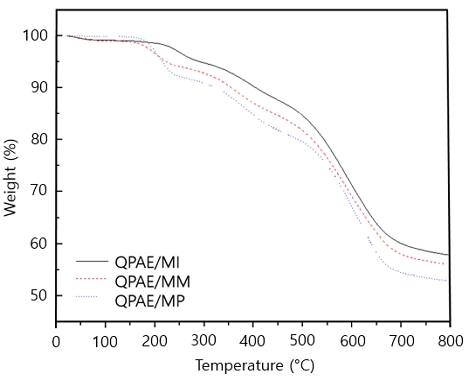
제조된 막인 QPAE/MI, QPAE/MM, QPAE/MP의 열적 특성은 TGA를 이용하여 질소 분위기 하에서 분당 10℃씩 온도를 높여 800℃까지 측정하였다(Fig. 4). QPAE/MI, QPAE/MM, QPAE/MP의 그래프는 두 번의 중량감소를 보여주었다. 200-350℃에서 보이는 중량 감소는 4차화 암모늄그룹의 분해로 인한 무게손실로 인해 나타났으며, 각기 다른 이온그룹의 손실로 인해 곡선에 차이가 있음을 보여주었다. 400℃ 이상에서 나타나는 중량 감소는 고분자 주사슬의 분해로 인해 무게손실이 나타났으며 이는 동일한 경향을 나타내었다33-35).
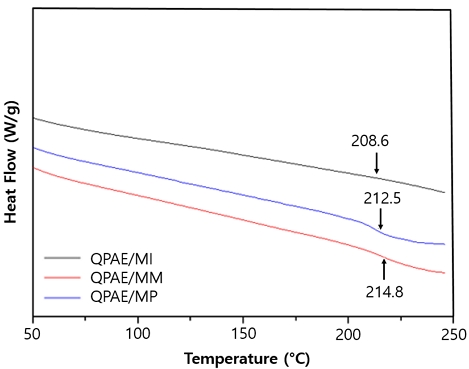
QPAE/MI, QPAE/MM, QPAE/MP의 유리전이온도(Tg)는 DSC 분석을 통해 측정하였다(Fig. 5). DSC 측정은 질소 분위기 하에서 분당 10℃씩 온도를 높여 250℃까지 측정하였고, 2차 스캔하여 얻은 값으로 분석을 진행하였다. QPAE/MI의 유리전이온도(Tg)는 208.6℃이며 QPAE/MM는 214.8℃, QPAE/MP는 212.5℃였다. 이는 도입된 4차화된 암모늄그룹이 주 사슬의 C-C 결합의 회전을 방해하고, 각 암모늄그룹이 가진 특성의 차이가 Tg에 영향을 미치는 것으로 확인되었다. QPAE/MM은 이온 그룹 내에 존재하는 C-O 결합의 비공유 전자쌍이 주 사슬의 움직임을 방해하여 C-O 결합을 가지지 않은 QPAE/MP보다 높은 Tg 값을 나타내었고, 이중결합이 포함된 오각형 고리를 갖는 QPAE/MI가 가장 낮은 값을 나타내었다. 높은 Tg 값은 열역학적으로 더 안정적이며 높은 온도에서도 견딜 수 있음을 의미한다36,37).
3.3 함습률, 팽창비율 및 IEC
IEC 값은 막의 물 흡수와 그에 따른 치수안정성에 결정적인 영향을 미치는 주요 요인이다. 제작한 막들의 IEC 값들(Table 1)은 QPAE/MI는 0.78 meq g-1, QPAE/MM 0.71 meq g-1, QPAE/MP 0.89 meq g-1로 QPAE/MP에서 가장 높은 IEC 값을 보여준다20). 막은 수분 함유량에 따라 막 표면의 형태 변화가 일어나게 되며, 적절한 수분을 함유한 막의 경우 수산화이온의 이동을 향상시킬 수 있는 이온채널을 형성하여 성능을 향상시킬 수 있다. Table 1을 살펴보면, 고분자에 붙어있는 작용기가 MM, MI, MP의 순서로 30℃에서 물을 함유하는 특성을 나타내며, 그 순서에 따라 막의 팽창이 유도될 것으로 생각할 수 있다. 이는 작용기의 화학 구조에 존재하는 질소 또는 산소 원자가 H2O와 수소결합을 형성할 수 있기 때문이라고 판단된다. 함습률과 팽창비율의 결과는 일관된 경향성을 보이지는 않았지만, 이 실험 결과를 비교해 보면 대체적으로 함습률과 팽창비율은 온도가 높아질수록 물을 잘 흡수하는 경향을 보였다. 90℃에서 QPAE/MI의 함습률은 39%로 가장 높은 값을 보여주었고, QPAE/MP의 함습률은 34.5%로 가장 낮은 값을 보여주었다. 또한 90℃에서 QPAE/MI의 팽창비율이 14.2%로 가장 높은 값을 보여주었고, QPAE/MP의 팽창비율이 12.9%로 가장 낮은 값을 보여주었다38).
3.4 형태 분석
표면형태 분석은 AFM을 통해 관찰하였으며, 음이온교환막의 친수성과 소수성의 상분리를 확인하였다. 준비된 막은 OH- 형태로 치환한 후, 3차 증류수에 보관한 막을 사용하였다. Fig. 6의 AFM 이미지를 살펴보면, 4차화 암모늄그룹이 작용기로 사용된 부분이 친수성 영역이며 물을 흡수하기 때문에 어둡게 나타난다. 반대로 소수성 부분은 밝게 나타나게 된다. QPAE/MP는 친수성/소수성 이온채널이 크고 뚜렷하게 형성됨을 확인하였으나, QPAE/MI, QPAE/MM은 친수성/소수성 이온채널이 QPAE/MP에 비해 크게 형성되지 않았다. 뚜렷한 이온채널 형성을 보여준 QPAE/MP가 높은 이온전도도를 보여주었고, 그에 비해 상 분리가 미미한 QPAE/MI, QPAE/MM이 낮은 이온전도도를 보여주었다37).
3.5 이온전도도 및 활성화 에너지
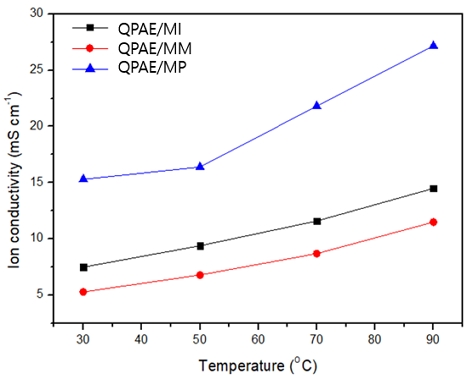
음이온교환막의 이온전도도는 이온교환용량과 물 함습률에 영향을 받으며, 전기화학적 성능을 결정하는 중요한 역할을 한다. QPAE/MI, QPAE/MM, QPAE/MP의 이온전도도는 100% 가습 조건하에 4전극 저항 측정법으로 30℃, 50℃, 70℃, 90℃에서 측정하였다(Fig. 7). 온도가 증가함에 따라 이온이 쉽게 확산되고 막의 자유체적이 더 높아질수록 이온의 확산이 증가하여 이온수송에 더 유리한 조건을 만들기 때문에 이온전도도는 증가한다.
90℃에서 QPAE/MP가 가장 높은 값인 27.2 mS cm-1의 이온전도도를 보여주었으며, QPAE/MI, QPAE/MM은 14.5 mS cm-1, 11.5 mS cm-1의 값을 보여주었다. QPAE/MP는 다른 암모늄 작용기에 비해 더 높은 이온전도도 값을 보여주었다. Fig. 6의 AFM 이미지에서 지방족 고리사슬을 갖는 QPAE/MP는 비교적 친수성과 소수성부분이 구분되는 이온채널의 형성을 보여주는 반면, 방향족성 고리사슬을 갖는 QPAE/MI 및 지방족성 고리사슬을 갖는 QPAE/MM의 친수성 부분은 통로가 뚜렷하게 분리되어 있지 않고 고르게 퍼져있는 형상을 보여준다. 이러한 현상은 방향족 성질을 갖는 MI작용기의 경우는 화학구조 내에 존재하는 질소원자의 비공유전자쌍이 모두 방향족고리 형성에 참여하게 되어, 원활한 물리·화학적 결합형성을 어렵게 한다고 예상되며, 반면에 지방족사슬에 헤테로 원자를 갖는 MM의 경우는 화학구조 내의 질소와 산소의 존재로, 비록 함습률이 비교적 높을지라도, 채널 형성이 원활하지 못하여 예상 밖의 이온전도도의 차이를 가져온 것으로 예상된다.
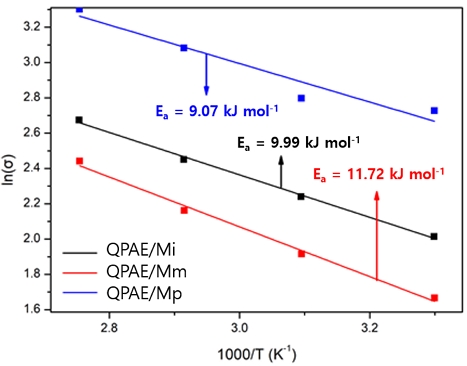
준비된 막들의 활성화에너지(Ea)는 Arrhenius plot의 기울기로부터 계산되었다(Fig. 8). 활성화 에너지는 이온의 이동 메커니즘을 예측할 수 있는 척도로 이온의 이동은 vehicle 메커니즘(<15 kJ mol-1)이 우세한 것으로 확인되었다37,39)
3.6 알칼리 안정성
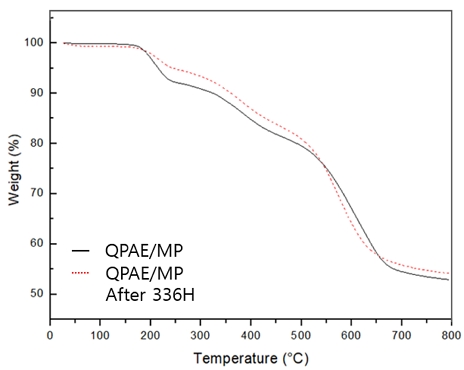
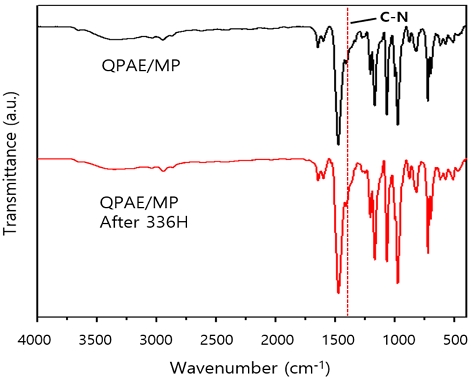
장기간의 연료전지 구동에 있어서 알칼리 안정성은 매우 중요하다. 음이온교환막은 높은 pH 하에서 OH-의 공격을 받아 암모늄그룹의 분해가 촉진되어 연료전지의 성능을 저하시키게 된다. 따라서 높은 pH 및 고온에서 막이 적절한 화학적 안정성을 나타내는지 확인하는 것은 연료전지 적용을 위해 필수적인 요소이다. 막은 가장 높은 이온전도도를 달성한 QPAE/MP를 사용하였다. 70℃에서 2 M KOH의 알칼라인 용액에 336시간 동안 담지한 후에 화학적 안정성을 테스트 하였고, 열적특성 및 화학구조 변화를 관찰하기 위해 TGA와 FT-IR을 측정하였다.
알칼리 용액에 처리하여 회수한 막들의 TGA 그래프로, 200-350℃ 범위는 암모늄작용기 손실에 해당하는 범위로써 알칼리 처리 후에도 무게 손실이 거의 없음을 확인하였다(Fig. 9). 또한 FT-IR 스펙트럼에서 C-N에 해당하는 피크와 다른 피크에서도 큰 변화는 거의 나타나지 않았다(Fig. 10). 이는 극한의 환경, 즉, 높은 pH 상태 및 고온에서 일정량의 암모늄 그룹이 존재하며, 화학적 안정성이 우수함을 보여준다40-42).
4. 결 론
본 연구에서는 PAE 구조로 주사슬을 도입하여 물리·화학적 및 전기화학적 안정성을 가지는 음이온교환막을 합성하고 4차 암모늄 작용기를 도입하여 각각의 음이온교환막의 특성을 비교하고자 하였다. 4차화 반응은 1-methylmorpholine, 1-methylimidazole, 1-methylpiperidine을 사용하여 담지법을 통해 진행하였다. 합성한 고분자의 화학구조는 1H-NMR 및 FT-IR을 통해 구조분석을 진행하였다. 열적 특성은 TGA와 DSC를 이용해 확인한 결과 높은 열적 안정성을 보여주었고, 작용기와 주사슬의 분해로 인한 두 차례의 중량손실을 보여주었다. 함습률, 팽창비율 및 이온교환용량은 QPAE/MP, QPAE/MI, QPAE/MM 순으로 낮아지는 경향을 보여주었으며 이는 이온전도도에 많은 영향을 주었다. 90℃에서 이온전도도는 QPAE/MP가 27.2 mS cm-1로 가장 높은 값을 보여주었다. 이는 AFM 이미지 나타나 있듯이 QPAE/MP가 친수성/소수성 이온채널이 크고 뚜렷하게 형성되어 다른 막에 비해 높은 이온전도도를 보여주었다고 판단된다.
결론적으로 본 연구에서는 작용기가 다른 3가지 종류의 4차화된 암모늄작용기를 갖는 음이온교환막을 제조하여 이온전도도와 화학적 열적 안전성을 비교한 결과, QPAE/MP가 가장 좋은 이온전도도를 보였으며, 극한의 알칼리 조건에서 장시간 담지 후에도 열적 안정성과 및 화학적 안정성이 우수함을 확인하였다.
Acknowledgments
이 성과는 2020년도 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구입니다(No. 2020R1A2B5B01001458).
References
-
K. F. L. Hagesteijn, S. Jiang, and B. P. Ladewig, “A review of the synthesis and characterization of anion exchange membranes”, J. Mater. Sci., Vol. 53, 2018, pp. 11131-11150.
[https://doi.org/10.1007/s10853-018-2409-y]

-
N. Chen and Y. M. Lee, “Anion exchange polyelectrolytes for membranes and ionomers”, Prog. Polym. Sci., Vol. 113, 2021, pp. 101345.
[https://doi.org/10.1016/j.progpolymsci.2020.101345]

-
M. Vinothkannan, A. R. Kim, S. Ramakrishnan, Y. T. Yu, and D. J. Yoo, “Advanced Nafion nanocomposite membrane embedded with unzipped and functionalized graphite nanofibers for high-temperature hydrogen-air fuel cell system: the impact of filler on power density, chemical durability and hydrogen permeability of membrane”, Compos. Part B Eng., Vol. 215, 2021, pp. 108828.
[https://doi.org/10.1016/j.compositesb.2021.108828]

-
M. A. Abdelkareem, K. Elsaid, T. Wilberforce, M. Kamil, E. T. Sayed, and A. Olabi, “Environmental aspects of fuel cells: a review”, Sci. Total Environ., Vol. 752, 2021, pp. 141803.
[https://doi.org/10.1016/j.scitotenv.2020.141803]

-
A. R. Kim, M. Vinothkannan, and D. J. Yoo, “Artificially designed, low humidifying organic–inorganic(SFBC-50/FSiO2) composite membrane for electrolyte applications of fuel cells”, Compos. Part B Eng., Vol. 130, 2017, pp. 103-113.
[https://doi.org/10.1016/j.compositesb.2017.07.042]

-
D. J. Yoo, S. H. Hyun, A. R. Kim, G. G. Kumar, and K. S. Nahm, “Novel sulfonated poly(arylene biphenylsulfone ether) copolymers containing bisphenylsulfonyl biphenyl moiety: structural, thermal, electrochemical and morphological characteristics”, Polym. Int., Vol. 60, No. 1, 2011, pp. 85-92.
[https://doi.org/10.1002/pi.2914]

-
G. Merle, M. Wessling, and K. Nijmeijer, “Anion exchange membranes for alkaline fuel cells: a review”, J. Membr. Sci., Vol. 377, No. 1-2, 2011, pp. 1-35.
[https://doi.org/10.1016/j.memsci.2011.04.043]

-
K Tammeveski and J. H. Zagal, “Electrocatalytic oxygen reduction on transition metal macrocyclic complexes for anion exchange membrane fuel cell application”, Current Opinion in Electrochemistry, Vol. 9, 2018, pp. 207-213.
[https://doi.org/10.1016/j.coelec.2018.04.001]

-
M. Pan, C. Pan, C. Li, and J. Zhao, “A review of membranes in proton exchange membrane fuel cells: transport phenomena, performance and durability”, Renew. Sust. Energ. Rev., Vol. 141, 2021, pp. 110771.
[https://doi.org/10.1016/j.rser.2021.110771]

-
L. Fan, Z. Tu, and S. H. Chan, “Recent development of hydrogen and fuel cell technologies: a review”, Energy Rep., Vol. 7, 2021, pp. 8421-8446.
[https://doi.org/10.1016/j.egyr.2021.08.003]

-
A. M. A. Mahmoud and K. Miyatake, “Highly conductive and alkaline stable partially fluorinated anion exchange membranes for alkaline fuel cells: effect of ammonium head groups”, J. Membr. Sci., Vol. 643, 2022, pp. 120072.
[https://doi.org/10.1016/j.memsci.2021.120072]

-
E. Gülzow and M. Schulze, “Long-term operation of AFC electrodes with CO2 containing gases”, J. Power Sources, Vol. 127, No. 1-2, 2004, pp. 243-251.
[https://doi.org/10.1016/j.jpowsour.2003.09.020]

-
P. Gouérec, L, Poletto, J, Denizot, E. Sanchez-Cortezon, and J. H. Miners, “The evolution of the performance of alkaline fuel cells with circulating electrolyte”, J. Power Sources, Vol. 129, No. 2, 2004, pp. 193-204.
[https://doi.org/10.1016/j.jpowsour.2003.11.032]

-
E. Gülzow, “Alkaline fuel cells: a critical view”, J. Power Sources, Vol. 61, No. 1-2, 1996, pp. 99-104.
[https://doi.org/10.1016/S0378-7753(96)02344-0]

-
E. Agel, J. Bouet, and J. F. Fauvarque, “Characterization and use of anionic membranes for alkaline fuel cells”, J. Power Sources, Vol. 101, No. 2, 2001, pp. 267-274.
[https://doi.org/10.1016/S0378-7753(01)00759-5]

-
M. Liu, X. Hu, B. Hu, L. Liu, and N. Li, “Soluble poly(aryl piperidinium) with extended aromatic segments as anion exchange membranes for alkaline fuel cells and water electrolysis”, J. Membr. Sci., Vol. 642, 2022, pp. 119966.
[https://doi.org/10.1016/j.memsci.2021.119966]

-
J. Y. Chu, K. H. Lee, A. R. Kim, and D. J. Yoo, “Improved electrochemical performance of composite anion exchange membranes for fuel cells through cross linking of the polymer chain with functionalized graphene oxide”, J. Membr. Sci., Vol. 611, 2020, pp. 118385.
[https://doi.org/10.1016/j.memsci.2020.118385]

-
K. H. Lee, J. Y. Chu, A. R. Kim, and D. J. Yoo, “Fabrication of high-alkaline stable quaternized poly(arylene ether ketone)/graphene oxide derivative including zwitterion for alkaline fuel cells”, ACS Sustain. Chem. Eng., Vol. 9, No. 26, 2021, pp. 8824-8834.
[https://doi.org/10.1021/acssuschemeng.1c01978]

-
Q. Chen, J. Luo, J. Liao, C. Zhu, J. Li, J. Xu, Y. Xu, H. Ruan, and J. Shen, “Tuning the length of aliphatic chain segments in aromatic poly(arylene ether sulfone) to tailor the micro-structure of anion-exchange membrane for improved proton blocking performance”, J. Membr. Sci., Vol. 641, 2022, pp. 119860.
[https://doi.org/10.1016/j.memsci.2021.119860]

-
K. H. Lee, J. Y. Chu, A. R. Kim, and D. J. Yoo, “Effect of functionalized SiO2 toward proton conductivity of composite membranes for PEMFC application”, Int. J. Energy Res., Vol. 43, No. 10, 2019, pp. 5333-5345.
[https://doi.org/10.1002/er.4610]

-
J. Miyake, K. Fukasawa, M. Watanabe, and K. Miyatake, “Effect of ammonium groups on the properties and alkaline stability of poly(arylene ether)-based anion exchange membranes”, J. Polym. Sci. A. Polym. Chem., Vol. 52, No. 3, 2014, pp. 383-389.
[https://doi.org/10.1002/pola.27011]

-
J. Liu, X. Yan, L. Gao, L. Hu, X. Wu, Y. Dai, X. Ruan, and G. He, “Long-branched and densely functionalized anion exchange membranes for fuel cells”, J. Membr. Sci., Vol. 581, 2019, pp. 82-92.
[https://doi.org/10.1016/j.memsci.2019.03.046]

-
Z. Wang, S. F. Zhou, Y. Z. Zhuo, A. N. Lai, Y. Z. Lu, and X. B. Wu, “Adamantane-based block poly(arylene ether sulfone)s as anion exchange membranes”, Polymer, Vol. 255, 2022, pp. 125155.
[https://doi.org/10.1016/j.polymer.2022.125155]

-
H. Ranganathan, M. Vinothkannan, A. R. Kim, V. Subramanian, M. S. Oh, and D. J. Yoo, “Simultaneous improvement of power density and durability of sulfonated poly(ether ether ketone) membrane by embedding CeO2-ATiO2: a comprehensive study in low humidity proton exchange membrane fuel cells”, Int. J. Energy Res., Vol. 46, No. 7, 2022, pp. 9041-9057.
[https://doi.org/10.1002/er.7781]

-
S. D. Sajjad, Y. Hong, and F. Liu, “Synthesis of guanidinium-based anion exchange membranes and their stability assessment”, Polym. Adv. Technol., Vol. 25, No. 1, 2014, pp. 108-116.
[https://doi.org/10.1002/pat.3211]

-
L. Liu, Q. Li, J. Dai, H. Wang, B. Jin, and R. Bai, “A facile strategy for the synthesis of guanidinium-functionalized polymer as alkaline anion exchange membrane with improved alkaline stability”, J. Membr. Sci., Vol. 453, 2014, pp. 52-60.
[https://doi.org/10.1016/j.memsci.2013.10.054]

-
B. N. Lee, A. Kodir, H. Lee, D. Shin, and B. Bae, “Preparation and characterization of the polymeric antioxidant for improving the chemical durability of polymer electrolyte membranes”, Trans Korean Hydrogen New Energy Soc, Vol. 32, No. 5, 2021, pp. 308-314.
[https://doi.org/10.7316/KHNES.2021.32.5.308]

-
K. H. Lee, J. Y. Chu, A. R. Kim, and D. J. Yoo, “Simultaneous improvement of anion conductivity and cell durability through the formation of dense ion clusters of F-doped graphitic carbon nitride/quaternized poly(phenylene oxide) composite membrane”, J. Membr. Sci., Vol. 650, 2022, pp. 120384.
[https://doi.org/10.1016/j.memsci.2022.120384]

-
X. Mao, Z. Li, G. He, Z. Li, J. Zhao, Y. Zhang, and Z. Jiang, “Enhancing hydroxide conductivity of anion exchange membrane via incorporating densely imidazolium functionalized graphene oxide”, J. Solid. State. Chem., Vol. 333, 2019, pp. 83-92.
[https://doi.org/10.1016/j.ssi.2019.01.023]

-
L. Liu, C. Tong, Y. He, Y. Zhao, and C. Lü, “Enhanced properties of quaternized graphenes reinforced polysulfone based composite anion exchange membranes for alkaline fuel cell”, J. Membr. Sci., Vol. 487, 2015, pp. 99-108.
[https://doi.org/10.1016/j.memsci.2015.03.077]

-
J. Liu, R. Qu, P. Peng, W. Liu, D. Chen, H. Zhang, and X. Liu, “Covalently functionalized graphene oxide and quaternized polysulfone nanocomposite membranes for fuel cells”, RSC Adv., Vol. 6, No. 75, 2016, pp. 71305-71310.
[https://doi.org/10.1039/C6RA12822J]

-
Z. Luo, Y. Gong, X. Liao, Y. Pan, and H. Zhang, “Nanocomposite membranes modified by graphene-based materials for anion exchange membrane fuel cells”, RSC Adv., Vol. 6, No. 17, 2016, pp. 13618-13625.
[https://doi.org/10.1039/C5RA21104B]

-
Q. Wang, L. Huang, J. Zheng, Q. Zhang, G. Qin, S. Li, and S. Zhang, “Design, synthesis and characterization of anion exchange membranes containing guanidinium salts with ultrahigh dimensional stability”, J. Membr. Sci., Vol. 643, 2022, pp. 120008.
[https://doi.org/10.1016/j.memsci.2021.120008]

-
L. Li, J. Wang, M. Hussain, L. Ma, N. A. Qaisrani, S. Ma, L. Bai, X. Yan, X. Deng, G. He, and F. Zhang, “Side-chain manipulation of poly (phenylene oxide) based anion exchange membrane: alkoxyl extender integrated with flexible spacer”, J. Membr. Sci., Vol. 624, 2021, pp. 119088.
[https://doi.org/10.1016/j.memsci.2021.119088]

-
H. M. Kim, C. Hu, H. H. Wang, J. H. Park, N. Chen, and Y. M. Lee, “Impact of side-chains in poly(dibenzyl-co-terphenyl piperidinium) copolymers for anion exchange membrane fuel cells”, J. Membr. Sci., Vol. 644, 2022, pp. 120109.
[https://doi.org/10.1016/j.memsci.2021.120109]

-
Y. Shen, L. Maurizi, G. Magnacca, V. Boffa, and Y. Yue, “Tuning porosity of reduced graphene oxide membrane materials by alkali activation”, Nanomaterials, Vol. 10, No. 11, 2020, pp. 2093.
[https://doi.org/10.3390/nano10112093]

-
Z. Xue, Y. Tang, X. Duan, Y. Ye, X. Xie, and X. Zhou, “Ionic polymer-metal composite actuators obtained from sulfonated poly(ether ether sulfone) ion-exchange membranes”, Compos. Part A Appl. Sci. Manuf., Vol. 81, 2016, pp. 13-21.
[https://doi.org/10.1016/j.compositesa.2015.11.007]

-
S. H. Kim and D. J. Yoo, “Simultaneous improvement of dimensional stability and ionic conductivity of QPAE/TiO2-x composite membranes according to TiO2 content control for anion exchange membrane fuel cells”, Trans Korean Hydrogen New Energy Soc, Vol. 33, No. 1, 2022, pp. 19-27.
[https://doi.org/10.7316/KHNES.2022.33.1.19]

-
S. Du, S. Li, N. Xie, Y. Xu, Q. Weng, X. Ning, P. Chen, X. Chen, and Z. An, “Development of rigid side-chain poly(ether sulfone)s based anion exchange membrane with multiple annular quaternary ammonium ion groups for fuel cells”, Polymer, Vol. 251, 2022, pp. 124919.
[https://doi.org/10.1016/j.polymer.2022.124919]

-
F. Xu, Y. Su, and B. Lin, “Progress of alkaline anion exchange membranes for fuel cells: the effects of micro-phase separation”, Front. Mater., Vol. 7, 2020, pp. 4.
[https://doi.org/10.3389/fmats.2020.00004]

-
J. Y. Chu, K. H. Lee, A. R. Kim, and D. J. Yoo, “Study on the chemical stabilities of poly(arylene ether) random copolymers for alkaline fuel cells: effect of main chain structures with different monomer units”, ACS Sustain. Chem. Eng., Vol. 7, No. 24, 2019, pp. 20077-20087.
[https://doi.org/10.1021/acssuschemeng.9b05934]

-
S. Xu, W. Wu, R. Wan, W. Wei, Y. Li, J. Wang, X. Sun, and R. He, “Tailoring the molecular structure of pyridine-based polymers for enhancing performance of anion exchange electrolyte membranes”, Renew. Energ., Vol. 194, 2022, pp. 366-377.
[https://doi.org/10.1016/j.renene.2022.05.071]