알칼리 수전해를 위한 상용 음이온교환막의 고온 특성
2022 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
In order to evaluate the possibility as a separator in alkaline water electrolysis, the high temperature characteristics were evaluated by measuring the membrane resistance and durability of 5 types of commercial anion exchange membranes in 7 M KOH solution and at 80℃. The membrane resistance of AEM membrane measured in 7 M KOH solution and at 80℃ had a lower value of about 8-24 times compared to the other membranes. The durability of AEM membrane tested with the soaking time in 7 M KOH solution and at 80℃ showed a very good stability and that of FAAM40 and FAAM75-PK showed secondly a good stability. The thermal stability with the soaking time in 7 M KOH solution and at 80℃ of FAAM40 and FAAM75-PK membrane analyzed by thermo-gravimetric analysis showed a good stability compared to the other membranes.
Keywords:
Hydrogen production, Water electrolysis, Alkaline water electrolysis, Ion exchange membrane, Aion exchange membrane키워드:
수소제조, 수전해, 알칼리 수전해, 이온교환막, 음이온교환막1. 서 론
최근 지구 환경오염 문제를 해결하기 위해 2050년 CO2 배출량을 0 (zero)로 하는 탄소중립(net-zero)에 대한 제안이 Intergovernmental Panel on Climate Change에 의해 이루어졌으며1), 국제에너지기구(International Energy Agency)는 2050년 탄소중립 달성을 위해 전력화, 수소, 바이오에너지, 이산화탄소 포집과 이용 및 저장(carbon capture, utilization and storage) 등 핵심기술 기술에 대한 연구개발 투자 규모를 확대할 필요가 있고, 2030년 850 GW의 수전해 조가 필요할 것으로 예측하고 있다2).
수소 제조 방법 중에서 특히, 물 전기분해를 이용하는 방법은 신재생 에너지원과의 접목을 고려할 때 가장 효율적이고 실용적인 방법으로 여겨지고 있다3-5). 물 전기분해 수소 제조 기술은 전기를 이용하여 수소를 물로부터 직접 제조하는 방법으로, 물 전기분해 장치를 수전해 조(water electrolyser)라고 한다.
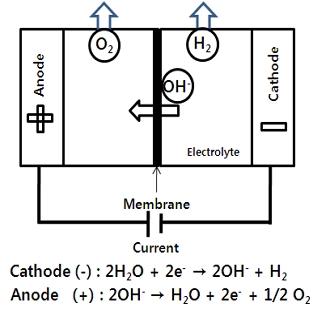
전해액으로 알칼리 수용액을 사용하는 알칼리 수전해(alkaline water electrolysis, AWE)는 물 전기분해 방법의 일종이다. 알칼리 수전해 방법은 오래 전부터 잘 알려진 수소 제조 방법으로, 전해액으로 10-20%의 NaOH 혹은 20-30%의 KOH 용액을 사용하며, 단위 셀은 수산화이온(OH-)만을 선택적으로 통과시키는 격막, 그리고 수소와 산소를 발생시키는 전극으로 구성된다.
Fig. 1은 알칼리 수전해의 개념을 나타낸다. 알칼리 수전해 셀에는 초기 석면과 티탄산칼륨과 같은 세라믹 산화물 또는 폴리프로필렌(polypropylene)과 폴리페닐렌설파이드(polyphenylene sulfide)와 같은 고분자를 활용한 하이드록실 이온(OH-) 전도성을 갖는 다공성 다이어프램(porous diaphragm)을 사용하여, 양극과 음극 전해액을 분리하였다6-8). 하지만 석면과 다공성 다이어프램의 사용 시에 문제점으로는 생성된 수소와 산소 가스의 혼합 또는 전해 효율이 저하되는 문제가 발생하였다. 이러한 문제점을 해결하기 위해 양극과 음극 전해액의 혼합을 방지함과 동시에 수산화이온의 선택투과성이 높은 격막의 개발이 필요하며, 알칼리 수전해용 격막으로는 음이온만을 선택적으로 투과시키는 음이온교환막이 적당하다9). 또한 알칼리 수전해용 음이온교환막은 전해 효율을 높이기 위해 수산화이온(OH-)의 높은 이온전도도를 가져야 하며, 알칼리 용액에 대한 내구성이 좋아야 한다.
음이온교환막을 사용하는 알칼리 수전해는 음이온교환막 알칼리 수전해(anion exchange membrane water electrolysis, AEMWE)로 불리며 이온교환막에 관한 연구개발이 활발히 진행되고 있다10-16). 이러한 음이온교환막은 아직 상용화가 되어 있지 않기 때문에 상용 음이온교환막의 알칼리 수전해에서의 적용성에 관한 연구가 필요하다. 따라서 이전 연구에서는 알칼리 수전해용으로 사용 가능성을 평가하기 위해 실온(25℃)에서 상용 음이온교환막의 특성 연구를 진행하였다5). 알칼리 수전해의 경우 일반적으로 40-80℃에서 운전이 이루어지고 있으며17), 운전 온도가 고온일수록 전해질의 전도도가 향상되어 셀 전압의 저하와 함께 효율이 향상된다. 따라서 AEMWE의 고온 운전을 위해서는 고온에서 적용 가능한 음이온교환막이 필요하다.
본 연구에서는 알칼리 수전해 용으로 사용 가능성을 평가하기 위해 상용 음이온교환막의 고온(80℃) 특성을 평가하였다.
2. 실 험
5종류의 상용 음이온교환막의 고온 특성을 측정하여 알칼리 수전해용 격막으로써 사용 가능성에 대해 평가하였다. 상용 음이온교환막은 Fuji Film 사(Tokyo, Japan)의 AEM 막, Asahi Glass 사(Tokyo, Japan)의 AHO 막, Astom 사(Yamaguchi, Japan)의 AHA 막, Fumatech 사(Bietigheim-Bissingen, Germany)의 FAAM40 막과 FAAM75-PK 막을 사용하였다5).
2.1 막의 고온 특성 평가
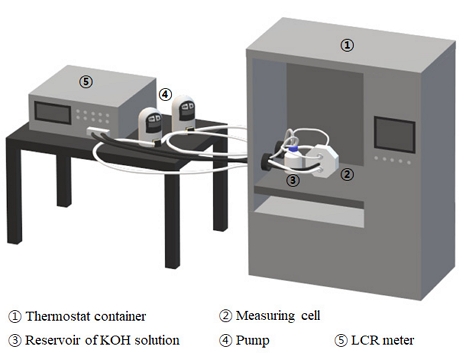
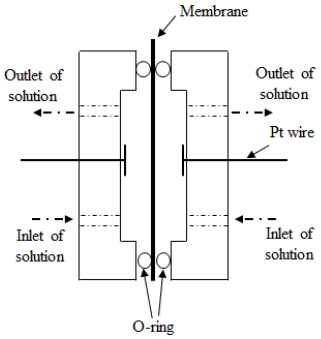
막의 고온 특성 평가를 위해 Fig. 2와 같이 실험 장치를 구성하였다. 막 저항 측정용 셀과 7 M KOH 수용액이 담겨있는 병을 항온조에 넣고, 항온조 온도를 80℃로 하였다. 펌프를 이용하여 7 M KOH 수용액을 Fig. 3에 나타낸 테플론으로 제작된 측정용 셀에 공급하고, LCR메터(PM-6304, FLUKE Co., Everett, WA, USA)를 이용하여 막 저항을 측정함으로써 실험을 진행하였다.
7 M KOH 수용액에서의 막 저항은 1 kHz의 주파수에서 LCR메터를 이용하여 측정하였다. 막 저항은 식 (1)로부터 계산하였다. 막의 유효면적은 0.75 cm2이다.
| (1) |
여기서, R은 막 저항(Ω·cm2), R1은 막을 주입하였을 때의 저항(Ω), R2는 막을 주입하지 않았을 때의 저항(Ω), S는 막의 유효면적이다.
막의 내구성 평가는 막을 80℃, 7 M KOH 수용액에 침적한 후, 침적 시간 경과와 함께 7 M KOH 수용액에서의 막 저항 변화를 측정함으로써 진행하였다. 내구성 측정은 5개월(3,600 hours) 동안 진행하였다.
Thermogravimetric analysis (TGA) 분석은 Scinco M&T Co. (Seoul, Korea)의 TGAN-1000을 이용하여 진행하였다. TGA 분석은 막 샘플을 장치 내에 설치한 후, 질소가스 분위기에서 온도를 25-500℃로 하여 진행하였으며, 승온 속도는 2℃/min으로 하였다.
3. 결과 및 고찰
3.1 막의 고온 내구성
Table 1은 80℃, 7 M KOH 수용액에서 측정한 침적 시간에 따른 막 저항값을 나타낸다. Fig. 4는 80℃, 7 M KOH 수용액에서 측정한 침적 시간과 막 저항의 관계를 나타낸다. AEM 막의 경우, 초기 0.08 Ω·cm2의 막 저항값에서, 막 저항은 침적 시간 경과와 함께 증가와 감소를 반복한 후, 5개월(3,600 hours) 후에 0.1 Ω·cm2의 값을 가졌다. AHO 막의 경우, 초기 1.93 Ω·cm2의 막 저항값에서, 막 저항은 침적 시간 경과와 함께 서서히 증가하여 5개월 후에 26.94 Ω·cm2의 값을 가졌다. AHA 막의 경우, 초기 0.67 Ω·cm2의 막 저항값에서, 막 저항은 침적 시간 경과와 함께 증가와 감소를 반복한 후, 5개월 후에 18.59 Ω·cm2의 값을 가졌다. FAAM40 막의 경우, 초기 0.60 Ω·cm2의 막 저항값에서, 막 저항은 침적 시간 경과와 함께 서서히 감소한 후, 5개월 후에 0.34 Ω·cm2의 값을 가졌다. FAAM75-PK 막의 경우, 초기 1.0 Ω·cm2의 막 저항값에서, 막 저항은 침적 시간 경과와 함께 서서히 감소한 후, 5개월 후에 0.52 Ω·cm2의 값을 가졌다.
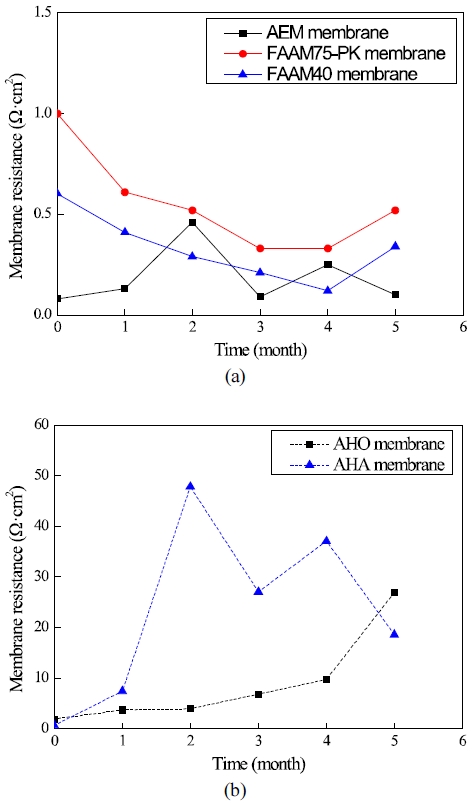
Relationship between membrane resistance and the soaking time in 7 M KOH solution and at 80℃. (a) AEM, FAAM40, FAAM75-PK membrane. (b) AHO, AHA membrane.
AHO와 AHA 막의 경우, 막 저항은 침적 시간 5개월 후에 초기(0개월)와 비교하여 각각 약 14배와 28배의 높은 값을 보였다. 일반적으로 음이온교환막에서 음이온은 OH-와 같은 형태로 이온채널을 통해 이동하며, 이는 막 저항에 영향을 미치게 되며, 막 저항은 높은 이온교환기를 가질수록 낮아진다18). AHO와 AHA 막의 침적 시간 5개월 후의 증가한 막 저항은 초기에 가지고 있던 이온교환기가 침적 시간과 함께 감소하였기 때문으로 판단된다.
FAAM40과 FAAM75-PK 막의 경우, 막 저항은 침적 시간 5개월 후에 초기와 비교하여 약 1/2의 낮은 값을 보였다. 일반적으로 막이 열화되어 막에 핀 홀이 형성되면 막 저항은 감소하는 경향을 보인다18). FAAM40과 FAAM75-PK 막을 현미경으로 관찰하였을 때 핀 홀은 형성되어 있지 않은 것을 확인하였다. FAAM40과 FAAM75-PK 막에서 침적 시간 경과와 함께 막 저항이 감소하는 것은 아직 정확한 원인은 알 수 없지만, KOH 수용액에 막을 침적함으로써 음이온인 OH-가 기존에 막이 가지고 있던 음이온 기와 활발히 교환이 이루어지면서 막에 OH-가 증가함으로써 막의 KOH 용액에 대한 친화력이 높아졌기 때문으로 판단된다. 막 저항 감소에 대한 정확한 원인을 분석하기 위해서 향후 침적 시간에 따른 원소분석을 위한 energy-dispersive analysis of X-ray 분석 또는 fourier-transform infrared spectroscopy 분석과 이온교환용량 변화 분석에 대한 연구가 필요할 것으로 판단된다.
3.2 TGA 분석
Fig. 5는 80℃, 7 M KOH 수용액에 침적한 침적 시간에 따른 TGA 분석 결과를 나타낸다.
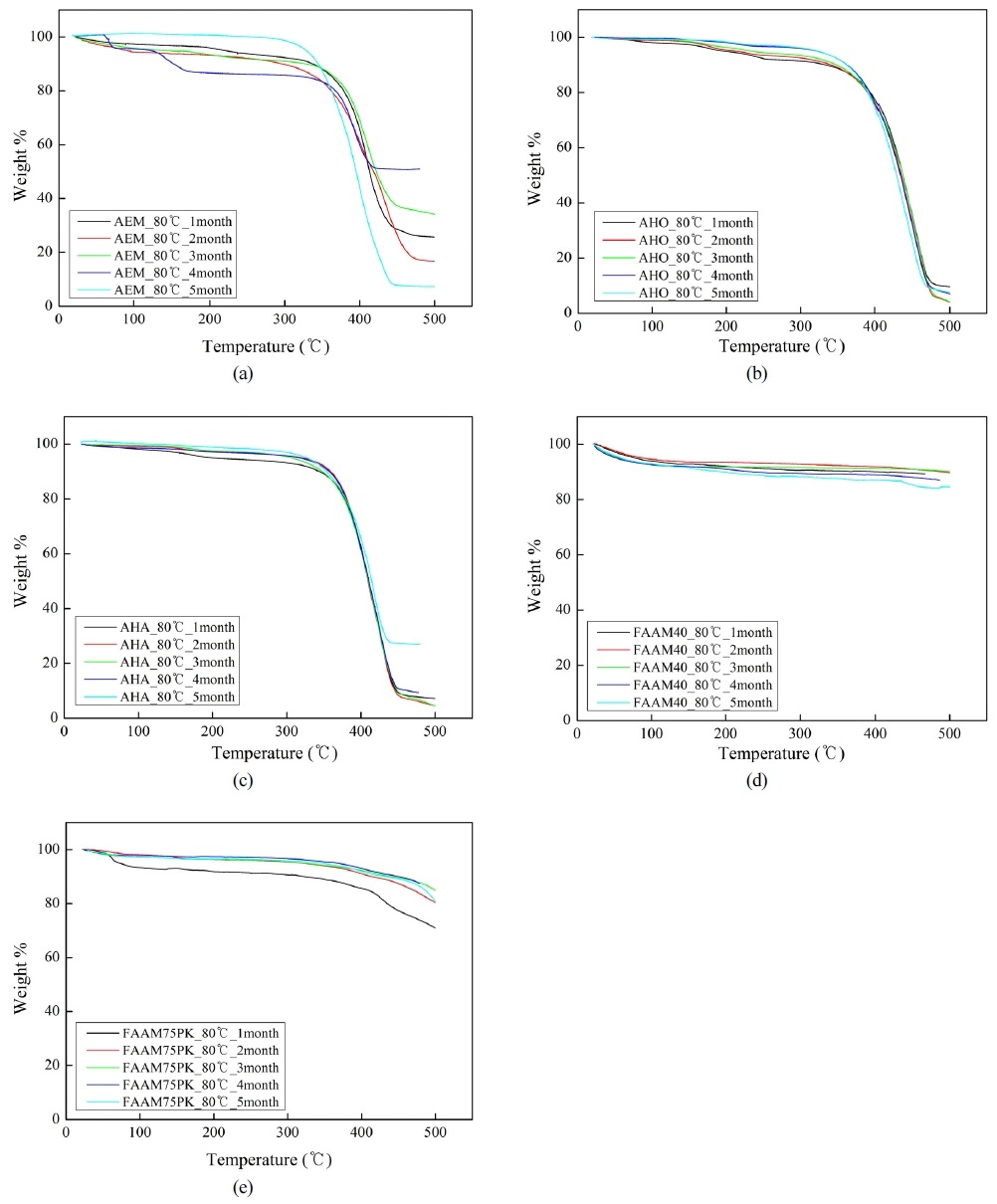
Thermal stability of the membrane analyzed by TGA with the soaking time in 7 M KOH solution and at 80℃. (a) AEM membrane. (b) AHO membrane. (c) AHA membrane. (d) FAAM40 membrane. (e) FAAM75-PK membrane.
AEM 막의 경우, 80℃, 7 M KOH 수용액에 침적한 1-3개월 후에는 약 340℃ 부근까지 질량이 서서히 감소하다가 340℃ 이상에서 질량이 급격하게 감소하였다. 4개월 후에는 약 130-180℃에서 1차 질량 감소가 일어난 후 340℃ 이상에서 질량이 급격하게 감소하였다. 5개월 후에는 310℃ 부근까지 질량이 서서히 감소하다가 310℃ 이상에서 질량이 급격하게 감소하였다. AEM 막에서 4개월 후의 TGA 분석 경향이 다른 침적 시간과 다르게 나타난 원인에 대해서는 아직 불명확하지만, TGA 분석할 때 사용되는 막의 양이 적기 때문에 일어난 측정오차로 판단된다.
AHO 막의 경우, 80℃, 7 M KOH 수용액에 침적한 1-5개월 후에는 모두 약 340℃ 부근까지 질량이 서서히 감소하다가 340℃ 이상에서 질량이 급격하게 감소하였다. AHA 막의 경우, 80℃, 7 M KOH 수용액에 침적한 1-5개월 후에는 모두 약 340℃ 부근까지 질량이 서서히 감소하다가 340℃ 이상에서 질량이 급격하게 감소하였다. FAAM40과 FAAM75-PK 막의 경우 80℃, 7 M KOH 수용액에 침적한 1-5개월 후에는 온도 증가와 함께 질량이 서서히 감소하였지만, 실험의 TGA 측정 범위인 500℃까지는 질량이 급격하게 감소하는 경향은 보이지 않았다.
AEM, AHO와 AHA 막의 경우, 약 340℃ 부근과 310℃ 부근에서 질량이 급속히 감소하는 것은 막을 이루고 있는 고분자의 주 사슬의 분해에 의한 것으로 판단된다.
Fig. 5의 결과로부터 5종류의 상용 막 중에서 FAAM40과 FAAM75-PK 막이 다른 3종류의 AEM, AHO, AHA 막과 비교하여 열적 안정성이 뛰어나다는 것을 알 수 있었다.
이상의 결과로부터, AEM 막이 80℃, 7 M KOH 수용액에서의 침적 시간 5개월 동안 좋은 고온 특성을 보였으며, 다음으로 FAAM40과 FAAM75-PK 막이 침적 시간 5개월 동안 좋은 고온 특성과 열적 안정성을 보인다는 것을 알 수 있었다. 또한 고온 특성 면에서 AEM 막이 다른 막과 비교하여 알칼리 수전해용 음이온교환막으로 충분히 사용 가능할 것으로 판단되었다.
4. 결 론
본 연구에서는 알칼리 수전해용 격막으로 사용 가능성을 평가하기 위해 5종류의 상용 음이온교환막의 80℃, 7 M KOH 수용액에서의 고온 특성을 평가하여 다음과 같은 결론을 얻었다.
1) 80℃, 7 M KOH 수용액에서의 막 저항(침적하기 전)을 측정한 결과, AEM 막이 가장 낮은 값인 0.08 Ω·cm2를 보였으며, 다음으로 FAAM40≒AHA>FAAM75-PK>AHO 막의 순서로 낮은 값을 보였다.
2) 80℃, 7 M KOH 수용액에서 내구성을 측정한 결과, AEM 막이 80℃, 7 M KOH 수용액에서의 침적 시간 5개월 동안 막 저항이 크게 변하지 않음으로써 좋은 내구성을 보였으며, 다음으로 FAAM40과 FAAM75-PK 막이 막 저항은 감소하였지만 좋은 내구성을 보였다.
3) TGA로 분석한 열적 안정성 평가 결과, 80℃, 7 M KOH 수용액에서의 침적 시간 5개월 동안 FAAM40과 FAAM75-PK 막이 다른 3종류의 막과 비교하여 열적 안정성이 뛰어나다는 것을 알 수 있었다.
4) 실험 결과로부터 AEM 막이 80℃, 7 M KOH 수용액에서의 침적 시간 5개월 동안 좋은 고온 특성을 보였으며, 다음으로 FAAM40과 FAAM75-PK 막이 침적 시간 5개월 동안 좋은 고온 특성과 열적 안정성을 보인다는 것을 알 수 있었다.
5) 고온 특성 면에서 AEM 막이 다른 막과 비교하여 알칼리 수전해용 음이온교환막으로 충분히 사용 가능할 것으로 판단되었다.
Acknowledgments
본 연구는 중소벤처기업부의 “중소기업기술혁신개발사업(S2840782)”으로 추진된 것으로 중소벤처기업부의 재정지원에 감사드립니다.
References
- KMD, “Special report for 1.5℃ of global warming: handbook”, Korea Meteorological Agency, Korea, 2020.
- International Energy Agency (IEA), “Net zero by 2050: a roadmap for the global energy”, IEA, 2021. Retrieved from https://iea.blob.core.windows.net/assets/deebef5d-0c34-4539-9d0c-10b13d840027/NetZeroby2050-ARoadmapfortheGlobalEnergySector_CORR.pdf, .
- G. J. Hwang, K. S. Kang, H. J. Han, and J. W. Kim, “Technology trend for water electrolysis hydrogen production by the patent analysis”, Trans Korean Hydrogen New Energy Soc, Vol. 18, No. 1, 2007, pp. 95-108. Retrieved from http://manu.hydrogen.or.kr/archive/archiveViewContents.php, .
-
G. J. Hwang and H. S. Choi, “Hydrogen production systems through water electrolysis”, Membr. J., Vol. 27, No. 6, 2017, pp. 477-486.
[https://doi.org/10.14579/MEMBRANE_JOURNAL.2017.27.6.477]

-
J. W. Park, C. H. Ryu, and G. J. Hwang, “Study on commercially available anion exchange membrane for alkaline water eectrolysis”, Membr. J., Vol. 31, No. 4, 2021, pp. 275-281.
[https://doi.org/10.14579/MEMBRANE_JOURNAL.2021.31.4.275]

-
H. Wendt and H. Hofmann, “Ceramic diaphragms for advanced alkaline water electrolysis”, J. Appl. Electrochem., Vol. 19, 1989, pp. 605-610.
[https://doi.org/10.1007/BF01022121]

-
V. M. Rosa, M. B. F. Santos, and E. P. da Silva, “New materials for water electrolysis diaphragms”, Int. J. Hydrogen Energy, Vol. 20, No. 9, 1995, pp. 697-700.
[https://doi.org/10.1016/0360-3199(94)00119-K]

-
W. Hu, X. Cao, F. Wang, and Y. Zhang, “A novel cathode for alkaline water electrolysis”, Int. J. Hydrogen Energy, Vol. 22, No. 6, 1997, pp. 621-623.
[https://doi.org/10.1016/S0360-3199(96)00191-7]

-
H. S. Choi, C. H. Ryu, S. G. Lee, C. S. Byun, and G. J. Hwang, “Study on anion exchange membrane for the alkaline electrolycsis”, Trans Korean Hydrogen New Energy Soc, Vol. 22, No. 2, 2011, pp. 184-190.
[https://doi.org/10.7316/khnes.2011.22.2.184]

-
I. Vincent, A. Kruger, and D. Bessarabov, “Development of efficient membrane electrode assembly for low cost hydrogen production by anion exchange membrane electrolysis”, Int. J. Hydrogen Energy, Vol. 42, No. 16, 2017, pp. 10752-10761.
[https://doi.org/10.1016/j.ijhydene.2017.03.069]

-
I. Vincent and D. Bessarabov, “Low cost hydrogen production by anion exchange membrane electrolysis: a review”, Renew. Sustain. Energy Rev., Vol. 81, No. 2, 2018, pp. 1690-1704.
[https://doi.org/10.1016/j.rser.2017.05.258]

-
H. Ito, N. Kawaguchi, S. Someya, and T. Munakata, “Pressurized operation of anion exchange membrane water electrolysis”, Electrochim. Acta, Vol. 297, 2019, pp. 188-196.
[https://doi.org/10.1016/j.electacta.2018.11.077]

-
A. Y. Faid, L. Xie, A. O. Barnett, F. Seland, D. Kirk, and S. Sunde, “Effect of anion exchange ionomer content on electrode performance in AEM water electrolysis”, Int. J. Hydrogen Energy, Vol. 45, No. 53, 2020, pp. 28272-28284.
[https://doi.org/10.1016/j.ijhydene.2020.07.202]

-
P. Shirvanian, A. Loh, S. Sluijter, and X. Li, “Novel components in anion exchange membrane water electrolyzers (AEMWE’s): status, challenges and future needs. A mini review”, Electrochem. Com., Vol. 132, 2021, pp. 107140.
[https://doi.org/10.1016/j.elecom.2021.107140]

-
H. Li, N. Yu, F. Gellrich, A. K. Reumert, M. R. Kraglund, J. Dong, D. Aili, and J. Yang, “Diamine crosslinked anion exchange membranes based on poly(vinyl benzyl methylpyrrolidinium) for alkaline water electrolysis”, J. Membr. Sci., Vol. 633, 2021, pp. 119418.
[https://doi.org/10.1016/j.memsci.2021.119418]

-
J. G. Kim, S. H. Lee, S. I. Choi, C. S. Jin, J. C. Kim, C. H. Ryu, and G. J. Hwang, “Application of Psf–PPSS–TPA composite membrane in the all-vanadium redox flow battery”, J. Ind. Eng. Chem., Vol. 16, No. 5, 2010, pp. 756-762.
[https://doi.org/10.1016/j.jiec.2010.07.007]

-
G. J. Hwang, B. M. Gil, and C. H. Ryu, “Preparation of the electrode using NiFe2O4 powder for the alkaline water electrolysis”, J. Ind. Eng. Chem., Vol. 48, 2017, pp. 242-248.
[https://doi.org/10.1016/j.jiec.2017.01.011]

-
G. J. Hwang and H. Ohya, “Crosslinking of anion exchange membrane by accelerated electron radiation as a separator for the all-vanadium redox flow battery”, J. Membr. Sci., Vol. 132, No. 1, 1997, pp. 55-61.
[https://doi.org/10.1016/S0376-7388(97)00040-9]