LiAlH4-PVDF 전해질 복합체의 열확산 및 전기화학적 특성평가
2022 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
A lithium-ion battery exhibits high energy density but has many limitations due to safety issues. Currently, as a solution for this, research on solid state batteries is attracting attention and is actively being conducted. Among the solid electrolytes, sulfide-based solid electrolytes are receiving much attention with high ion conductivity, but there is a limit to commercialization due to the relatively high price of lithium sulfide, which is a precursor material. This study focused on the possibility of relatively inexpensive and light lithium hydride and conducted an experiment on it. In order to analyze the characteristics of LiAlH4, ion conductivity and thermal stability were measured, and a composites mixed with PVDF, a representative polymer electrolyte, was synthesized to confirm a change in characteristics. And metallurgical changes in the material were performed through XRD, SEM, and BET analysis, and ion conductivity and thermal stability were measured by EIS and LFA methods. As a result, Li3AlH6 having ion conductivity higher than LiAlH4 is formed by the synthesis of composite materials, and thus ion conductivity is slightly improved, but thermal stability is rapidly degraded due to structural irregularity.
Keywords:
All-solid state battery, Lithium-based hydrides, Ion conductivity, Thermal conductivity, LiAlH4키워드:
전고체전지, 리튬계 수소화물, 이온전도도, 열전도도, 수소화 알루미늄 리튬1. 서 론
국제적으로 환경 이슈에 대한 관심이 증가하면서 “기후변화에 관한 정부 간 협의체(Intergovernmental Panel on Climate Change, IPCC)”는 현재 에너지 소비에 따른 온실가스의 총배출량 중 약 70%가 화석 연료의 소비로 보고 있으며, 지구온난화 정도를 1.5℃로 제한하기 위해 잔여탄소배출총량(carbon budget)을 500 GtCO2 (이산화탄소톤)로 제한하였다1,2). 국제에너지기구(International Energy Agency, IEA)는 석유를 비롯해 석탄, 이탄, 천연가스 등의 물질을 지금 혹은 그 이상의 속도로 계속해서 채취하고 연소시킬 경우 환경 및 경제, 사회적으로 지속적인 활용이 어려울 것으로 보고 있다3). 이를 해소하기 위해 여러 연구가 진행되고 있는 가운데, 리튬 자원이 기술의 고도화에 따라 청정기술이 개발되면서 차세대 에너지 전략자원으로 여겨지게 되었다. 특히 리튬 이온 배터리는 상대적으로 가볍고 높은 에너지 밀도를 지니고 있어 에너지 저장 및 모빌리티(mobility), 무선 장치 등에 활용하고 있으며, Jaskula 등에 의하면 리튬 화합물에 대한 end-use markets의 약 39% 정도가 배터리에 해당한다고 한다4,5).
그러나 안전성, 비용, 낮은 저온 특성 등으로 인해 여러 문제에 직면하고 있다. 특히, 리튬배터리를 사용하는 핸드폰, 대중교통, 항공기 등에서 화재가 발생하면서 안전성에 대한 걱정과 관심이 증가하였다. 이러한 동향에 따라 전해질이 고체로 구성된 전고체 전지(all-solid battery)가 주목받게 되었다. 기존과는 달리 액체 전해질의 기화로 인한 swelling 현상을 방지할 수 있고, 고체 전해질이 Li dendrites 성장에 대한 장벽으로 작용하여 우수한 안정성을 지니고 있다. 또한, Li metal과 반응하지 않아 Li metal 등의 대용량 전극 소재를 사용해 고용량을 확보할 수 있다6,7).
전고체 전지에 대한 최근 동향은 10-2-10-3 S/cm 이상의 우수한 이온전도도를 지닌 황화물계 전해질에 주목하고 있다. 그러나 황화물계 전해질의 주원료 중 하나인 황화리튬(Li2S)의 높은 가격으로 인해 상업화에 상당한 어려움이 있다. 따라서 가격경쟁력을 확보하기 위해서는 저렴하게 황화리튬을 확보하는 방법이나 대체재에 대한 연구가 요구되고 있다8,9).
이를 고려해 본 연구에서는 리튬계 수소화물 전해질에 주목하였다. 리튬계 수소화물은 상대적으로 저렴하고, 밀도가 낮아 모빌리티의 에너지 효율을 향상시킬 수 있으며, 선행의 연구에서 10-3 S/cm 이상의 높은 이온 전도 특성을 지닌 물질들도 발견되어 높은 잠재력을 지니고 있다10). 우리 연구팀은 여러 리튬계 수소화물의 이온전도도를 분석하여 잠재력 높은 물질을 탐색하는 것을 주목표로 하고 있으며, 해당 연구에서는 복합수소화물 물질인 LiAlH4를 선정해 연구를 진행하였다. LiAlH4는 0.917 g/cm3의 저밀도의 물질로 단사정 구조(monoclinic structure)를 가지고 있다11). 상온에서 10-9 S/cm의 매우 낮은 이온전도도를 가졌지만, 최근 연구에서 turbostratic 구조의 질화붕소(turbostratic boron nitride, t-BN)와의 합성으로 1.2×10-4 S/cm의 준수한 이온전도도를 확보하는 결과가 확인되었다12). 이를 바탕으로 다른 물질과 혼합한 복합 전해질 형성을 고려하였으며, 상대적으로 우수한 전기화학 및 열적 안정성을 지닌 PVDF를 선택하여 실험을 진행하였다13).
2. 실험 방법
2.1 Cell 제조
상대적인 이온전도도를 비교 분석하기 위해 전형적인 액체 전해질 cell을 제조하였다. Cathode 제조를 위해 활물질로는 LiCoO2 (99.8%; Sigma-aldrich, St. louis, MO, USA)를 선정하였으며, carbon black (Timcal [Imerys Graphite & Carbon], Bodio, Switzerland)과 poly vinylidene fluoride (PVDF; Sigma-Aldrich), N-Methyl-2-Pyrrolidinone (NMP; Sigma-Aldrich)을 일정 질량비로 혼합하였다. Cell 조립에는 1M LiPF6/EC:DEC (7:3 mass%) 액체 전해질과 poly propylene (PP) 분리막, Li metal (Wellcos, Gunpo, Korea)을 사용하여 진행하였다.
PVDF와 NMP를 1:10의 질량비로 플레이트 장비를 통해 30℃의 온도에서 300 RPM의 속도로 약 1시간 동안 혼합하였다. 이후 LiCoO2와 Carbon black, PVDF를 7:2:1의 질량비로 hand-mixing하여 약 1시간 동안 균일하게 교반하였다. 균일한 전극 제조를 위해 NMP로 점도를 조절하였다. Cathode 혼합물을 film applicator를 이용해 20 µm 두께로 Al foil에 도포하고 110℃의 진공 오븐에서 약 3시간 정도 건조하였다. 건조된 전극을 지름 16 mm로 cutting하고 1 M LiPF6/EC:DEC (7:3 mass%)와 PP 분리막, Li metal을 순서대로 적층하여 cell을 제조하였다. Cell 조립 중 Li metal이 산화되는 것을 방지하기 위해 Ar 분위기의 글로브박스에서 진행되었다(H2O<0.1 ppm).
LiAlH4의 특성을 분석하기 위해 LiAlH4 (95%, Aldrich) 물질을 사용하였다. LiAlH4와의 합성을 위해 PVDF와 NMP를 질량 기준 1:10 비율로 비커에 넣고 magnetic stirring 방법을 이용해 30℃의 온도에서 300 RPM으로 1시간 동안 교반하였다. 균일 합성된 PVDF가 이온 전도 및 열 전도에 미치는 영향을 분석하기 위해 LiAlH4와 PVDF의 비율을 9:1, 8:2, 7:3, 6:4의 질량비로 hand-mixing하여 제조하였다. 이 때, LiAlH4가 수분과 반응하는 것을 최소화하기 위해 Ar 분위기에서 소량씩 첨가하면서 제조하였다. 이후 Ar 분위기에서 72시간 상온 건조를 통해 전해질 복합체를 제조하였다.
전해질 pellet을 제조하기 위해 LiAlH4 및 복합체 분말을 지름 14 mm SUS mold에 넣고 300 MPa로 가압하여 5분간 유지하였다. 제조된 전해질 pellet은 이온전도도를 분석하기 위해 양면에 Li metal을 접합해 Ar 분위기에서 대칭 cell을 제조하였다.
2.2 특성 평가
전해질 복합체 제조에 따른 구조적 변화가 이온 전도 및 열적 특성 변화에 미치는 영향을 확인하기 위해 X-ray diffraction (XRD), scanning electron microscope (SEM), Brunanuer-Emmett-Teller (BET) 분석으로 야금학적 특성을 분석하였다. 물질의 결정 구조 및 상 분석은 XRD (D8 Advance, Bruker, Billerica, MA, USA)를 통해 진행되었다. X선 target은 1.5405Å의 Cu Kα, scanning speed는 5 deg/min, scanning range는 20-80°였다. 주사전자현미경(scanning electron microscopy [SEM], Quanta-400, FEI Company, Hillsboro, OR, USA)을 사용해 복합체의 질량비에 따른 시료의 표면 형상 변화를 관찰하고, 비표면적 측정 장비(brunauer-emmett-teller surface analysis [BET], Micromeritics 3-Flex, Micromeritics, Norcross, GA, USA)를 통해 시료의 표면적 변화를 확인하였다
전기화학적 임피던스 측정기(electrochemical impedance spectroscopy [EIS], nstat, IVIUM, Eindhoven, Nederland)를 사용해 전해질의 저항 변화를 파악하였다. 1 MHz-0.1 Hz의 주파수 범위와 진폭 10 mV의 조건으로 진행되었으며, 측정된 저항을 Eq.1을 통해 이온전도도를 계산하였다. 이때 σ는 이온전도도, Rb는 벌크 전해질의 저항, A는 단면적, L은 두께를 의미한다14).
| (1) |
열 안전성 평가는 laser flash analysis (LFA) 방법으로 열 확산도를 분석하여 이루어졌다. 측정을 위해 지름 10 mm의 SUS mold에 넣어 200 MPa로 압축하여 두께 1 mm 이내의 pellet을 제조하였다. 양면에 Li metal을 접합하고 300-400 K의 온도 범위에서 열 확산도 측정기(laser flash analysis [LFA]; TC-9000H, ULVAC, Chigasaki, Japan)로 열 확산도를 측정하였다. Eq.2를 통해 열 전도도를 계산하였다. 이때, k는 열 전도도, α는 열 확산도, ρ는 밀도, 는 Cp비열을 의미한다15).
| (2) |
3. 결과 및 고찰
3.1 합성 및 전해질 제조
선행의 연구를 고려할 때 전반적으로 리튬계 수소화물의 상온 이온전도도는 상당히 낮다. 이를 고려해 상대적으로 우수한 이온전도도 및 열 안정성을 지닌 PVDF 고분자 전해질을 일정 성분비로 합성한 복합체를 제조하였다. 단, LiAlH4의 경우 수분과의 반응 시 수소를 방출하며 열이 발생하기 때문에 NMP 용매와의 반응성을 우선적으로 확인할 필요가 있다16). Fig. 1은 합성 과정에서 복합체의 반응 여부를 보여주고 있다. 지속적으로 기포가 발생하는 것을 확인할 수 있었으며, 이를 통해 LiAlH4와 NMP 용매가 반응한다는 것을 확인할 수 있었다. 이러한 과정은 Ar 분위기의 글로브박스에서도 조금씩 나타났으며, 해당 과정으로 인해 균일한 전극의 제조는 어려울 것으로 판단되어 이온전도도 분석은 대칭셀의 형태로 진행하였다. 대칭셀의 형태는 cell 내부의 특정 영역에 대하여 한정적으로 분석할 수 있기 때문에 전해질인 LiAlH4와 복합체의 전해질 특성을 분석하는 데 적합하다고 적용하였다17). 그리고 반응열에 의해 불규칙한 전해질이 형성된 것을 고려해 분쇄 및 압축 과정을 추가해 전해질 pellets를 제조하였다.
3.1 LiAlH4 및 전해질 복합체 야금학적 특성평가
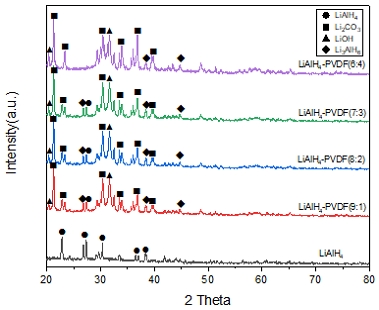
Fig. 2는 전해질 복합체의 질량비에 따른 XRD patterns을 보여주고 있다. LiAlH4의 경우 θ=23, 27에서 강한 peaks를 보여주었으며, 이론적인 XRD data와 일치하는 것을 확인할 수 있었다18). ICDD를 통해 이론과 같은 단사정(monoclinic) 구조를 갖는 것을 알 수 있었다. LiAlH4-PVDF의 경우 다수의 Li2CO3와 LiOH, Li3AlH6의 peaks가 관측되었으며, 기존의 LiAlH4와는 전혀 다른 XRD 데이터를 보였다. ICDD에 의한 분석에 따라 Li2CO3는 단사정(monoclinic) 구조, LiOH와 Li3AlH6의 경우 정방정(tetragoanl) 구조인 것을 확인하였다. 이러한 부산물의 형성은 LiAlH4와 PVDF가 용해된 NMP 용매와의 반응에 의한 것으로 보인다. LiAlH4는 수분과의 반응 시 LiOH와 수소를 형성하는 발열반응이 일어난다(ΔH° =-599.6 kJ)19). Ares 등20)에 따르면 약 150-175℃의 온도 범위에서 LiAlH4가 5.3 wt%의 수소를 방출하면서 Li3AlH6로 분해되는데, 수분과의 반응으로 발생한 엔탈피의 변화로 Li3AlH6의 분해가 촉진된 것으로 판단된다. 이론적으로 LiAlH4의 이온전도도가 약 8.7×10-9 to 4.6×10-6 S/cm, Li3AlH6는 약 1.4×10-7 to 1.6×10-5 S/cm의 이온전도도를 갖는 것을 고려할 때 LiAlH4와 PVDF-NMP의 부반응에 의한 Li3AlH6의 형성은 재료의 이온전도 특성에 영향을 미칠 것으로 판단된다21).
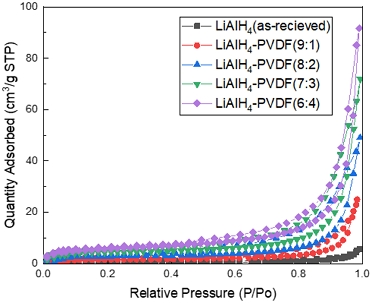
Fig. 3은 전해질 복합체의 비표면적 변화를 나타내는 그래프이다. 전해질 물질들의 N2에 대한 흡착 거동을 나타내며, 비표면적 변화를 비교하기 위해 Table 1에 정리하였다. LiAlH4의 비표면적은 약 3.6679 m2/g으로 계산되었으며, LiAlH4-PVDF 복합체 형성에 따라 급격히 증가하는 것을 확인되었다. 특히, LiAlH4와 PVDF의 질량비가 8:2 이상일 때 비표면적이 급격하게 증가하였다. 이러한 비표면적의 변화는 PVDF에 의한 구조적 변화에 의한 것으로 보인다. PVDF 등의 polymer계 물질은 용매에 해리된 후 finger-like나 sponge-like와 같은 다공성의 구조를 갖는데 이러한 구조적 변화는 다수의 기공을 형성하고 비표면적의 증가시킬 수 있다22). 다공성 구조는 높은 비표면적으로 인해 리튬 이온의 이동 경로를 단축시키기 때문에 이온전도도를 향상시킬 가능성이 높다23).
전해질 복합체의 구조적 변화는 Fig. 4의 SEM 표면 형상 이미지를 통해 알 수 있었다. LiAlH4는 전반적으로 1-5 µm의 크기를 가진 비정질 상의 미세결정들이 관찰되었다. LiAlH4-PVDF들의 이미지에서는 1 µm 이하의 미세결정과 군집체가 형성된 것을 확인할 수 있었으며, 질량비가 7:3, 6:4일 때 두드러지는 차이를 관찰할 수 있었다. 또한, 7:3, 6:4 비율의 복합체의 10,000배율의 이미지 상에서 복잡한 다공성 혹은 그물형 구조를 볼 수 있었다. 이러한 구조적 변화는 합성 과정에서 PVDF에 의해 복잡한 구조가 형성되고, 내부를 LiAlH4가 차지하면서 형성된 것으로 판단된다. 결과적으로 구조적 변화로 인해 리튬 이온의 이동 속도가 증가하여 이온전도도가 상승할 것으로 보인다.
3.2 Electrochemical impedance spectroscopy (EIS)
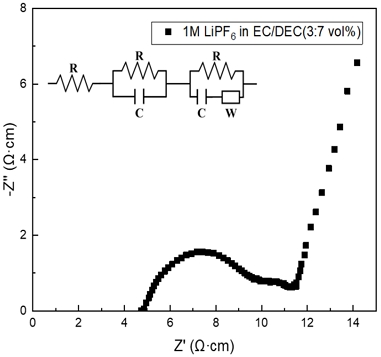
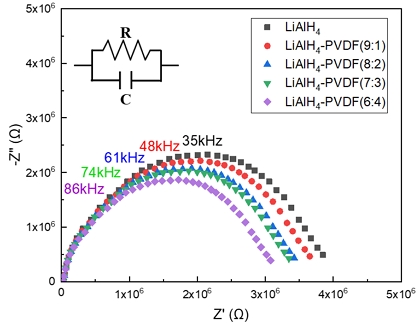
Figs. 5, 6은 제조된 cell의 Nyquist plots를 나타내고 있으며, 측정값들은 Table 2에 정리하였다. 측정된 1M LIPF in EC/DEC (7:3 mass%)의 벌크 저항은 약 3.86 Ω∙cm로 확인되었으며 이때 1.02×10-3 S/cm의 높은 이온전도도를 보여주었다. 이에 비해 LiAlH4는 약 3.32×106 Ω∙cm의 높은 저항값이 나타났으며, 이온전도도는 약 2.32×10-8 S/cm로 확인되었다. 복합체의 PVDF 조성의 증가에 따라 저항은 점차 감소해 이온전도도가 증가하였다. 이러한 결과는 앞서 언급한 것과 같이 PVDF의 조성이 증가함에 따라 복잡한 다공성 구조를 형성하면서 비표면적이 증가한 것이 주원인으로 보인다. 또한, 선행의 연구를 고려할 때 높은 유전상수(ε=8.4)를 가진 electron-withdrawing group의 PVDF의 주사슬이 리튬염의 이온화를 촉진하고 리튬 이온의 농도 및 이동율(migration rate)을 향상시켜 이온전도도를 향상시키는 과정도 다소 기인한 것으로 판단할 수 있다24). 결과적으로 PVDF와의 복합체 합성을 통해 이온전도도는 최대 2.57×10-8 S/cm까지 개선되었다. 그러나 현저히 낮은 전도 특성으로 인해 상용화에는 제한이 있으며, 높은 이온전도도를 얻기 위해 추가적인 후속 연구가 요구된다.
3.3 Laser flash analysis (LFA)
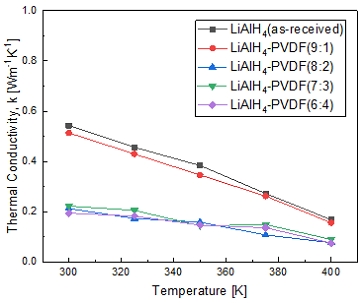
물질의 열 전도도 변화를 Fig. 7에 나타내었다. 열 전도도는 온도의 증가에 따라 점차 감소하는 경향을 보이는 것을 알 수 있었다. 이러한 거동은 보통 세라믹 등의 물질에서 나타나는데, 고체 내의 열전도가 자유 전자보다 격자 진동(phonon)에 의한 전도가 지배적인 경우에 이러한 변화를 보인다25). 상온에서의 측정된 수치에 대해서는 Table 3에 표시하였다. LiAlH4의 열 전도도는 약 0.543 W∙m-1 K-1로 400 K에서는 0.168 W∙m-1 K-1까지 감소하였다. LiAlH4-PVDF 복합체의 경우 이보다 더 낮은 수치를 보여주었으며, 6:4의 질량비의 복합체에서는 0.194-0.074 W∙m-1 K-1의 가장 낮은 전도도를 보였다. Sintered LLZO가 0.47 W∙m-1 K-1의 열 전도 특성을 보이는 것을 고려할 때 상대적인 열 전도도는 sintered LLZO와 유사하거나 조금 높다는 것을 알 수 있으며26), LiAlH4-PVDF의 질량비가 8:2 이상으로 PVDF가 합성될 경우 열 안정성이 급격히 감소하는 것을 확인할 수 있었다. 합성에 따른 열 전도도의 감소는 Fig. 2의 SEM 이미지 상에서 PVDF로 인한 구조적 변화를 고려할 때 불규칙한 구조의 형성으로 인한 phonon scattering의 증가로 인해 감소한 것으로 판단된다27). 결론적으로 LiAlH4와 LiAlH4-PVDF (9:1)가 가장 높은 열적 안정성을 가지고 있다고 볼 수 있다.
4. 결 론
낮은 밀도를 가져 경량성 배터리 연구에 이점이 있는 LiAlH4의 이온전도도 및 열전도도를 분석하고 이를 개선하기 위해 polymer계 물질인 PVDF와의 복합체를 형성하여 실험을 진행하였다. 비교 분석을 위해 LiAlH4와 PVDF의 질량비를 다르게 하여 상대적 차이를 비교 분석하였으며, 다음과 같은 결과를 얻을 수 있었다.
1) XRD 분석을 통해 LiAlH4가 이론과 같은 단사정(monoclinic) 구조를 가지고 있는 것을 확인할 수 있었으며, peaks의 변화를 통해 NMP 용매와의 부반응 일어난 것을 확인할 수 있었다. 부반응을 통해 LiOH와 Li2CO3, Li3AlH6가 형성되었으며, 형성된 Li3AlH6는 LiAlH4보다 높은 이온전도도를 가지고 있어 긍정적인 영향을 미칠 것으로 판단된다.
2) SEM 표면 형상 분석으로 LiAlH4가 1-5 µm 크기의 비정질 상의 미세입자로 구성되어 있으며, PVDF와의 합성으로 1 µm 이하의 미세결정이 증가한 것을 확인하였다. 또한, PVDF에 의해 물질 내부에 부분적인 다공성 군집체가 관측되었다. 이러한 구조적 변화는 BET 분석에서 비표면적의 변화를 보여주었고, 비표면적이 높을수록 리튬 이온 경로가 단축되어 이온전도도가 증가하는 것을 고려할 때 이온전도도가 개선될 것으로 나타난다.
3) 임피던스 분석 결과 상온에서의 LiAlH4의 이온전도도는 약 2.32×10-8 S/cm였으며, 1M LIPF in EC/DEC (7:3 mass%)에 비해 상당히 낮은 전도 특성을 보였다. 복합체의 경우 이보다 조금 개선된 2.57×10-8 S/cm인 것을 계산을 통해 분석할 수 있었으며, 이온전도도의 향상은 PVDF에 의한 리튬 이온의 농도 및 이동율(migration rate)의 증가에 기여한 것으로 고려된다. 결과적으로 상당히 낮은 이온전도도로 인해 상용화에는 제한이 있다.
4) 열 안정성 분석을 위해 시행한 LFA 분석 과정에서 LiAlH4의 열 전도도를 계산할 수 있었다. 상온(300 K) 조건에서의 LiAlH4의 열 전도도는 약 0.543 W∙m-1 K-1 정도였으며, 이러한 수치는 sintered LLZO보다 조금 높은 수준이었다. LiAlH4-PVDF 합성으로 인해 최소 0.194 W∙m-1 K-1까지 급격히 감소하였으며, 이런 질량비에 따른 차이는 구조적 불규칙성의 증가로 인해 phonon scattering이 증가한 것이 원인으로 판단된다.
5) 전반적인 결과를 고려할 때 PVDF와의 합성으로 구조적 변화를 유도해 LiAlH4의 이온전도도를 개선하였지만, 열 안정성을 오히려 낮추는 결과를 초래하였다. 상용화를 고려할 때 PVDF와의 합성은 열 안정성을 저하시킬 수 있어 열 안정성을 향상 혹은 개선할 수 있는 추가적인 연구가 요구된다.
Acknowledgments
본 연구는 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구(2019R1F1A1041405)와 교육부가 지원하는 한국기초과학지원연구원을 통한 기초과학연구역량강화사업(국가연구시설장비진흥센터, 2019R1A6C1010047)의 지원에 의해 수행되었으며, 이에 감사드립니다.
References
-
J. Rockström, G. Brasseur, B. Hoskins, W. Lucht, J. Schellnhuber, P. Kabat, N. Nakicenovic, P. Gong, P. Schlosser, M. M. Costa, A. Humble, N. Eyre, P. Gleick, R. James, A. Lucena, O. Masera, M. Moench, R. Schaeffer, S. Seitzinger, S. van der Leeuw, B. Ward, N. Stern, J. Hurrell, L. Srivastava, J. Morgan, C. Nobre, Y. Sokona, R. Cremades, E. Roth, D. Liverman, and J. Arnott, “Climate change: the necessary, the possible and the desirable Earth League climate statement on the implications for climate policy from the 5th IPCC Assessment”, Earth's Future, Vol. 2, No. 12, 2014, pp. 606-611.
[https://doi.org/10.1002/2014EF000280]

-
J. A. Lowe and D. Bernie, “The impact of Earth system feedbacks on carbon budgets and climate response”, Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences, Vol. 376, No. 2119, 2018, pp. 20170263.
[https://doi.org/10.1098/rsta.2017.0263]

-
L. A. Gil-Alana and M. Monge, “Lithium: production and estimated consumption. Evidence of persistence”, Resources Policy, Vol. 60, 2019, pp. 198-202.
[https://doi.org/10.1016/j.resourpol.2019.01.006]

-
M. Gutsch and J. Leker, “Global warming potential of lithium-ion battery energy storage systems: a review”, Journal of Energy Storage, Vol. 52, 2022, pp. 105030.
[https://doi.org/10.1016/j.est.2022.105030]

- B. Jaskula, “Mineral commodity summaries 2017”, U. S. Geological Survey. Retrieved from https://minerals.usgs.gov/minerals/pubs/commodity/lithium/, .
-
M. Y. Cho and J. W. Jo, “Safe storage rack to prevent fire propagation when lithium batteries, powered by drones, are fired”, Journal of Digital Contents Society, Vol. 22, No. 7, 2021, pp. 1125-1133.
[https://doi.org/10.9728/dcs.2021.22.7125]

-
J. Kim, J. Oh, J. Y. Kim, Y. G. Lee, and K. M. Kim, “Recent progress and perspectives of solid electrolytes for lithium rechargeable batteries”, Journal of the Korean Electrochemical Society, Vol. 22, No. 3, 2019, pp. 87-103.
[https://doi.org/10.5229/JKES.2019.22.3.87]

-
A. Hayashi, A. Sakuda, and M. Tatsumisago, “Development of sulfide solid electrolytes and interface formation processes for bulk-type all-solid-state Li and Na batteries”, Frontiers in Energy Research, Vol. 4, 2016, pp. 25.
[https://doi.org/10.3389/fenrg.2016.00025]

-
Y. Zhang, M. X. Xie, W. Zhang, J. L. Yan, and G. Q. Shao, “Synthesis and purification of SiS2 and Li2S for Li9.54Si1.74P1.44S11.7Cl0.3 solid electrolyte in Lithium-ion batteries”, Materials Letters, Vol. 266, 2020, pp. 127508.
[https://doi.org/10.1016/j.matlet.2020.127508]

-
M. Matsuo, Y. Nakamori, and S. Orimo, “Lithium superionic conduction in lithium borohydride accompanied by structural transition”, Applied Physics Letters, Vol. 91, No. 22, 2007, pp. 224103.
[https://doi.org/10.1063/1.2817934]

-
J. C. Fallas, W. M. Chien, D. Chandra, V. K. Kamisetty, E. D. Emmons, A. M. Covington, R. Chellappa, S. A. Gramsch, R. J. Hemley, and H. Hagemann, “Raman spectroscopy measurements of the pressure-temperature behavior of LiAlH4”, J. Phys. Chem. C, Vol. 114, No. 27, 2020, pp. 11991-11997.
[https://doi.org/10.1021/jp1015017]

-
Y. Nakagawa, T. Kimura, S. Isobe, and T. Shibayama, “Effects of defective boron nitride additives on lithium-ion conductivity and hydrogen-desorption properties of LiAlH4”, J. Phys. Chem. C, Vol. 124, No. 19, 2020, pp. 10398-10407.
[https://doi.org/10.1021/acs.jpcc.0c02312]

-
Y. Wu, Y. Li, Y. Wang, Q. Liu, Q. Chen, and M. Chen, “Advances and prospects of PVDF based polymer electrolytes”, Journal of Energy Chemistry, Vol. 64, 2022, pp. 62-84.
[https://doi.org/10.1016/j.jechem.2021.04.007]

-
J. Cheng, W. Bao, D. Zhu, C. Tian, Q. Yin, and M. Ding, “Preparation of CE0.8GD0.2O1.9 solid electrolyte by the sol-combustion method”, J. Chil. Chem. Soc., Vol. 54, No. 4, 2009, pp. 445-447.
[https://doi.org/10.4067/S0717-97072009000400027]

-
M. C. Pang, K. Yang, R. Brugge, T. Zhang, X. Liu, F. Pan, S. Yang, A. Aguadero, B. Wu, M. Marinescu, H. Wang, and G. J. Offer, “Interactions are important: linking multi-physics mechanisms to the performance and degradation of solid-state batteries”, Materials Today, Vol. 49, 2021, pp. 145-183.
[https://doi.org/10.1016/j.mattod.2021.02.011]

- G. C. Gerrans, R. Hartmann-Petersen, and P. Hartmann-Petersen, “Sasol science and technology encyclopaedia book”, New Africa Education Publishing, South Africa, 2004, pp. 143.
-
C. H. Chen, J. Liu, and K. Amine, “Symmetric cell approach and impedance spectroscopy of high power lithium-ion batteries”, Journal of Power Sources, Vol. 96, No. 2, 2001, pp. 321-328.
[https://doi.org/10.1016/S0378-7753(00)00666-2]

-
L. Wang and K. F. Aguey-Zinsou, “Synthesis of LiAlH4 nanoparticles leading to a single hydrogen release step upon Ti coating”, Inorganics, Vol. 5, No. 2, 2017, pp. 38.
[https://doi.org/10.3390/inorganics5020038]

- F. A. Cotton, G. Wilkinson, and P. L. Gaus, “Basic inorganic chemistry”, 3rd ed, John Wiley & Sons, USA, 1995, pp. 8.
-
J. R. Ares, K. F. Aguey-Zinsou, M. Porcu, J. M. Sykes, M. Dornheim, T. Klassen, and R. Bormann, “Thermal and mechanically activated decomposition LiAlH4”, Materials Research Bulletin, Vol. 43, No. 5, 2008, pp. 1263-1275.
[https://doi.org/10.1016/j.materresbull.2007.05.018]

-
H. Oguchi, M. Matsuo, T. Sato, H. Takamura, H. Maekawa, H. Kuwano, and S. Orimo, “Lithium-ion conduction in complex hydrides LiAlH4 and Li3AlH6”, Vol. 107, 2010, pp. 096104.
[https://doi.org/10.1063/1.3356981]

-
A. Magistris, P. Mustarelli, F. Parazzoli, E. Quartarone, P. Piaggio, and A. Bottino, “Structure, porosity and conductivity of PVdF films for polymer electrolytes”, Journal of Power Sources, Vol. 97-98, 2001, pp. 657-660.
[https://doi.org/10.1016/S0378-7753(01)00644-9]

-
G. L. Ji, B. K. Zhu, Z. Y. Cui, C. F. Zhang, and Y. Y. Xu, “PVDF porous matrix with controlled microstructure prepared by TIPS process as polymer electrolyte for lithium ion battery”, Polymer, Vol. 48, No. 21, 2007, pp. 6415-6425.
[https://doi.org/10.1016/j.polymer.2007.08.049]

-
X. Liang, D. Han, Y. Wang, L. Lan, and J. Mao, “Preparation and performance study of a PVDF–LATP ceramic composite polymer electrolyte membrane for solid-state batteries”, RSC Advances, Vol. 8, No. 71, 2018, pp. 40498-40504.
[https://doi.org/10.1039/C8RA08436J]

-
W. Yang, S. Sokhansanj, J. Tang, and P. Winter, “PH—postharvest technology: determination of thermal conductivity, specific heat and thermal diffusivity of borage seeds”, Biosystems Engineering, Vol. 82, No. 2, 2002, pp. 169-176.
[https://doi.org/10.1006/bioe.2002.0066]

-
R. Bock, M. Onsrud, H. Karoliussen, B. G. Pollet, F. Seland, and O. S. Burheim, “Thermal gradients with sintered solid state electrolytes in lithium-ion batteries”, Energies, Vol. 13, No. 1, 2020, pp. 253.
[https://doi.org/10.3390/en13010253]

-
J. J. Lin and C. Y. Wu, “Disorder dependence of electron-phonon scattering time in bulk Ti1-xAlx Alloys”, Europhysics Letters, Vol. 29, No. 2, 1995, pp. 141. Retrieved from https://iopscience.iop.org/article/10.1209/0295-5075/29/2/006/meta, .
[https://doi.org/10.1209/0295-5075/29/2/006]