광전기화학 물분해 수소 제조 기술에서 수소화효소 엔자임 활용
2022 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
There is growing interest in sustainable energy sources that can reduce fossil fuel dependence and environmental pollution while meeting rapidly growing energy demands. Hydrogen have been investigated as one of the ideal alternative energies because it has relatively high efficiency without emitting pollutants. The light-sensitized enzymatic (LSE) system, which uses hydrogenase-enzymes, is one of the methods towards economically feasible system configurations that enhance the rate of hydrogen generation. Hydrogenase is an enzyme that catalyzes a reversible reaction that oxidizes molecular hydrogen or produces molecular hydrogen from protons and electrons. In this paper, utilization of [NiFe]-hydrogenase (from Pyrococcus furiosus) in photoelectrochemical hydrogen production system such as handling, immobilization, physicochemical and electrochemical analysis, process parameters, etc. was introduced.
Keywords:
Photoelectrochemical water splitting, Hydrogen, Hydrogenase enzyme, Enzymatic cathode, Photocatalyst키워드:
광전기화학적 물분해, 수소, 수소화효소, 엔자임고정화 캐소드, 광촉매1. 서 론
과도한 화석연료 사용에 따른 이산화탄소 축적은 전 지구적 기후변화를 야기하였으며, 한파, 폭염, 가뭄과 같은 극한 기상 현상의 빈도와 강도를 증가시키고 있다. 화석연료의 높은 의존도는 기후 변화뿐만 아니라 경제, 에너지 안보 차원에서 국제 정세에도 큰 영향을 끼치고 있다. 미국 에너지 정보청(U. S. Energy Information Administraction)이 발간한 2021 국제에너지전망(2021 International Energy Ourlook, IEO 2021)에 따르면 아시아의 전력 생산량은 경제 및 소득 성장으로 인해 2019년에서 2050년 사이에 두 배 이상 증가할 것이라고 예측하였다1). 급증하는 에너지 요구를 충족하면서 화석연료 의존도와 환경오염을 줄이기 위해서는 지속 가능한 에너지 자원에 대한 연구가 필수적이다.
수소에너지는 오염물질을 배출하지 않고 비교적 효율이 높기 때문에 화석연료가 주를 이루는 기존 에너지원에 대한 이상적인 대안에너지 중 하나로서 전 세계적으로 큰 주목을 받고 있다. 수소는 물이나 탄화수소, 기타 유기물질에 결합되어 있기 때문에 이러한 화합물에서 수소를 분리하기 위한 다양한 기술이 도입되었다. International Energy Agency (IEA)에 따르면 2018년 기준으로 세계 수소생산량은 74천 만 톤이다. 이 중 76%가 천연가스에서 생산되며, 23%가 석탄, 나머지가 물전기분해에 의한 생산이다2,3). 대부분이 탄소를 배출하는 공정에 의한 수소생산법으로 환경오염 및 이산화탄소 배출 문제를 해결하기 위한 실질적인 탄소 중립을 이루기 위해서는 친환경적인 수소생산 방법을 개발하고 그 비율을 높여야 한다.
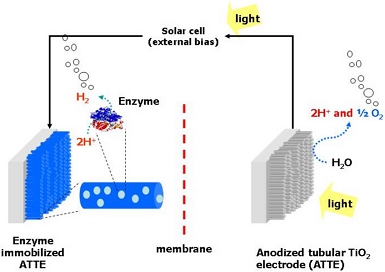
수소에너지로 전환시킬 수 있는 에너지원으로서 태양에너지는 풍부하고 쉽게 이용 가능하다는 장점이 있다4). 태양에너지를 활용할 수 있는 방법으로 광전기화학(photoelectrochemical, PEC) 방법은 광촉매와 전기화학적 기술이 결합된 수소 제조 공법이다. Fig. 1은 엔자임을 활용한 광전기화학적 셀(PEC cell)의 구조와 작동 원리를 핵심적으로 보여준다5). 광어노드(photoanode)와 캐소드(cathode), 분리막, 전해질, 외부바이어스로 구성된다. 광어노드에 밴드갭 이상의 빛 에너지가 조사(irradiation)되면, 광여기(photo-excited)된 전자가 분리되어 외부 회로를 통해 캐소드로 이동하고 효소의 활성 부위에서 양성자를 수소로 환원시키는 데 사용된다. 소용량의 태양전지가 외부전압원으로 사용될 수 있으면 광촉매와 전해질간의 상호작용에 의해 발생되어 원활한 전자 전달에 요구되는 최소 전위차 이상을 얻을 수 있어 목적 달성이 더 용이해진다.
수소제조효율은 PEC 시스템을 구성하는 다양한 요소들의 최적 조합에 의해 결정된다. 구성요소 중 캐소드는 전해질과 직접 계면을 형성하여 수소를 생성하며 주로 백금을 사용해왔다6). Nam 등7)은 TiO2나노튜브 기반의 Pt/TiO2 캐소드를 제조하고 해수 전해질에서 광전기화학적 수소생산율을 측정하였다. 가장 높은 수소생산율은 약 277 µmol cm-2hr-2로서 Ti metal, Enzyme/TiO2, Pt mesh와 비교하여 시간당 더 높은 수소생산효율을 나타냈다7). 하지만 백금을 비롯한 귀금속은 국제정세와 경제적 측면에서 민감도가 매우 높은 편이다. 온라인 글로벌 귀금속 전문거래소 불리언볼트(BullionVault)에 따르면 백금의 가격은 28,335.58 USD/kg (2022년 7월 20일 기준)이며 이는 한화로 37,158,712.9 원(2022년 7월 20일 환율 기준)이다. 실용화를 위한 시스템 대면적화 관점에서 경제성이 떨어지기 때문에 백금을 대체할 수 있는 경제성과 효율성을 갖춘 물질을 개발하고 적용하는 연구가 요구된다. 엔자임(enzyme)을 활용한 전극 개발은 대량생산, 경제적 측면에서 앞서 언급한 문제점들을 해결할 이상적인 대안책이 될 수 있다.
따라서 본고에서는 광전기 화학적 물분해 수소제조 시스템에서의 수소화효소의 활용, 취급 및 고정화 방법, 분석 방법, 공정 변수 그리고 진행 상황과 향후 계획 등을 정리 및 소개하고자 한다.
2. 수소화효소 엔자임 활용
2.1 엔자임 종류
위에 언급한 대로, 수소화효소(hydrogenase)를 활용하여 PEC기술과 광바이오 기술이 융합된 시스템을 구성할 수 있다. 수소화효소는 수소분자를 산화시키거나 양성자와 전자로부터 수소분자를 생성하는 가역 반응에서 촉매로 작용하는 효소이다. 이 효소는 활성 부위에 포함된 금속 이온에 따라 (NiFe)-, (FeFe)-, (Fe)-수소화효소로 분류된다. (NiFe)-수소화효소는 박테리아와 고세균, 특히 100℃ 근처에서 최적으로 성장하는 Pyrococcus furiosus (Pfu)에서 발견된다. (FeFe)-수소화효소는 박테리아와 일부 진핵생물에서 발견되며, (Fe)-수소화효소는 고세균에서만 발견된다. 본고에서 주로 언급될 Pfu (21,834 unit/mL)의 활성은 Tri-HCl (50 mM, pH 8.5, 50℃, absorbance at 570 nm)에서 측정한 결과, Clostridium butyricum (1,442 unit/mL)와 Thiocapsa reseoperisicina (1,704 unit/mL)의 활성보다 높은 것으로 나타났다. Pfu의 비활성(specific activity, unit/mg, bio-rad protein assay, absorbance at 750 nm)은 후자의 수소화효소보다 2-3배 높았다8,9). Pfu에서 추출한 cytoplasmic (NiFe)-수소화효소(Kefafase, USA)는 150 kDa의 몰질량을 갖는 효소이며 1 unit 당 1 µmol H2 mg-1min-1의 수소생산효율을 가진다. 열 및 화학시약에 의한 불활성화에 강한 내성을 갖는 반면, 산소에 매우 민감한 특징을 갖기 때문에 취급에 주의해야 한다(Fig. 2).
2.2 엔자임 고정화(immobilization)
본고에서 소개할 엔자임 고정화는 반데르발스힘(Van der Waals force)에 의한 물리적 흡착과 화학적 결합에 의한 고정화이다. 두 방법 모두 다양한 지지체에 적용 가능하지만 본고에서는 양극산화공법을 통해 제조한 TiO2 나노튜브(nanotubes, NTs)를 지지체로 한 방법과 절차를 소개하고자 한다.
첫 번째 방법은 흡착법에 의한 고정화이다. Tri-HCl 버퍼용액(pH 7.5 at 4℃, Trizma base, minimum 99.9% titration and 2M HCl, Sigma)에 엔자임을 넣고 제조한 전극을 12시간 동안 담근다(방법1, Pfu-adsorbed TiO2 NTs). 이때, dithiothretiol (DTT)와 MgCl2가 엔자임 흡착 전 안정제로서 소량 투입된다. 물리적 흡착의 가장 큰 단점은 비영구적 결합(non-permanent binding)으로 인해 지지체에서 반응 매질로 효소가 침출되어 엔자임이 크게 손실된다는 점이다10). 이를 방지하기 위해 순환 전압전류법(cyclic voltammetry)을 이용하여 2 mM pyrrole monomer (purity >98%)를 0-0.8 V로 20분 동안 전기중합(electropoly-merization)한다. 전기중합을 통해 합성된 polypyrrole은 높은 전도성, 무색, 간편한 합성법, 높은 안정성 등의 특징을 가지고 있기 때문에 반응에 영향을 끼치지 않으면서 엔자임의 손실을 방지할 수 있다.
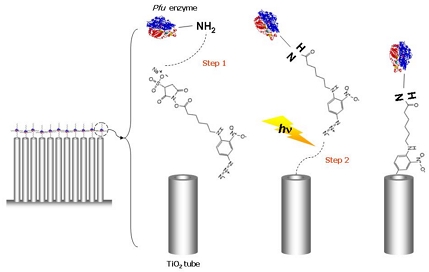
두 번째 방법은 지지체와 수소화효소를 화학적으로 결합시키는 방법으로서 그 매체로 crosslinker가 사용된다는 점이 방법 1과 가장 큰 차이점이다. Yoon 등11)은 crosslinker 중 광활성이 있는 Aryl azide cross linking 시약(sulfo-SANPAH, MW 492.40, PIERCE Biotechnology, Waltham, MA, USA)으로 효소를 고정화하였다. Fig. 3은 crosslinker가 효소 및 지지체와 결합하는 반응을 보여준다. 광활성이 있는 물질이기 때문에 암실에서 진행되며, crosslinker의 끝단에 위치하는 N-hydroxysuccinimide (NHS) ester와 효소가 반응하고(step 1, Fig. 3), nitrophenyl azide가 지지체와 반응하여 amide bond를 형성한다(step 2, Fig. 3). 미반응 crosslinker를 제거하기 위해 암실에서 투석한 뒤, 309 nm cut-on filter가 장착된 광원(300 W solar simulator, Oriel Instrument, Irvine, CA, USA)을 이용하여 조사하면 효소와 지지체에 이중결합이 포함된 nitrene group이 형성된다(step 3, Fig. 3). 이후에는 첫 번째 고정화 방법과 동일하게 전기중합반응을 진행한다.
3. 수소화효소 엔자임 분석
3.1 형광 현미경 분석
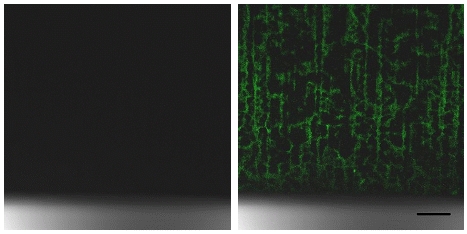
형광 현미경(confocal laser scanning microscopy)은 엔자임에 형광물질을 염색시켜 고정화 상태를 파악할 수 있는 정성분석법이다. 이때, 엔자임의 형광염색은 NHS (491 nm 여기, 518 nm 방출)-fluorescein방법을 이용하며 자외선에 의한 손상을 방지하기 위하여 fluorescein 라벨링은 암실에서 진행된다. Fig. 4는 고정화 방법 1을 이용한 엔자임 고정화 전후의 TiO2 NTs 형광현미경 사진이다12). Fig. 4 (오른쪽)의 경우, 수직으로 배열된 TiO2 NTs 표면에 형광염색된 엔자임이 푸른색을 띄고 있다. 반면 엔자임을 고정시키기 전(왼쪽)에는 염색된 엔자임이 없으므로 검은색으로 나타난다.
3.2 주사탐침현미경 분석
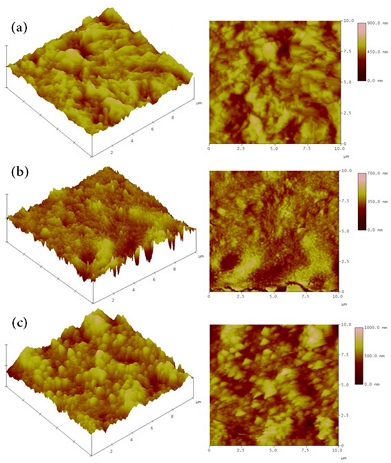
주사탐침현미경(atomic force microscope, AFM)은 시료의 표면 지형도를 측정하는 분석기법으로 엔자임 고정화 여부와 고정화 전후의 시료 표면 형태의 변화를 알 수 있다. Fig. 5는 고정화 전(Fig. 5[a]), 흡착법에 의한 고정화(Fig. 5[b]), crosslinker에 의한 고정화(Fig. 5[c])에 따른 AFM 결과이다13). Fig. 5(a)와 Fig. 5(b), (c)를 비교하였을 때 엔자임 고정화 전 시료의 경우 응집물질이 발견되지 않았다. 이를 통해 엔자임 고정화 유무에 따라 응집물질(agglomerate) 생성 유무가 결정되는 것을 확인할 수 있다. 또한 고정화 방법에 따라 표면의 거친 정도의 차이가 발견되었다. Fig. 5(c)의 경우, 더 거친 지형도의 표면을 나타낸다. 이는 crosslinker를 사용하는 고정화방법이 좀 더 효과적인 엔자임 고정방법임을 알 수 있다.
3.3 엔자임 농도 분석
엔자임을 지지체에 고정화한 경우, 실질적으로 전극에 고정된 엔자임의 양을 측정한 논문은 현재까지 없다. 이를 측정할 수 있는 방법으로 Modified Lowry Protein Assay Kit (Thermo Scientific, Waltham, MA, USA; Number 23240)을 활용한 분석법을 소개하고자 한다. 2절에 언급한 일련의 방법으로 엔자임을 지지체에 고정시킨 후 전해질의 잔류 엔자임을 측정하여 전극에 고정된 엔자임의 양을 간접적으로 추정하는 방법이다. 형광현미경분석과 AFM 분석으로 정성분석을 했다면 본 방법으로 정량적 확인이 가능할 것으로 보인다. 본 Kit를 활용한 분석의 경우, 엔자임이 알카리 용액 속 황산 제2구리(cupric sulfate) 및 구리 착물(chelated copper complexes)에 비례하여 환원됨으로서 750 nm에서 청색(blue color)을 측정할 수 있다. 엔자임의 종류와 버퍼용액에 따라 반응 곡선이 다르게 생성되기 때문에 일반적으로 제공하는 소혈청알부민(bovine serum albumin)을 기준으로 하여 적용하고자 하는 엔자임의 표준곡선을 비교한 검량선을 작성하는 것이 필요할 것으로 보인다.
3.4 전기화학 분석
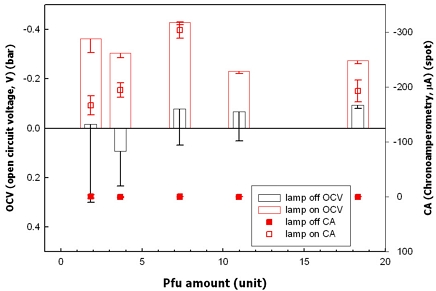
광전기화학에서 개방회로전위(open circuit voltage, OCV)는 전류가 0일 때, 광전극과 상대전극사이의 전위차를 의미한다. 위의 정의에 따라, 설정한 광전기화학 셀(photoelectrochemical cell)에서 |OCVlight−OCVdark|로 구할 수 있다. OCV를 측정함으로서 조사(irradiation)유무에 따른 광전류(photocurrent)를 나타낸다. 동일 시스템에서 광생성된 전자의 이동과 정공에 의한 산화는 고유한 특성이기 때문에 OCV와 chronoamperometry (CA)는 동일한 경향을 따른다. 실험적으로 엔자임 최적량은 인가하는 바이어스(bias)의 종류에 따라 달라질 수 있지만 광전기화학적 특성은 수소생산량과 상당한 유사 상관관계가 있음을 알 수 있다 (Fig. 6)5). 태양전지의 경우, 이온 수송의 향상과 전기 장벽의 감소로 인해 potentiostat를 사용할 때와 비교하여 더 적은 양의 효소가 요구될 수 있다.
4. 변수별 수소발생반응
Fig. 7은 수소발생실험에서 전해질에 엔자임을 slurry 형태로 반응한 결과와 물리적 흡착에 의한 엔자임 고정 및 crosslinker를 이용한 화학적 결합에 의한 엔자임 고정전극을 활용한 결과를 비교한다13).
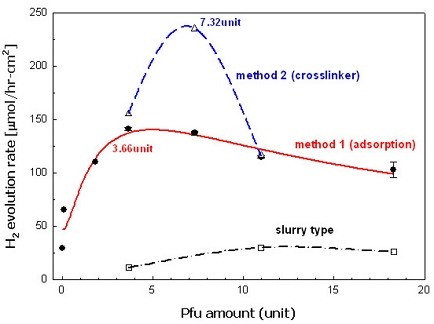
Effect of immobilization method of enzyme on hydrogen evolution rate (external bias of 1.5 V from solar cell, ca. 74±3.4 mWcm-2, ATTE at 20 V for 45 min in 0.5% HF at 5℃ and annealed at 650℃ for 5 h)13)
Slurry 시스템보다 전극에 엔자임을 고정시킨 시스템이 엔자임과 캐소드 사이의 효율적인 접촉에 의해 수소생산량이 높았다. 같은 관점에서 동일 엔자임 양에서 물리적 흡착보다 화학적 결합이 이루어졌을 때 효율이 높아지는 것을 알 수 있다. 시스템에서 최적의 엔자임 양이 존재하는 것은 양성자의 환원과 수소의 산화에 기여하는 엔자임의 이중역할 때문이며 과도한 Pfu는 수소를 양성자로 만드는 산화효소(oxidase)로서 작용할 수 있음을 나타낸다.
전해질은 전자의 이동과 전극계면과의 상호작용, 전기전도도 등 광전기화학 셀에서 효율에 큰 영향을 미치는 구성 중 하나이다. Fig. 8은 동일 조건에서 시간에 따른 전해질 농도별 수소발생량을 나타낸다5).
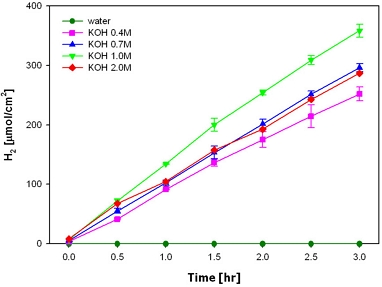
Time-coursed profile of hydrogen evolution with different concentrations of KOH as electrolyte (external bias of 1.5 V from solar cell, ca. 74±3.4 mWcm−2, Pfu (10.98 units) immobilized on ATTE)5)
KOH 농도별 수소발생속도는 1 M>0.7 M≥2 M>0.4 M이다. 광전기화학 셀을 구성함에 있어서 최적의 전해질 농도는 존재한다. 특정 임계값을 초과할 때까지 OH-이온의 농도가 증가함에 따라 전기전도도가 증가하여 수소생산율도 증가하지만 그 이상에서는 OH-이온이 생성된 양성자의 확산을 방지하고 광자에너지를 흡수하는 H2O2를 생성할 수 있기 때문에 효율이 감소한다.
광전기화학시스템에서 외부 전압은 광생성된 전자/정공의 재결합을 방지하여 활성화된 전자 또는 정공의 유지시간을 증가시켜 전체 광전기화학시스템의 효율에 영향을 미치는 것으로 알려져 있다. Fig. 9는 3.66 unit의 Pfu를 고정시킨 캐소드를 이용한 외부전압별(0.5-2.0 V) 수소생산율을 나타낸다12). 2.0 V 외부 바이어스를 인가한 전기분해 실험(electrolysis) 또는 외부 바이어스 없이 빛에 의해서만 진행한 실험(photocatalysis)의 경우 수소가 거의 생성되지 않았다. 또한 2.0 V 이상의 외부 바이어스가 인가되었을 때, 빛 조사에 의한 어노드의 에너지 준위의 상향 이동에 따른 밴드밴딩(band bending)과 함께 수소생산에 충분한 에너지가 인가되는 것을 알 수 있다. 수소발생 포텐셜과 외부 저항을 고려하여 반응이 진행되기 위한 최소 바이어스를 찾아야 한다. 또한, 셀에 요구되는 에너지를 최소로 줄이는 연구가 필요하다.
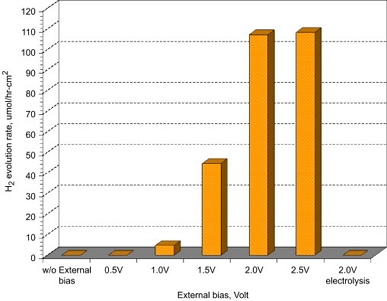
Effect of external bias on hydrogen evolution rate (external bias of 1.5 V from solar cell, ca. 74±3.4 mWcm-2, Pfu (3.66 units) immobilized on ATTE)12)
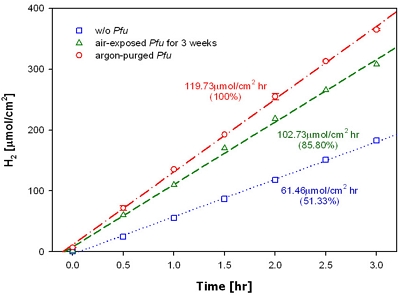
수소화효소는 수소분자(H2)를 가역적산화하는 효소이다. 일반적으로 (FeFe)-수소화효소와 (NiFe)-수소화효소는 산소분자(O2)에 의해서 비활성화되는 것으로 알려져 있다. 이러한 이유로 Pfu에서 추출한 (NiFe)-수소화효소를 활용할 경우, 비활성가스로 퍼징(pursing)하여 산소와의 접촉을 최소화하면서 효율을 극대화할 수 있다. Fig. 10은 이에 대한 실험으로서, 시간에 따른 각 조건별 수소발생량을 나타낸다5). 엔자임이 없는 상태의 수소발생률(파랑색)은 61.46 µmol cm-2hr-2이며, 엔자임이 없는 상태에서도 외부 바이어스와 광반응에 의해 물분해 수소생성이 가능함을 보여준다. 하지만 엔자임이 존재하는 시스템과 비교했을 때 효율은 약 50%에 그쳤으며, 이는 광전기화학 시스템에서 효소의 역할을 직접적으로 나타내는 것이다. 반응실험 전, 호기성상태에 노출시킨 엔자임을 이용한 실험(초록색)의 경우, 수소발생속도가 85.8%로 감소하였다, 수소화효소는 large subunit (NiFe, ca. 60 kDa)과 small subunit (Fe-S, ca. 30 kDa)을 포함한다. 이러한 클러스터(cluster)는 전자릴레이(electron relay)의 활성 부위(active site)로 작용한다.
이 외에도 전극을 비롯하여 시스템의 안정성과 내구성을 확인하는 것은 실용화 측면에서 매우 중요하다. 내구성을 확인하는 방법으로서 반복 실험을 통한 수소생산량 효율 비교, 정전압 장기실험을 통한 비활성화테스트 등을 활용할 수 있다.
5. 결 론
본고에서는 광전기화학적 물분해 수소제조 시스템에서의 (NiFe)-수소화효소(Pfu에서 추출)의 활용, 취급 및 고정화 방법, 물리화학적 분석 방법, 전기화학적 분석법, 공정 변수 등에 대해 소개하였다. 광전기화학적 물분해 수소제조반응은 광촉매의 광감응성 및 결정성 등 외에도 빛과 외부전압 유무에 따른 밴드갭에너지 변화와 전자의 이동 용이성 등 물리적 특성에 크게 영향을 받는다. 또한 용질과 용매와의 상호작용 등 화학적 영향에도 관심을 많이 가져야 하는 복잡성을 갖는다. 이 두 가지 변수 영역은 별개가 아닌 복합적으로 동시에 고려되어야 한다. 현재 사용하고 있는 엔자임 Pfu는 산소에 매우 민감하여 노출 시 활성이 감소된다. 이를 대체하고자 내산소성이 확보되고 상온 등 적정 온도에서 활성화가 최적화된 엔자임 선별 등을 계획하고 있다. Crosslinker의 경우 고정화를 위해 보유할 양 끝 작용기들이 선정된 상황에서 총 물질 길이 등이 고려되어야 할 변수가 된다. 추후 엔자임 종류(수소화효소), 전해질, pH, crosslinker, 온도, 지지체 등 다양한 변수들의 최적화에 대한 연구뿐만 아니라 셀 최적화에 대한 연구도 함께 이루어져야 할 것이다.
Acknowledgments
본 연구는 국토교통부/국토교통과학기술진흥원의 지원을 받아 수행되었으며 이에 감사드립니다(부처과제번호 22OHTI-C162271-02).
References
- IEA, “International energy outlook 2021”, IEA, 2021. Retrieved from https://www.eia.gov/outlooks/ieo, .
- IEA, “The future of hydrogen”, IEA, 2018. Retrieved from https://www.iea.org/reports/the-future-of-hydrogen, .
- United States Department of Energy, “Hydrogen strategy enabling a low-carbon economy”, United States Department of Energy, 2020. Retrieved from https://www.energy.gov/fecm/downloads/hydrogen-strategy-enabling-low-carbon-economy, .
-
S. Hwang and J. Park, “Techno-economic analysis of water electrolysis system connected with photovoltaic power generation”, Trans Korean Hydrogen New Energy Soc, Vol. 32, No. 6, 2021, pp. 477-482.
[https://doi.org/10.7316/KHNES.2021.32.6.477]

-
S. Bae, E. Shim, J. Yoon, and H. Joo, “Photoanodic and cathodic role of anodized tubular titania in light-sensitized enzymatic hydrogen production”, J. Power Sources, Vol. 185, No. 1, 2008, pp. 439-444.
[https://doi.org/10.1016/j.jpowsour.2008.06.094]

-
P. Zhang, J. Lee, and H. Lee, “Preparation and characterization of Pt-Ni nanocatalyst for anion exchange membrane in alkaline electrolysis by spontaneous reduction reaction”, Trans Korean Hydrogen New Energy Soc, Vol. 33, No. 3, 2022, pp. 202-208.
[https://doi.org/10.7316/KHNES.2022.33.3.202]

-
W. Nam, S. Oh, H. Joo, and J. Yoon, “Preparation of Pt deposited nanotubular TiO2 as cathodes for enhanced photoelectrochemical hydrogen production using seawater electrolytes”, J. Solid State Chem, No. 184, No. 11, 2011, pp. 2920-2924.
[https://doi.org/10.1016/j.jssc.2011.08.041]

-
E. Shim, Y. Park, S. Bae, J. Yoon, and H. Joo, “Photocurrent by anodized TiO2 photoelectrode for enzymatic hydrogen production and chromium(VI) reduction”, Int. J. Hydrogen Energy, Vol. 33, No. 3, 2008, pp. 5193-5198.
[https://doi.org/10.1016/J.IJHYDENE.2008.05.011]

-
J. Yoon and H. Joo, “Photobiocatalytic hydrogen production in a photoelectrochemical cell”, Korean J. Chem. Eng., Vol. 24, 2007, pp. 742-748.
[https://doi.org/10.1007/S11814-007-0036-4]

-
M. G. Nussbaumer, P. Q. Nguyen, P. K. R. Tay, A. Naydich, E. Hysi, Z. Botyanszki, and N. S. Joshi, “Bootstrapped biocatalysis: biofilm-derived materials as reversibly functionalizable multienzyme surfaces”, ChemCatChem, Vol. 9, No. 23, 2017, pp. 4328-4333.
[https://doi.org/10.1002/CCTC.201701221]

- J. K. Yoon, M. S. Park, A. Y. Her, E. J. Shim, and H. K. Joo, “Hydrogen production from anodized tubular TiO2 electrode and immobilized cross-linked P. furiosus”, New. Renew. Energy, 2009, pp. 749-752. Retrieved from https://koreascience.kr/article/CFKO200935161994168.page, .
-
H. Joo, S. Bae, C. Kim, S. Kim, and J. Yoon, “Hydrogen evolution in enzymatic photoelectrochemical cell using modified seawater electrolytes produced by membrane desalination process”, Sol. Energy Mater. Sol. Cells, Vol. 93, No. 9, 2009, pp. 1555-1561.
[https://doi.org/10.1016/J.SOLMAT.2009.04.008]

-
J. Yoon, S. Bae, E. Shim, and H. Joo, “Pyrococcus furiosus-immobilized anodized tubular titania cathode in a hydrogen production system”, J. Power Sources, Vol. 189, No. 2, 2009, pp. 1296-1301.
[https://doi.org/10.1016/J.JPOWSOUR.2008.12.072]