증기 메탄 개질 반응의 Ru 촉매 Kinetic Parameter 예측
2022 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
This study proposes kinetic parameters of Ru catalyst for steam methane reforming (SMR). First, extensive experiments are performed under different SMR conditions to evaluate performance of the catalyst in SMR. Second, a kinetic model is designed and developed for parameter estimation and validation using gPROMS. Finally, estimated parameters are fitted to the kinetic model and then, the model results are compared with the experimental data. The model results are in a good agreement with the experimental data.
Keywords:
Hydrogen production, Steam methane reforming, Ru catalyst, Parameter estimation, gPROMS, Kinetic study키워드:
수소 생산, 증기 메탄 개질, 루테늄 촉매, 파라미터 예측, 지프롬스, 키네틱 스터디1. 서 론
최근 석유 및 석탄 등의 화석 연료 사용으로 여러 환경오염 문제들이 많이 발생하고 있다. 이러한 문제들로 인해 화석 연료를 대체할 새로운 에너지 매체에 대한 관심이 증가하고 있으며, 특히 수소는 친환경적이고 수송과 저장이 용이한 장점이 있어 주요 에너지 매체로 각광받고 있다.
수소를 생산하는 방법에는 전기 분해, 가스화, 개질 등 여러 방법이 존재한다. 그중 개질방법은 전체 수소 생산의 약 48%를 차지하는 주요 수소 생산 방법이다1). 화학반응을 통해 탄화수소를 수소로 바꾸는 개질방법에는 크게 수증기개질(steam methane reforming, SMR), 부분산화개질(partial oxidation reforming), 자열개질(autothermal reforming) 3가지가 있지만 천연 가스를 이용한 SMR은 개질효율이 높아 수소 생산에 가장 많이 사용된다2,3).
SMR 공정은 여러 장치들로 구성된다. 그중 개질반응이 직접적으로 일어나는 SMR 반응기는 운전 조건에 따라 생산되는 수소 수율과 개질효율에 영향을 준다. 따라서 안정적인 수소 수율과 높은 개질효율을 위해 SMR 반응기의 운전조건을 최적화 하는 연구들이 진행되어 왔다4). 그러나 최적의 운전조건은 반응기에 사용되는 촉매의 kinetic parameter에 따라 달라진다. 또한 여러 종류의 촉매는 각각 다른 kinetic parameter 값을 가지므로, SMR 반응기 운전 조건을 최적화하기 위해서는 사용 촉매에 대한 kinetic parameter 값이 필요하다. 이와 관련하여 여러 연구로부터 SMR의 세 가지 주요 반응에 대한 다양한 kinetic parameter 값이 보고되었다. 주요 반응은 다음과 같다.
- R1 : CH4+H2O↔CO+3H2 ΔH0298K= +206 KJ/mol
- R2 : CO+H2O↔CO2+H2 ΔH0298K= +165 KJ/mol
- R3 : CH4+2H2O↔CO2+4H2 ΔH0298K= -41 KJ/mol
Xu와 Froment5)는 반응기에 대한 디자인과 시뮬레이션을 위해 Ni/MgAl2O4 촉매의 intrinsic kinetics를 제시하였다. Hoang 등6)은 상업용 sulfide Ni 촉매의 kinetics를 제시하였으며, Oliveira 등7)은 Ni/Al2O3 촉매의 kinetics를 제시하였다.
대부분의 촉매 관련 연구에서는 대규모 수소플랜트에서 사용하는 Ni 기반 촉매의 kinetic parameter를 제시하였으며, 다른 촉매의 kinetic parameter 연구는 미비하였다. 분산형(on-site) 수소충전소(hydrogen refueling station) 등의 소규모 수소플랜트는 규모가 작기 때문에 가격이 비싸지만 촉매 활성도, 안정성, 그리고 다른 feedstock 사용으로 인한 carbon formation 예방 기능이 Ni보다 우수한 Ru 기반 촉매를 사용한다8). 따라서 소규모 수소플랜트의 모델 개발 및 운전조건 최적화를 위해서는 Ru 촉매의 kinetic parameter 값이 필요하다.
본 연구는 소규모 수소플랜트의 simulation 모델 개발과 운전조건 최적화를 위해 Ru 촉매의 kinetic parameter를 제시하였다. 먼저 다양한 SMR 운전 조건에서 Ru 촉매에 의한 개질 성능을 측정하였다. 이후 gPROMS를 이용한 SMR 반응기 모델 개발을 통해 소규모 수소플랜트에서 사용되는 Ru 촉매의 kinetic parameter를 제시하고, SMR 반응기 모델 결과와 실험 데이터를 비교함으로써 kinetic parameter를 검증하였다.
2. 실 험
2.1 실험 장치 구성
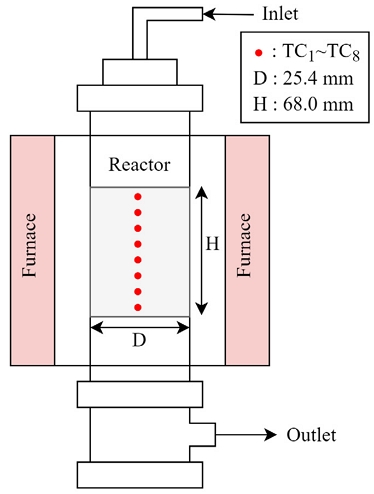
Fig. 1은 Ru 촉매를 이용한 SMR 반응기의 개략도이다. 반응기의 직경은 25.4 mm, 높이는 68.0 mm이며, 반응기 내부에는 8 mm 간격으로 온도를 측정하는 8개의 온도계가 설치되어 있다. 반응기 외부에는 SMR 반응을 위한 전기 furnace가 설치되어 있으며, Ru 촉매는 약 100 μm 지름의 파우더 형태로 사용되었다. 대표적인 SMR 운전 조건인 반응 온도, gas hourly specific volume (GHSV), 그리고 steam to carbon ratio (SCR)를 각각 780-880, 1,500-3,500, 그리고 2.0-4.0으로 바꾸어가며 반응기에서 나오는 개질 가스 조성을 측정하였다. 자세한 조건들은 Table 1에 나타내었다.
2.2 SMR 반응기 모델링
Ru의 kinetic parameter를 예측하기 위해 gPROMS프로그램을 이용하여 실험에 사용된 SMR 반응기를 모사하는 simulation 모델을 개발하였다. gPROMS의 fixed-bed catalytic reactor (FBCR) 모델을 이용하였으며, 정상상태를 가정하고 2D FBCR과 1D catalyst pellet model이 사용되었다.
각 성분에 대한 연속 방정식은 대류 및 확산에 의한 촉매와 유체 사이의 물질 전달과 축방향 및 반경방향 물질 대류를 설명한다. 식 (1)은 촉매 층에 의한 압력강하를 Ergun correlation9)을 이용하여 설명한 식이다. 이때 P는 압력, z는 수직 방향의 거리, ε은 공극률, μ는 유체의 점도, ρ는 유체의 밀도, d와 u는 각각 지름과 유속을 의미한다. 또한, 반응기 내에서의 질량 균형 방정식은 유체의 축방향 및 반경 방향 물질 전달을 모두 설명할 수 있으며, 식 (2)와 같이 표현된다. 식 (3)은 유체의 에너지 수지를 설명한다. Axial 및 radial 이류, radial 확산과 대류에 의한 열전달이 고려되었다. 여기서 M은 질량 선속, r은 수평 방향의 거리, N은 몰 선속, x는 몰 분율, av는 부피 대비 면적 비율, H는 엔탈피 선속을 의미한다.
| (1) |
| (2) |
| (3) |
Catalyst pellet 내부에 대한 물질 수지 계산식은 대류와 확산에 의한 물질 전달 요소를 포함하고 있다. 뿐만 아니라, SMR 반응과 관련있는 요소들도 포함한다. 에너지 수지 계산식은 이류, 분산, 확산, 그리고 SMR 반응에 의해 생성된 열 에너지를 고려한다. Catalyst pellet 내의 물질 및 에너지 수지는 식 (4)와 (5)를 통해 계산하였다. 이때 ΔH는 생성 엔탈피를 의미한다.
| (4) |
| (5) |
식 (6)과 (7)은 catalyst pellet의 표면, 반응기 층 중심선, 그리고 반응기 벽에 대한 경계 조건을 설명한다. 질량 및 열 확산은 catalyst pellet 표면에서 계산되고, 유체와 입자 사이의 계면 질량 및 열전달 저항은 Gineliski10)의 질량 및 열전달 계수를 기반으로 계산된다. 식 (8)은 벽에서의 확산 열 유동을 나타냈으며, radial 열 전도율이 고려되었다. 각 식에서 C는 몰 농도, k는 물질 전달 계수, h는 열 전달 계수, α는 벽에서의 열 전달 계수를 의미한다.
| (6) |
| (7) |
| (8) |
Ru의 kinetic parameter를 예측하기 위해 식 (9)-(12)이 SMR 반응기 모델에 적용되었다11). 식 (9)-(11)은 Langmuir-Hinshelwood 모델을 이용하여 SMR의 대표 3개 반응을 표현하였다. 이때 k는 반응상수, Keq는 평형상수, p는 부분압력을 의미한다. 본 연구에서 제안한 6개 parameter는 gPROMS의 parameter fitting을 이용하여 예측되었다. Parameter fitting에 사용된 MXLKHD solver는 모수적인 데이터 밀도 추정 방법 중 하나로, 여러 parameter로 구성된 확률밀도 함수에서 관측된 표본 데이터 집합을 이용하여 parameter를 추정하는 방법이다. MXLKHD solver의 목적함수는 식 (13)과 같다12). 여기서 N은 총 측정 횟수 NM은 측정 데이터 개수, NV는 실험에서 측정된 변수 개수, NE는 실험 횟수, σ2은 분산, Z는 예측값, 는 측정값을 의미한다.
| (9) |
| (10) |
| (11) |
| (12) |
| (13) |
3. 결과 및 고찰
3.1 실험 결과
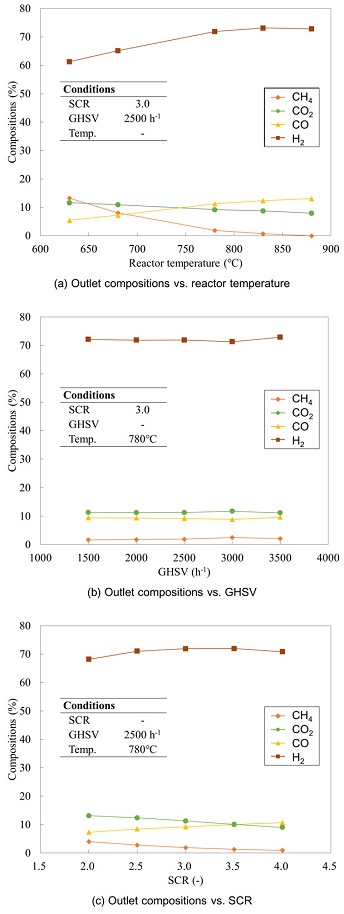
Fig. 2(a)는 반응기 온도에 따른 생성 가스의 조성 변화를 보여준다. 이 경우 GHSV는 2,500 h-1, SCR은 3, 압력은 8 barg으로 유지하였다. 반응기의 온도가 830℃까지 증가함에 따라 수소 비율은 점차 증가하고, 메탄 함량은 점차 감소하였다. 약 830℃ 이상에서는 반응기 온도가 더 증가해도 수소농도는 변화하지 않았다. 따라서 830℃보다 높은 온도에서 SMR 반응을 진행할 경우, 반응기 승온에 투입되는 에너지 대비 수소 수율이 낮아질 수 있다.
Fig. 2(b)는 일정한 SCR, 반응기 온도, 압력에서 GHSV에 대한 생성 가스의 조성을 보여준다. 일반적으로 GHSV 2,000-4,000 h-1 범위에서 SMR 반응이 잘 일어난다고 알려져 있다13). 그러나 Ru 촉매는 다른 촉매에 비해 더 좋은 반응성을 갖고 있어 높은 feed rate에서도 SMR 반응이 잘 일어난다14). 따라서 Fig. 2(b)에서 GHSV 변화에 따른 생성 가스 조성 변화는 거의 없었다. Fig. 2(c)는 SMR 반응에 대한 SCR의 영향을 보여준다. SCR이 증가함에 따라 조성의 메탄 함량이 감소하였다. 이는 SCR이 커질수록 많은 양의 메탄이 반응됨을 의미한다. 하지만 SCR이 증가함에 따라 이산화탄소 함량은 감소하고, 일산화탄소 함량은 증가하였다. 이를 통해 SMR의 반응 중 R1 반응이 더 지배적임을 알 수 있다.
3.2 모델 검증
실험 결과를 바탕으로 식 (14)와 (15)의 Ru 촉매 Ej, k0,j (j=1, 2, 3) 총 6개 kinetic parameter를 예측하였으며, 예측 결과는 Table 2와 같다. E1, E2, 그리고 E3은 각각 196.8, 10.0, 그리고 237.2 kJ/mol로, k0,1, k0,2, 그리고 k0,3은 각각 1.26×1013 mol/bar0.5 g s, 6.01×10-1 mol/bar g s, 그리고 1.54×1012 mol/bar0.5 g s로 예측되었다. 다른 Ni 기반 촉매에 대한 kinetic parameter와 비교한 결과, 약간의 차이를 보였다.
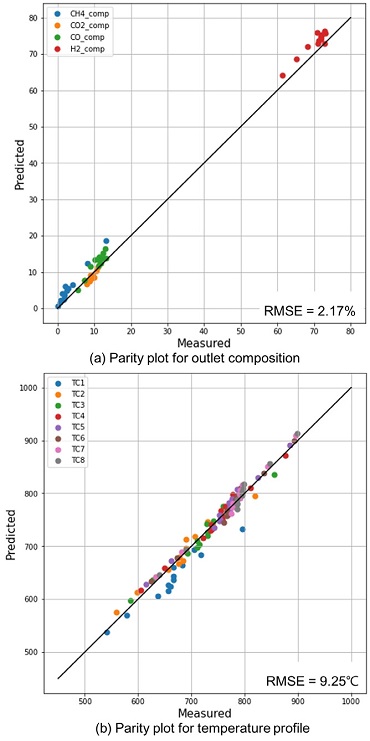
이후, 제안된 6개 kinetic parameter를 이용하여 gPROMS 기반의 kinetic 모델을 개발하였다. 개발된 모델은 개질 가스 조성과 반응기 내부 온도를 계산하는 데 사용되었고, 계산된 값은 실험값과 비교하였다. 비교 결과는 Fig. 3에 parity plot과 root mean squared error (RMSE)로 나타내었으며, RMSE는 식 (16)으로 계산된다.
| (14) |
| (15) |
| (16) |
Fig. 3(a)는 개질 가스 조성에 대한 실험값과 simulation 모델로 예측한 값의 비교 결과를 보여준다. 그림에서 파란색, 주황색, 초록색, 그리고 붉은색 점은 각각 메탄, 이산화탄소, 일산화탄소, 그리고 수소 조성을 의미한다. 일산화탄소와 수소 조성은 실제값보다 예측값이 크게 계산되었는데, 이는 SMR의 주요 반응 중 이산화탄소와 수소를 생산하는 R3 반응이 simulation 내에서 더 우세하였음을 의미한다. 또한, 메탄 비율은 예측값이 실제값보다 크게 계산이 되었고, 이산화탄소 비율은 예측값이 실제값보다 작게 계산되었다. 이러한 결과는 일산화탄소와 수소를 생산하는 R2 반응이 simulation에서는 실험보다 적게 일어났음을 의미한다. 위와 같은 이유로 RMSE는 약 2.17%로 계산되어 실제값과 예측값 사이에 작은 오차를 보였으나, 개발된 모델은 개질 가스의 주요 성분들 모두에 대해 상당히 높은 정확도로 예측하였다.
한편, Fig. 3(b)는 실험에 사용한 SMR 반응기 내부 온도에 대한 예측 결과를 보여준다. 온도에 대한 RMSE 값은 약 9.25℃로 실제값과 예측값의 오차가 낮음을 확인하였다. 따라서 본 연구에서 제안한 SMR에 Ru 촉매의 kinetic parameters를 이용하면 Ru 기반의 소규모 수소플랜트에 대해 현실적인 모델링 및 운전조건 최적화가 가능하다.
4. 결 론
본 연구는 소규모 수소플랜트의 simulation 모델 개발과 운전조건 최적화를 위하여 Ru의 kinetic parameter를 제시하였다. 실험을 통해 13개의 반응 조건에 따른 실험 데이터를 측정하고, gPROMS를 이용하여 parameter estimation과 반응기 모델 개발을 진행하였다. 연구 결과는 다음과 같다.
1) Parameter estimation 결과, E1, E2, 그리고 E3은 각각 196.8, 10.0, 그리고 237.2 kJ/mol로, k0,1, k0,2, 그리고 k0,3은 각각 1.26×1013 mol/bar0.5 g s, 6.01×10-1 mol/bar g s, 그리고 1.54×1012 mol/bar0.5 g s로 계산되었다.
2) 제시된 파라미터를 이용하여 반응기 모델을 개발한 결과, 개발된 모델은 높은 정확도로 개질 가스 조성과 반응기 내부온도를 예측하였다.
Acknowledgments
이 연구는 대한민국 정부 산업통상자원부 및 방위사업청 재원으로 민군협력진흥원에서 수행하는 민군기술협력사업의 연구비(UM19313RD3) 지원으로 수행되었다.
References
-
M. Voldsund, K. Jordal, and R. Anantharaman, “Hydrogen production with CO2 capture”, Int. J. Hydrogen Energy, Vol. 41, No. 9, 2016, pp. 4969-4992.
[https://doi.org/10.1016/j.ijhydene.2016.01.009]

-
Y. S. Kim, K. H. Lee, D. K. Lee, Y. D. Lee, and K. Y. Ahn, “Mid-temperature operation characteristics of commercial reforming catalysts: comparison of ru-based and ni-based catalyst”, Trans Korean Hydrogen New Energy Soc, Vol. 32, No. 3, 2022, pp. 149-155.
[https://doi.org/10.7316/KHNES.2021.32.3.149]

-
B. J. Kim, W. L. Yoon, and D. J. Seo “Analysis of the economy of scale for domestic steam methane reforming hydrogen refueling stations utilizing the scale factor”, Trans Korean Hydrogen New Energy Soc, Vol. 30, No. 3, 2019, pp. 251-259.
[https://doi.org/10.7316/KHNES.2019.30.3.251]

-
S. Hong, J. Lee, H. Cho, M. Kim, I. Moon, and J. Kim, “Multi-objective optimization of CO2 emission and thermal efficiency for on-site steam methane reforming hydrogen production process using machine learning”, J. Cleaner Production, Vol. 359, 2022, pp. 132133.
[https://doi.org/10.1016/j.jclepro.2022.132133]

-
J. Xu and G. F. Froment, “Methane steam reforming, methanation and water-gas shift: I. Intrinsic kinetics”, AIChE J., Vol. 35, No. 1, 1989, pp. 88-96.
[https://doi.org/10.1002/aic.690350109]

-
D. L. Hoang, S. H. Chan, and O. L. Ding, “Kinetic and modelling study of methane steam reforming over sulfide nickel catalyst on a gamma alumina support”, Chem. Eng. J., Vol. 122, No. 1-3, 2005, pp. 1-11.
[https://doi.org/10.1016/j.cej.2005.06.004]

-
E. L. G. Oliveria, C. A. Grande, and A. E. Rodrigues, “Steam methane reforming in a Ni/Al2O3 catalyst: kinetics and diffusional limitations in extrudates”, Can. J. Chem. Eng., Vol. 87, No. 6, 2009, pp. 945-956.
[https://doi.org/10.1002/CJCE.20223]

-
J. W. Lee, H. T. Cho, M. J. Kim, S. Hall, and I. Moon, “Double-tube reactor design and process optimization for on-site steam methane reforming processes”, Ind. Eng. Chem. Res., Vol. 59, No. 40, 2020, pp. 18028-18038.
[https://doi.org/10.1021/acs.iecr.0c02875]

- S. Ergun, “Fluid flow through packed columns”, Chemical Engineering Progress, Vol. 48, 1952, pp. 89-94.
- V. Gnielinski, “Calculation of heat-and mass transfer coefficient in the flow of gases through static packed beds”, Erfahrenstechnik (Mainz), Vol. 16, No. 1, 1982, pp. 36-39.
-
S. Lee, J. Bae, S. Lim, and J. Park, “Improved configuration of supported nickel catalysts in a steam reformer for effective hydrogen production from methane”, J. Power Sources, Vol. 180, No. 1, 2008, pp. 506-515.
[https://doi.org/10.1016/j.jpowsour.2008.01.081]

- Process Systems Enterprise Ltd., “gPROMS advanced user guide”, Process Systems Enterprise Ltd., London, 2011. Retrieved from http://www.psenterprise.com, .
-
J. H. Ryu, K. Y. Lee, H. La, H. J. Kim, J. I. Yang, and H. Jung, “Ni catalyst wash-coated on metal monolith with enhanced heat-transfer capability for steam reforming”, J. Power Sources, Vol. 171, No. 2, 2007, pp. 499-505.
[https://doi.org/10.1016/J.JPOWSOUR.2007.05.107]

-
F. Morales-Cano, L. F. Lundegaard, R. R. Tiruvalam, H. Falsig, and M. S. Skjøth-Rasmussen, “Improving the sintering resistance of Ni/Al2O3 steam-reforming catalysts by promotion with noble metals”, Appl. Catal. A Gen., Vol. 498, 2015, pp. 117-125.
[https://doi.org/10.1016/j.apcata.2015.03.016]