온도와 반응 시간에 따른 세라믹 튜브 내 메탄 열분해 반응의 메탄 전환율과 선택도 분석
2022 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
Interest in hydrogen productions that do not emit carbon dioxide and can produce hydrogen at a low price is increasing. Reforming and electrolysis are widely used, but they have limitations, such as carbon dioxide problems and costs. The methane can be decomposed as hydrogen and solid carbon without carbon dioxide emission at high temperatures. In this research, the methane pyrolysis experiment was conducted at 1,200℃ and 1,400℃ in a ceramic tube. The composition of the produced gas was measured by gas chromatography before carbon blocked the tube. The methane conversion rate and hydrogen selectivity were calculated based on the results. The hydrogen selectivity was derived as 60% and 55% at the highest point at 1,200℃ and 1,400℃, respectively. The produced solid carbon was expected to be carbon black and was analyzed using scanning electron microscope.
Keywords:
Methane pyrolysis, Decomposition, Hydrogen production, Solid carbon, Ceramic tube, Conversion rate키워드:
메탄 열분해, 분해, 수소 생산, 고체탄소, 세라믹 튜브, 전환율1. 서 론
급격한 기후변화에 대응하기 위해 이산화탄소의 배출 감소에 대한 요구가 전 세계적으로 확대되고 있으며, 화석 연료의 사용을 줄이고 이산화탄소의 배출이 적은 에너지원을 사용하려는 수요가 증가하고 있다. 풍력, 태양광 등 재생에너지 기반의 전력 시스템과 더불어 화석 연료를 대체하기 위한 차세대 에너지 캐리어의 관심이 커지고 있으며, 화석 연료를 대신할 에너지 캐리어로서 많은 수소가 언급되고 있다. 수소는 이산화탄소를 배출하지 않고, 물만 배출하기 때문에 이산화탄소 배출 저감에 효과적이다.
수소는 전기화학적 방식을 이용하는 연료전지의 연료로 사용되어 전력을 생산할 수도 있으며, 직접 연소를 통해 터빈을 돌려 전력을 생산할 수도 있다. 수소 연료전지를 이용한 기술은 상용화 단계에 이르렀으며, 차량ㆍ항공ㆍ선박 등 이미 다양한 분양에서 활용되고 있다. 수소 활용 기술이 상용화되는 시점에서 수소 경제 이행을 위해 가장 우선적으로 해결해야하는 문제는 수소 생산 기술이다.
현재 국내에서 공급되는 수소는 대부분 석유화학 공정에서 나오는 부생수소이다. 부생 수소는 생산되는 한정되어 있고, 이산화탄소를 배출한다는 점에서 장기적으로 활용이 어렵다. 이러한 대한으로 메탄과 수증기 개질을 통하여 수소를 추출하는 방법이 현재 현실적인 방안이나, 이 또한 이산화탄소를 배출하기 때문에 장기적인 측면에서 수소 생산 기술로는 고려할 수는 없다. 이산화탄소를 배출하지 않으면서 수소를 생산하는 방법으로 수전해 기술이 있다. 재생에너지를 이용하여 물을 전기분해하면 수소를 생산할 수 있으며, 이 경우에는 이산화탄소의 배출이 없다. 그러나 수전해 기반의 수소 생산기술은 수소의 생산 단가가 현재 매우 비싸 저가의 수소를 생산하는데 어려움이 있다.
수소 경제 실현을 위해 수소 생산 단가, 규모화, 이산화탄소 배출을 고려하여야한다. 부생 수소나 추출(개질) 수소는 생산 단가가 낮고, 화학 공정에 기반 하기 때문에 규모화가 유리하나 이산화탄소를 배출하는 단점이 있다. 이산화탄소를 포집하여 배출을 저감시킬 수 있으나, 이 경우 포집된 이산화탄소를 처리하여야하는 문제가 발생하기 때문에 수소 생산 단가를 상승시킬 수 있다. 수전해 수소는 이산화탄소를 배출하지는 않으나, 스택의 가격이 비싸고, 내구성 확보가 어려워 수소 생산 단가 확보에 한계가 있다. 현재 기술들은 수소 생산 단가, 규모화, 이산화탄소 배출 여부를 만족하지 못하고 있는 실정이다.
이러한 현재 기술의 단점을 보완할 기술로 메탄열분해를 통한 수소 생산 기술이 부각되고 있다. 메탄 열분해 기술은 메탄이 고온에서 고체 탄소와 수소로 분해되기 때문에 이산화탄소를 배출하지 않으며, 화학 공정에 기반 하기 때문에 규모화도 가능하다. 또한 반응에서 부산물로 얻어지는 고체 탄소를 판매할 경우, 수소 생산의 경제성을 확보할 수 있다. 따라서 메탄 열분해 기술을 통하여 이산화탄소를 배출하지 않으며 대용량으로 저가 수소 생산이 가능하다.
에너지 측면에서도 메탄 열분해 반응이 타 수소 생산 기술에 비하여 장점을 가진다. Table 1에 개질(추출), 수전해, 메탄 열분해 수소 생산 기술의 화학 반응식 및 필요 에너지량을 나타내었다. 개질(추출) 수소는 1 mol의 수소를 생산하기 위하여 63 kJ이 필요하며, 수전해 수소는 286 kJ이 필요하다. 이에 비하여 메탄 열분해 반응은 37 kJ만 필요함을 확인할 수 있다.
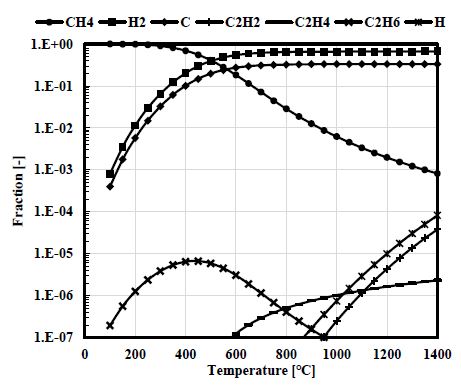
메탄 열분해 반응이 기존 기술들 대비 많은 장점을 가졌음에도 상용화가 되지 않은 가장 큰 이유는 높은 반응 온도와 고체 탄소의 처리 문제 때문이다. 평형 조건에서의 메탄 열분해 반응의 특성을 Fig. 1에 도시하였다. 메탄 열분해 반응은 1,000℃이하에서도 충분히 시작이 가능하나, 도시된 값은 평형 조건에서의 조성이며 반응 속도를 고려하면 촉매가 없는 반응은 약 1,200℃ 이상의 고온의 조건이 되어야 한다. 이러한 고온에서의 금속 재질의 반응기를 사용하는 것은 매우 어렵기 때문에 촉매를 이용하여 반응 온도를 낮추고 반응 속도를 향상시켜야 한다. 그러나 촉매를 이용하는 경우 메탄 열분해 반응에서 생성되는 고체 탄소가 촉매 표면에 침적되어 촉매의 활성도가 저해된다. 고온의 반응 온도와 촉매 탄소 침적 문제를 해결하기 위한 연구들이 수행되었다.
Ibrahim 등1)은 내벽에 Fe촉매를 가지는 알루미나 튜브 고정층 반응기를 이용하여 메탄 열분해 실험을 수행하였으며, 700℃의 온도에서 77.2%의 수소 생산 효율을 도출하였다.
Torres 등2)은 유동층 반응기를 이용하여 메탄 열분해 실험을 수행하였다. 촉매로는 Fe촉매를 이용하였으며, 700-900℃영역에서 실험을 수행하였으며, 촉매층 표면에서는 탄소나노튜브(carbon nano tube)가 증착됨을 확인하였고, 약 40%의 메탄 전환율을 확인하였다.
Geißler 등3)은 금속 액체를 이용하여 메탄 열분해 반응 실험을 수행하였다. 튜브 내부를 Sn으로 채우고 1273 K으로 가열하여 액체 금속 상태로 유지시킨다. 이러한 액체 금속 반응기에 하부에서 상부 방향으로 메탄을 공급하면 액체 금속 반응기 내부 에서 메탄이 기포 형태로 부력에 의하여 떠오르면서 반응이 지속된다. 액체 금속은 촉매로 작용하여 반응 속도를 극대화하고 가스 기포에 효율적으로 열을 공급한다. 메탄 열분해 반응으로 생성된 고체 탄소는 액체 금속 상부로 떠올라 상부에 축적된다. 실험을 통하여 30%의 수소 생산 수율을 확인하였다.
Upham 등4)은 메탄 열분해 반응에 활성화 특성을 가지는 촉매를 활성화 특성은 가지지 않지만 융점이 낮은 금속에 용해시키는 방법을 이용하여 안정적인 용융 금속 합금 촉매 조건에서의 메탄 열분해 반응을 실험적으로 수행하였다. 1,065℃에서 95% 메탄 전환율을 달성하였으며, X선 광전자 분광법을 통하여 생성된 탄소가 흑연임을 확인하였다.
Fincke 등5)은 플라즈마의 고온을 이용하여 메탄 열분해 반응 실험을 수행하였으며, 플라즈마를 이용한 메탄 열분해 반응의 메커니즘 및 반응에서 생성될 수 있는 부산물인 아세틸렌, 벤젠 등 탄화수소의 거동을 제시하였다. 실험을 통하여 30% 수율을 달성하였다.
본 연구에서는 세라믹 튜브를 이용하여 메탄 열분해 반응을 통한 수소 생산 실험을 수행하였으며, 반응 동안 가스 크로마토그래피(gas chromatography, GC)를 이용하여 가스 조성을 측정하였다. 반응이 지속되는 동안 메탄 전환율 및 수소 선택도의 경향성을 분석하였다. 또한, 부산물로 생성되는 탄소의 조성을 확인하기 위하여 주사전자현미경(scanning electron microscope, SEM) 분석과 성분분석을 수행하였다.
2. 실험 장치 구성 및 운전 조건
2.1 실험 장치 구성
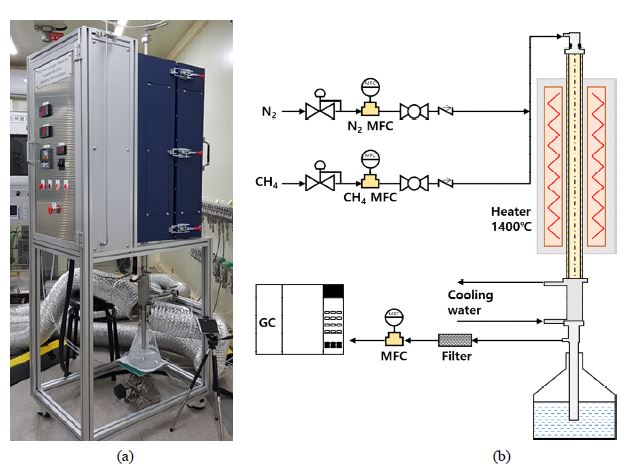
Fig. 2에 메탄 열분해 평가 장치의 사진을 나타내었다. Mass flow controller (MFC)를 통하여 메탄과 질소가 공급되고 튜브 전단에서 혼합되어 세라믹 튜브로 공급된다. 세라믹 튜브는 전기로(furnace)안에서 고온으로 유지된다. 고온의 세라믹 튜브로 메탄이 공급되면 내부에서 메탄 열분해 반응이 일어나 메탄이 고체 탄소와 수소로 분해된다. 세라믹 튜브에서 배출되는 가스는 열교환기에서 한 번 냉각되어 일부가 GC로, 나머지는 비커로 연결된다. GC에서는 가스의 조성을 측정하고, 비커에서는 생성된 가스가 배출되고 탄소가 포집된다.
사용된 세라믹 튜브는 알루미나 세라믹(Al2O3) 재질이며 내경이 23 mm, 외경이 30 mm이다. 세라믹 튜브는 전기로 내부에서 가열되며, 약 65 cm의 길이가 전기로 내부에서 가열된다. 실험 조건을 Table 2에 나타내었다.
2.2 실험 조건 및 방법
고온 조건에서의 실험을 위하여 5시간에 걸쳐 서서히 세라믹 튜브 반응기의 온도를 상승시켰으며, 승온 과정에서는 메탄을 공급하지 않고 질소만 공급하였다. 실험 조건에 맞는 온도에 도달하면 메탄을 공급하였으며, 메탄이 공급된 이후부터 GC를 통해 가스 조성을 측정하였다. 배기가스의 조성의 정량화를 위하여 메탄을 공급하는 동안 반응에 참여하지 않는 소량의 질소를 같이 공급하였다. 배출되는 가스의 조성은 GC를 이용하여 측정하였으며, 5분마다 측정하였다. 생성된 고체 탄소가 관내 침적되어 유동을 저해할 때 까지 측정되었으며, 비커에서 가스 기포가 떠오르지 않는 시점에서 실험을 중지하였다.
3. 실험 결과
3.1 메탄 전환율
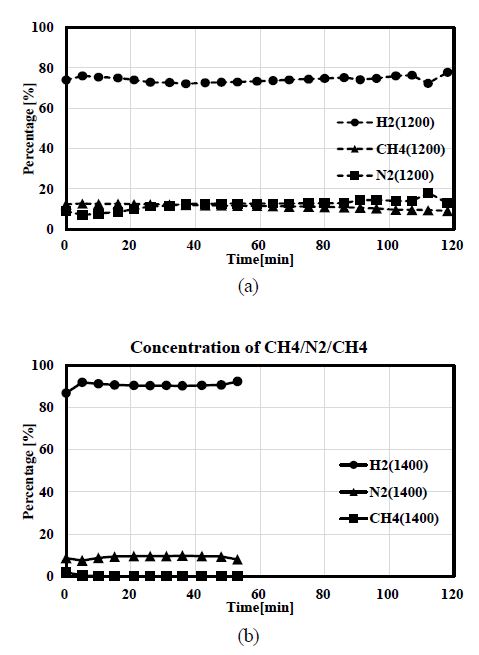
GC의 분석 결과를 토대로 반응기에서의 메탄 전환율을 도출하였다. Fig. 3에 1,200℃와 1,400℃에서 메탄이 열분해 되는 동안의 가스 조성비를 도시하였다. 1,200℃ 조건과 1,400℃ 조건에서의 반응 시간을 비교해보면, 1,200℃ 조건에서는 118분 동안 측정되었으며, 1,400℃ 조건에서는 53분 동안 측정되었다. 이는 두 조건의 측정시간이 다른 이유는 반응기의 막힘에 걸리는 시간이 다르기 때문이다. 관내에서 메탄 열분해 반응이 시작되면 튜브 내 벽면으로부터 고체 탄소가 생성되기 시작하는데, 탄소가 지속적으로 쌓이다 보면 결국 기체의 흐름을 막게 된다. 따라서 1,400℃의 지속시간이 짧은 이유는 튜브가 일찍 막히기 때문이다. 온도가 높아지면 메탄의 열분해 반응이 빨라지고 결국 관내 고체 탄소의 생성이 빨라져 관이 일찍 막히게 된다.
1,200℃에서는 반응이 지속될수록 메탄의 농도가 12%에서 9%로 변동하며, 수소의 농도는 75% 내외로 유지되는 것을 확인할 수 있다. 질소는 9%에서 시작하여 14%로 증가하는 것이 관찰된다. 1,400℃에서는 메탄의 경우 초기 10분 동안 1% 수준의 농도가 유지되나 10분 이후부터는 농도가 측정되지 않았으며, 수소의 농도는 초기 86%에서 10분 이후 90% 수준으로 올라가서 유지되며, 질소는 9% 수준을 유지하였다.
메탄 전환율은 공급된 메탄(QCH4, in) 중 반응에 참여하여 소비된 메탄(QCH4, consumed)을 비율로 정의되며, 아래의 식에 따라 계산하였다.
| (1) |
공급되는 메탄의 양은 MFC로 제어하며, 소비된 메탄의 양은 GC의 조성비 결과와 반응에 참여하지 않은 기체인 질소의 양으로 계산이 가능하다. 조성비를 토대로 메탄 전환율을 계산하였으며, 이를 Fig. 4에 나타내었다. 공급된 메탄 중 화학 반응으로 인하여 소비된 메탄의 비율을 나타내며, 1,200℃조건에서는 초기 약 80% 수준으로 메탄이 반응에 참여하기 시작하여 90% 이상까지 메탄이 반응에 참여하는 것을 볼 수가 있으며, 1,400℃ 조건에서는 모든 메탄이 반응에 참여한다는 것을 확인할 수 있다.
전환율은 메탄이 다른 물질로 전환되는 비율을 나타내는 것이며, 메탄이 수소로 전환되는 것과는 다르다. 반응 이후 메탄의 잔여량을 고려하여야 하는 경우 유용하나, 생산 수율을 고려하기 위해서는 선택도 측면에서 분석을 하여야 한다.
3.2 수소 선택도
계측된 조성비를 바탕으로 메탄에서 수소로 전환되는 비율인 수소 선택도를 계산하였다. 수소 선택도는 공급하는 메탄(QCH4, in)의 비율과 메탄 열분해 반응으로 인하여 수소로 전환된 메탄(QCH4, reaction)의 비율을 통하여 계산되며, 수소로 전환된 메탄의 양은 생산된 수소(QH2, produced)의 양으로부터 역산이 가능하다.
| (2) |
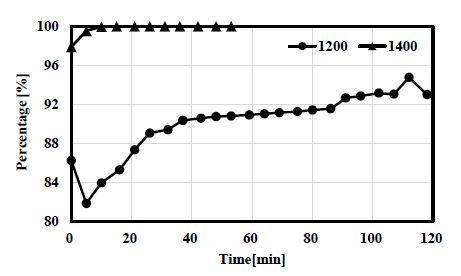
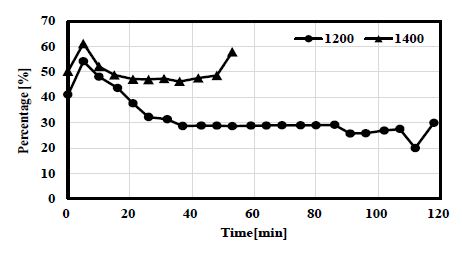
수소 선택도에 대한 결과를 Fig. 5에 나타내었다. 1,200℃ 조건의 그래프를 보면, 메탄 공급 10분 동안 선택도가 55%까지 상승했다가 점차 감소하여 30% 수준을 유지하는 것을 볼 수가 있다. 이는 튜브 내 벽으로 탄소가 생성되면서 열전달을 저해하고, 메탄 열분해의 흡열 반응으로 인하여 벽면 일부 온도가 낮아졌기 때문으로 생각된다. 이러한 현상은 1,400℃ 조건에서도 동일하게 관찰되는데, 메탄 공급 10분후 선택도 최고값인 60%에 도달하였다가 점차 감소하여 48% 수준에 머무르는 것을 확인할 수 있다.
튜브 내 온도를 정밀하게 제어하기는 매우 어렵다. 전기로를 통해서 열이 전달되고 전기로는 튜브와 전기로 히터 사이에 위치해 있는 열전대에 의하여 제어되기 때문에 직접적으로 튜브 내 온도를 제어하기에는 어려움이 있다. 선택도가 낮아지는 이유로 열전달 감소와 흡열 반응으로 인한 내부 온도 저하로 추측되나 내부 온도 측정을 통하여 정확한 분석이 가능할 것으로 생각된다.
두 온도 조건에서 모두 관이 막히기 직전에는 선택도가 갑자기 높아지는 것이 관찰되었는데, 이는 관이 막히기 시작하면서 내부 유동이 저해되고 메탄의 관내 체류시간이 증가하면서 수소로 전환되는 메탄의 비율이 증가했기 때문으로 생각된다.
Fig. 4의 메탄 전환율과 Fig. 5의 수소 선택도를 비교해보면, 반응으로 소모된 메탄의 비율에 비하여 수소로 전환된 메탄의 비율이 상당히 작다는 것을 확인할 수 있다. 1,400℃에서 거의 모든 메탄이 소비되는데, 이 중 실제로 수소로 전환되는 비율은 50% 이하이다. 즉, 메탄 열분해 반응에서 수소로 전환이 아니라 기타 다른 탄화수소 계열의 물질로 전환되는 부반응이 동반됨을 의미한다. 에텐인(ethane, C2H6), 에틸렌(ethylene, C2H4), 아세틸렌(acetylene, C2H2) 혹은 벤젠류와 같은 다른 탄화수소 계열로 생성되는 부산물이 있을 것으로 예상된다. 수소를 생산하는 관점에서 수소 선택도를 높이는 일이 매우 중요하며, 수소 선택도를 높이기 위해서 촉매의 사용이나, 공급 기체의 유량 제어를 통한 체류 시간 증대 등의 방법이 수행되어야 할 것으로 생각된다.
3.3 고체 탄소 분석
메탄 열분해 반응을 통하여 생산된 고체 탄소를 포집하여 성상 분석을 위하여 SEM 측정을 수행하였다. 세라믹 튜브 내 침착된 고체 탄소를 제거하여 모았으며, 모아진 탄소의 사진과 SEM 결과를 Fig. 6에 나타내었다. 탄소의 SEM 사진을 보면 구형으로 균일한 사이즈를 가지는 형상을 볼 수가 있는데, 이는 일반적인 카본 블랙의 형상과 유사하다. 카본 블랙으로 판단되나 탄소의 성상에 대하여 더 정밀한 분석을 위하여 라만 분석, X선 회절 분석 등과 같은 추가적인 분석이 필요하다고 생각된다.
4. 결 론
본 연구에서는 이산화탄소를 배출하지 않고, 저가의 수소를 대량으로 생산하기 위한 기술인 메탄 열분해 수소 생산 기술에 대하여 실험적인 연구를 수행하였다. 세라믹 튜브 반응기를 활용하여 고온에서의 메탄이 열분해되어 수소와 고체 탄소로 분해되는 과정을 실험적으로 검증하였으며, GC 분석을 통하여 메탄 전환율과 수소 선택도를 도출하였다. 1,400℃ 조건에서 메탄은 거의 소비되어 배출되는 가스에서 측정이 되지 않지만, 이 중 수소로 전환되는 비율은 약 50%로 계산되었다. 수소 선택도를 높이기 위한 추가적인 연구가 필요하며, 체류 시간 증가, 촉매 활용 등이 가능할 것으로 판단된다. 메탄 열분해 반응의 부산물인 고체 탄소에 대하여 SEM 분석을 수행하였으며, 카본 블랙의 고체 탄소로 추정되며, 추가적인 분석을 통하여 정밀한 성상 분석이 가능할 것으로 판단된다.
Acknowledgments
본 연구는 한국기계연구원 신진연구자 창의연구지원 사업(KM4010, 차세대 고온 메탄 직접 열분해 반응기 기술 개발)과 산업통상자원부(MOTIE)와 한국에너지 기술평가원(KETEP)의 지원을 받아 수행되었습니다(No. 2019281010007A).
References
-
A. A. Ibrahim, A. H. Fakeeha, A. S. Al-Fatesh, A. E. Abasaeed, and W. U. Khan, “Methane decomposition over iron catalyst for hydrogen production”, International Journal of Hydrogen Energy, Vol. 40, No. 24, 2015, pp. 7593-7600.
[https://doi.org/10.1016/j.ijhydene.2014.10.058]

-
D. Torres, S. de Llobet, J. L. Pinilla, M. J. Lázaro, I. Suelves, and R. Moliner, “Hydrogen production by catalytic decomposition of methane using a Fe-based catalyst in a fluidized bed reactor. Journal of natural gas chemistry”, Journal of Natural Gas Chemistry, Vol. 21, No. 4, 2012, pp. 367-373.
[https://doi.org/10.1016/S1003-9953(11)60378-2]

-
T. Geißler, M. Plevan, A. Abánades, A. Heinzel, K. Mehravaran, R. K. Rathnam, and T. Wetzel, “Experimental investigation and thermo-chemical modeling of methane pyrolysis in a liquid metal bubble column reactor with a packed bed”, International Journal of Hydrogen Energy, Vol. 40, No. 41, 2015, pp. 14134-14146.
[https://doi.org/10.1016/j.ijhydene.2015.08.102]

-
D. C. Upham, V. Agarwal, A. Khechfe, Z. R. Snodgrass, M. J. Gordon, H. Metiu, and E. W. McFarland, “Catalytic molten metals for the direct conversion of methane to hydrogen and separable carbon”, Science, Vol. 358, No. 6365, 2017, pp. 917-921.
[https://doi.org/10.1126/science.aao5023]

-
J. R. Fincke, R. P. Anderson, T. A. Hyde, and B. A. Detering, “Plasma pyrolysis of methane to hydrogen and carbon black” Industrial & engineering chemistry research, Vol. 41, No. 6, 2002, pp. 1425-1435.
[https://doi.org/10.1021/ie010722e]