생활폐수 내 혼합균주를 이용한 미생물 연료전지의 구동 특성에 관한 연구
2021 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
The use of fossil fuels is a major contributor to the increase atmospheric greenhouse gas emissions. As such problems arise, interest in new and renewable energy devices, particularly fuel cells, is greatly increasing. In this study, various characteristics of mixed strains were observed in wastewater collected by the Jeonju Environment Office to investigate the effects of microorganisms on voltage generation and voltage generation of substrates, electrode materials, electrons, electron transport media, and ash microbial fuel cells. As a result of separately measuring the voltage generated during inoculation, the inoculation voltage of Escherichia coli K12 (E. coli K12) was 0.45 V, and the maximum inoculation voltage of the mixed strain was 1.2 V. Thereafter, voltage values were collected using a digital multimeter and the amount of voltage generated over time was measured. In the case of E. coli K12, the maximum voltage reached 0.45 V, and the cell voltage was maintained above 0.23 V for 140 hours. In contrast, for the mixed strain, the maximum voltage reached 1.2 V and the voltage was slowly decreased to 0.97 V. In addition, the degree of microbial adsorption to the electrod surface after the inoculation test was confirmed using a scanning electron microscope. Therefore, these results showed the possibility of purifying pollutants at the same time as power generation through the production of hydrogen ions using microorganisms and wastewater.
Keywords:
Microbial fuel cell, Hydrogen ion, Wastewater, E. coli K12, Mixed strains키워드:
미생물 연료전지, 수소이온, 폐수, 대장균 K12, 혼합균주1. 서 론
증가되고 있는 화석연료의 사용은 환경오염의 주범인 온실가스 농도 증가의 주요 원인 중의 한 원인으로 손꼽히고 있다. 전 세계적으로 화석연료와 석유자원의 과도한 사용은 대기오염 및 지구온난화와 같은 심각한 환경문제를 불러오고 있다. 세계기상기구(WMO)는 화석연료를 사용하기 시작한 산업혁명 후 대기 중에 존재하는 온실가스 농도가 산업혁명 이전의 280.0 ppm에 비하여 2019년 기준으로 407.8 ppm, 약 1.47배 늘어난 수치로 역대 최대치를 기록하였다1). 최근 에너지의 수요 및 공급 비용의 증가로 인하여 대체에너지와 에너지 효율이 우수한 공정 개발에 관한 관심이 높아짐에 따라 이에 관한 연구들이 활발히 진행되고 있다. 그중 연료전지는 연료와 산화제가 공급되는 동안 연료가 가지고 있는 화학에너지를 전기에너지로 연속적으로 변환하는 전기화학적인 장치이다2-6).
알려진 여러 종류의 연료전지 중 미생물 연료전지(microbial fuel cell, MFC)는 전기화학적 활성을 가지는 미생물을 이용하여 유기물에 저장된 생화학적 에너지를 전기에너지로 변환하는 장치로서7-10), 에너지를 소비하는 공정인 하·폐수 처리 공정에 적용하면 하·폐수 내 존재하는 유기오염물을 제거함과 동시에 에너지 생산을 도모함으로써 에너지 생산 공정으로 전환 할 수 있다는 점이 크게 주목받고 있다.
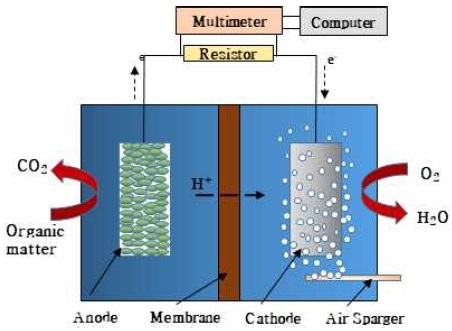
일반적인 연료전지는 일반적으로 수소와 메탄올 등의 연료를 이용하여 산화 반응을 통해 수소이온(H+)과 전자(electron)로 분리된다11-13). 그러나 미생물 연료전지는 수용액 속에 존재하는 포도당 및 아세트산과 같은 유기물, 황화물과 같은 무기물을 미생물의 세포적 호흡과정을 통해 직접 분해하여 수소이온을 생산함으로써 전기를 발생하는 장치이다. 본 연구에서 사용된 미생물 연료전지의 전체적인 모습은 Fig. 1에 나타내었다. 미생물 연료전지 시스템 구조는 외부 전기회로에 의하여 산화극(anode)과 환원극(cathode)을 연결하고 양이온 교환막(proton exchange membrane, PEM)과 같은 이온 교환막(ion exchange membrane)에 의해 양구획이 분리된다. 이때, 산화극에 접종된 미생물이 유기물을 분해하면 전자와 수소이온이 생산된다. 생성된 전자는 외부 전기회로를 통하여 환원극으로 이동하게 되고 수소이온은 양이온 교환막을 통하여 환원극으로 이동한다. 환원극으로 이동한 수소이온과 전자는 환원극에 공급되는 산소 분자와 결합하여 환원 반응을 통해 물을 생성한다14-16). 기질로서 포도당을 사용할 경우 산화극과 환원극에서의 화학 반응식은 다음과 같다.
- 산화극: C6H12O6 + 6H2O ⟶ 6CO2 + 24e- + 24H+ Bo = 0.014 V
- 환원극: 6O2 + 24H+ + 24e- ⟶ 12H2O Bo = 0.013 V
미생물 연료전지가 전기를 생산하는 방법은 3가지로 분류할 수 있는데 다음과 같다: (1) 미생물 연료전지 외의 추가적인 미생물 반응조를 이용하여 미생물 대사 작용의 산물로서 수소이온을 생산 후 연료전지의 전기화학 반응을 유도함으로써 에너지를 생산하는 방법, (2) 전기적 활성이 높은 전자전달 매개체를 이용하여 미생물이 생산한 전자를 전극으로 전달하는 방법, (3) 마지막으로 전자전달 매개체를 사용하지 않는 방법으로 나눌 수 있다17).
미생물 연료전지에서의 분리막은 크게 두 가지의 중요한 역할이 있다. 첫 번째 역할은 산화전극과 환원전극을 분리하는 것이다. 산화전극에서 기질을 산화하여 전자 및 수소이온을 생산하는 미생물은 주로 호기성 미생물이다. 호기성 미생물은 기질을 산화적 호흡 과정을 이용하여 전자전달계를 통해 최종 전자수용체로 세포 밖에 산소에 전자를 제공함으로써 adenosine triphophate (ATP)를 생산하여 생존이 필요한 에너지를 수급한다. 미생물 연료전지는 이때 발생되는 전자를 산화극에 전달하여 외부회로를 통해 이동시킴으로써 전기를 발생하므로 이 호기성 미생물에게 산소를 제공하지 않아 최종 전자수용체로 전극을 선택하게 하는 것이 중요하다. 산소 및 강한 산화제가 사용되는 환원전극부의 수용액이 산화전극부로 섞이지 않게 하는 것이 중요하며, 이러한 강한 산화제는 미생물 생장에 영향을 미치고 산화극에 손상을 주어 전하량이 감소하는 문제를 초래하게 된다. 두 번째 역할은 환원전극으로 전달된 전자와 산화전극에서 생성된 수소이온이 만나 반응할 수 있도록 산화전극에서 생성된 수소이온을 환원전극으로 전달하고 다른 이온들은 이동하지 못하게 막는 선택적 투과막 역할이다. 미생물 연료전지에 주로 사용되는 분리막은 양이온 교환막(PEM), 음이온 교환막(anion exchange membrane, AEM), 양극성 교환막(bipolar exchange membrane, BEM)이 있다18,19).
본 연구에서는 회분식 미생물 연료전지의 전압 발생 및 효율에 영향을 미치는 기질, 전극 재료, 전자 전달매개체, 미생물 종류와 같은 여러 요인들 중에서 일반적으로 전기화학적인 활성을 가진다고 알려진 Escherichia coli K12 (E. coli K12) 종을20) 접종한 미생물 연료전지와 전주시 환경사업소에서 채수한 폐수에 존재하는 혼합 균주를 접종한 미생물 연료전지를 비교하여 미생물 종에 따른 영향을 살펴보았다. 본 실험은 전극에서의 미생물 흡착과 전압 발생을 측정하여 보다 효율적인 미생물 선정을 위한 기초 자료로 활용하고자 하였다.
2. 실 험
2.1 시약
인산염 완충용액(phosphate buffer solution), 아세테이트 나트륨(sodium acetate), 과망가니즈산칼륨(potassium permanganate), 백금촉매(platinum catalyst)는 Sigma-Aldrich사(St Louis, Missouri, USA)에서 구입하였고, 나피온(Nafion 115), 탄소 cloth (Pt-coated carbon cloth)와 흑연펠트(graphite felt)는 (주) Nara cell tech (Seoul, Korea)에서 구매하여 사용하였다. 티타늄 와이어(titanium wire, 0.5 mm)는 Alfa Aesar (Haveril, MA, USA)에서 구입하였으며 그 밖에 특별히 따로 언급하지 않은 과산화수소(hydrogen peroxide), 비타민, 용매 등은 삼전화학(주) (Seoul, Korea)과 대정화금(주) (Siheung, Korea)에서 주로 구입하여 사용하였다.
2.2 E. coli K12 배양
사용된 E. coli K12 균주는 37℃의 저온 배양기에서 멸균된 Lura-Bertani (LB) 배지(트립톤 10 gL-1, 효모 5 gL-1, NaCl 10 gL-1)에서 18시간 동안 호기성 조건에서 성장시켰다. 정지기 상의 휴지기 세포를 원심분리로 수확한 후, 얻은 세포를 100 mM 인산염 완충용액(pH 7.0)에 혼합하여 사용하였다.
2.3 장치 및 특성분석
실험에서 사용된 미생물 연료전지는 유리로 제작된 H모형 이실형 구조(H-shape dual chamered MFC, adams & chitteden scientific glass)이다. 사용된 셀은 분리막을 기준으로 양쪽에 산화전극조와 환원전극조로 구성되어 있는데, 이 반응기의 형태는 두 개의 원기둥 모양의 유리 반응조가 가운데의 중간통로로 이어져 클램프로 고정시키는 방식으로 밑면 반지름 4.5 cm⨯높이 8 cm이다. 반응기 총 부피는 150 mL로 미생물 연료전지의 산화전극조에서 발생하는 전자를 환원전극으로 흐르게 유도하기 위하여 외부회로로 티타늄 와이어(0.5 mm)를 사용하였으며 외부저항은 1,000 Ω으로 설정하여 실험하였다.
산화전극(anode electrode)은 50 mM의 인산염 완충 용액(pH 7-7.5)에 미생물의 전자 방출기질로 사용될 아세테이트 나트륨을 2 gL-1의 농도로 넣은 용액 120 mL를 접종 후 사용하였고, 환원전극(cathode electrode)은 산화제로써 50 mM 과망가니즈산칼륨 용액 120 mL를 채워 최종 전자수용체로 사용하였다. 산화전극은 흑연펠트를 2.5 cm⨯2.5 cm 두께로 재단하여 티타늄 와이어에 직접 연결하여 사용하였다. 환원전극은 백금촉매를 도포한 탄소 cloth (Pt-coated carbon cloth)를 사용하였으며, 환원전극 또한 산화전극과 동일한 면적인 2.5 cm⨯2.5 cm로 재단하여 티타늄 와이어에 단순 연결하여 사용하였다. 분리막은 과산화수소(34.5%)로 전처리한 나피온 양이온 교환막(Nafion 115)을 반응조의 중간다리 크기(지름 3 cm)에 맞춰 재단하여 산화전극조와 환원전극조의 사이에 클램프로 단단히 고정하여 양극조를 분리하였고, 양극액이 서로 섞이지 않도록 하였다21,22). 본 실험에서 사용된 미생물은 전주시 환경사업소의 1차 소화조와 2차 소화조에서 채수된 폐수 속에 존재하는 혼합 균주를 사용하였다.
미생물 연료전지가 생산하는 전압을 측정하기 위하여 디지털 멀티미터(3701A, Keithley Instrument, Cleveland, OH, USA)를 사용하여 발생되는 전압을 수집하여 분석하였으며, 이를 통한 인공폐수의 정화능력 및 전압 발생 능력을 분석하였다. Fig. 2에 구체적인 미생물 연료전지의 모습과 실제로 구동중인 이실형 미생물 연료전지를 나타냈다.
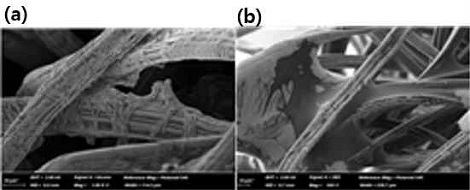
전계방출형 주사전자현미경(field emission scanning electron microscopy, FE-SEM)을 이용한 표면 분석은 가속 전자빔을 시료에 조사해 시료 표면의 형상, 즉 입자의 크기와 배열 상태를 확인한다. 본 연구에서 균주가 붙어있는 전극의 표면 상태를 확인하기 위하여 JEOL사(Tokyo, Japan)의 JSM-6400 기기를 이용하였다.
2.4 미생물 연료전지 구동
미생물 연료전지가 정상적으로 전압을 발생하기 위해서는 미생물의 산화전극으로 안정된 접종이 필수적이다. 본 실험에서 산화전극의 미생물 접종은 전주 환경사업소에서 1차 침전지 유출수 및 활성슬러지 유출수를 1 대 4 비율로 섞은 슬러리 120 mL를 산화전극조에 가득 채운 뒤, 30℃ 항온실에서 외부저항 1,000 Ω에 연결하여 접종시켰다. 원활한 미생물 접종을 확인하기 위하여 디지털 멀티미터를 이용해 미생물 연료전지의 전압을 15분 간격으로 측정하였다. 72시간 운전 후에 100 mV 이상 지속적인 전압이 생산되었을 때, 접종 완료된 것으로 판단하고, 미리 준비한 실험실 배양액으로 교체하여 운전하였으며, 이때 사용된 배양액은 아세트산 나트륨 2 gL-1과 비타민이 포함된 50 mM 인산염 완충 용액을 사용하였다23). 내부 용액이 침전되지 않도록 마크네틱 바를 이용하여 지속적으로 교반시켜 구동하였다. 그 후 시스템을 회분식으로 운전하면서 산화전극의 미생물 막을 10주 동안 성장시켰다24). 전압의 생성이 최대에 다다른 것을 확인한 후에 I-V 분극곡선 분석을 수행하였다.
3. 결과 및 고찰
3.1 E. coli K12 균주 접종
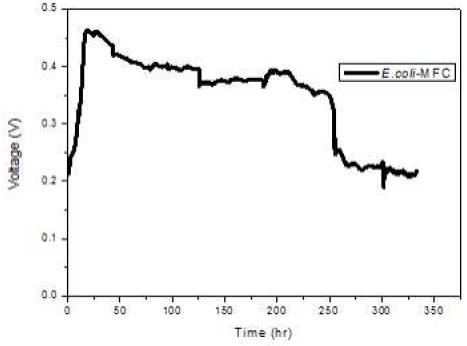
본 실험에서는 전주시 전주환경사업소의 혼합 균주가 미생물 연료전지에 접종되었을 때 전압 발생을 비교하기 위한 비교군으로서 전자전달 매개체가 요구되지 않는 종으로 보고된 E. coli K12(유전자 변형 대장균)를 사용하였다. 비교군의 전압 발생 결과는 Fig. 3에 나타냈다.
대장균을 접종한 미생물 연료전지의 전압 발생 그래프는 접종이 시작되고 나서 25시간 동안 0.2 V에서 꾸준히 상승하여 0.45 V에서 최대 전압에 도달하였고, 이후 점진적으로 하강하여 250시간이 지났을 때 다시 0.23 V까지 감소한 후 100시간 동안 비슷한 값을 유지하였다. 이는 접종 초기에 혐기성 조건이 형성된 후 미생물이 발생하는 전자의 양이 증가하여 전압이 상승한 것으로 보이며25), 이후 미생물이 생장을 멈추고 전압 발생 구간에 접어들어 비교적 안정적으로 유지되다가 250시간 후에는 배양액의 유기물질이 감소함에 따라 미생물의 대사가 함께 감소하여 전압이 낮아지는 것으로 해석된다.
3.2 혼합 균주 접종
산화극과 환원극에 저항 1,000 Ω을 로딩한 멀티미터를 연결한 후, 시간에 따른 전류 값을 측정하였다. 실험 후 약 2주의 시간이 흘렀을 때 전압 발생이 거의 중단되었음을 볼 수 있었다. 이는 기질로 사용된 아세트산나트륨이 거의 소모되었음을 시사한다.
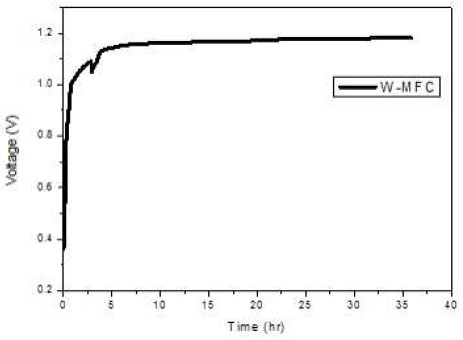
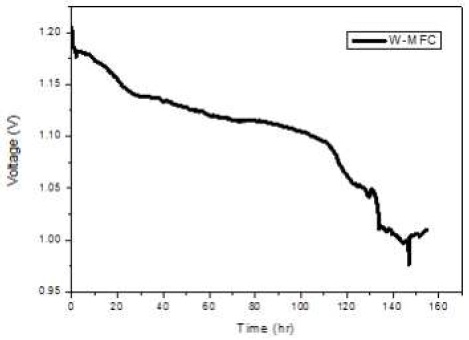
Fig. 4는 접종 단계에서 전압 발생이 되었음을 나타내고, Fig. 5는 접종 단계가 지난 후 산화전극 액체를 교체 한 후의 전압 발생을 나타낸다.
Fig. 4에 나타난 결과에 따르면, 혼합균주를 접종한 미생물 연료전지는 접종 초기에 0.4 V로 시작하여 5시간 이내에 매우 빠른 속도로 1.18 V까지 상승하였으며 이후 38시간 동안 이 값이 유지되어 최대 1.2 V의 전압 발생량을 보였다. 이는 전주시 환경사업소의 생활폐수에 용존산소량이 낮고 유기물질이 매우 높은 농도로 존재하고 있어 혐기성 조건이 쉽게 형성되었음과 풍부한 유기물질로 인하여 미생물의 대사가 매우 활발하게 진행됨을 나타낸다. 이때 접종이 완료된 것으로 판단되어 산화전극조를 채우고 있던 폐수 슬러지를 비우고, 인공적으로 제조한 아세트산나트륨을 첨가한 완충용액을 채워 다시 전압 발생을 측정하였다. Fig. 5는 산화전극액 교체 후 발생하는 전압은 전종이 완료되었을 때의 값과 거의 비슷한 1.2 V 정도였으나 이후 기질로 사용되는 유기물질의 농도가 낮아짐에 따라 140시간에 걸쳐 0.97 V까지 서서히 감소하는 것을 보여 준다26,27).
4. 결 론
본 논문에서는 E. coli K12를 접종한 미생물 연료전지와 전주시 환경사업소에서 채수한 폐수 내에 존재하는 혼합균주를 접종한 미생물 연료전지를 비교하여 전기 생산에 관한 기본적인 응용 연구를 수행하였으며 다음과 같은 결론을 얻었다. 회분식으로 운영한 미생물 연료전지 시스템으로부터의 전기 생산은 접종된 미생물의 종류, 내부 저항, 미생물의 활동도에 영향을 받으며, 또한 미생물 연료전지의 산화 반응조로부터 생성된 수소이온을 이용한 전기 생산과 오염물질의 정화가 가능하다.
전주시 환경사업소의 1차 및 2차 소화조에서 채수한 생활폐수에는 수많은 미생물균주가 혼합되어 있으며 그 혼합균주 속에 혐기성 조건에서 전자를 방출할 수 있는 전자방출 균주가 존재한다. 이 생활폐수에 존재하는 혼합균주를 접종한 미생물 연료전지는 기존에 보고된 E.coli K12 균주를 접종하여 사용한 미생물 연료전지보다 전압 발생이 우수하였다. 결론적으로 폐수 내의 혼합균주를 활용한 미생물 연료전지는 단일 E.coli K12 균주보다 전압 발생이 우수하였을 뿐만 아니라 동시에 폐수 정화처리를 함께 도모할 수 있기에 차세대 폐수 처리기술로 발전할 가능성이 높다고 판단된다.
Acknowledgments
이 성과는 2020년도 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구입니다(No. 2020R1A2B5B01001458).
References
-
J. Li, Q. Chen, T. Wang, H. Wang, and J. Ni, “Hydrochemistry and nutrients determined the distribution of greenhouse gases in saline groundwater”, Environmental Pollution, Vol. 286, 2021, pp. 117383.
[https://doi.org/10.1016/j.envpol.2021.117383]

- D. Han and D. J. Yoo, “Synthesis and charaterization of polybenzimidazole random copolymers containing methylene chain for high temperature PEMFC”, Trans Korean Hydrogen New Energy Soc, Vol. 29, No. 6, 2018, pp. 578-586.
-
S. K. Ryu, M. Vinothkannan, A. R. Kim, and D. J. Yoo, “Effect of type and stoichiometry of fuels on performance of polybenzimidazole-based proton exchange membrane fuel cells operating at the temperature range of 120–160 °C”, Energy, Vol. 238, 2022, pp. 121791.
[https://doi.org/10.1016/j.energy.2021.121791]

-
J. Y. Chu, A. R. Kim, K. S. Nahm, H. K. Lee, and D. J. Yoo, “Synthesis and characterization of partially fluorinated sulfonated poly(arylene biphenylsulfone ketone) block copolymers containing 6F-BPA and perfluorobiphenylene units”, International Journal of Hydrogen Energy, Vol. 38, No. 14, 2013, pp. 6268-6274.
[https://doi.org/10.1016/j.ijhydene.2012.11.144]

-
K. H. Lee, J. Y, Chu, A. R. Kim, K. S. Nahm, C. J. Kim, and D. J. Yoo, “Densely sulfonated block copolymer composite membranes containing phosphotungstic acid for fuel cellmembranes”, Journal of Membrane Science, Vol. 434, 2013, pp. 35-43.
[https://doi.org/10.1016/j.memsci.2013.01.037]

-
D. Park, Y. J. Sohn, Y. Y. Choi, M. Kim, and J. Hong, “A study on oxygen diffusion characteristics according to changes in flow field shape of polymer electrolyte membrane fuel cell metallic bipolar plate for building”, Trans Korean Hydrogen New Energy Soc, Vol. 32, No. 4, 2021, pp. 245-255.
[https://doi.org/10.7316/KHNES.2021.32.4.245]

-
G. G. Kumar, A. R. Kim, K. S. Nahm, D. J. Yoo, and R. Elizabeth, “High ion and lower molecular transportation of the poly vinylidene fluoride–hexa fluoro propylene hybrid membranes for the high temperature and lower humidity direct methanol fuel cell applications”, Journal of Power Sources, Vol. 195, No. 18, 2010, pp. 5922-5928.
[https://doi.org/10.1016/j.jpowsour.2009.11.021]

-
Y. Cao, H. Mu, W. Liu, R. Zhang, J. Guo, M. Xian, and H. Liu, “Electricigens in the anode of microbial fuel cells: pure cultures versus mixed communities”, Microbial Cell Factories, Vol. 18, No. 39, 2019.
[https://doi.org/10.1186/s12934-019-1087-z]

-
B. E. Logan, “Microbial fuel cells”, Wiley, 2007, pp. 146-161.
[https://doi.org/10.1002/9780470258590]

-
C. Karthikeyan, Y. Sathishkumar, Y. S. Lee, A. R. Kim, D. J. Yoo, and G. G. kumar, “The influence of chitosan substrate and its nanometric form toward the green power generation in sediment microbial fuel cell”, J. Nanoscience and Nanotechnology, Vol. 17, No. 1, 2017, pp. 558-563.
[https://doi.org/10.1166/jnn.2017.12090]

-
J. Y. Chu, K. H. Lee, A. R. Kim, and D. J. Yoo, “Study on the chemical stabilities of poly (arylene ether) random copolymers for alkaline fuel cells: effect of main chain structures with different monomer units”, ACS Sustainable Chemistry & Engineering, Vol. 7, No. 24, 2019, pp. 20077-20087.
[https://doi.org/10.1021/acssuschemeng.9b05934]

-
R. Kannan, A. R. Kim, and D. J. Yoo, “Enhanced electrooxidation of methanol, ethylene glycol, glycerol, and xylitol over a polypyrrole/manganese oxyhydroxide/palladium nanocomposite electrode”, J. Appl. Electrochem., Vol. 44, 2014, pp 893-902.
[https://doi.org/10.1007/s10800-014-0706-y]

-
D. J. Yoo, S. H. Hyun, A. R. Kim, G. G. Kumar, and K. S. Nahm, “Novel sulfonated poly(arylene biphenylsulfone ether) copolymers containing bisphenylsulfonyl biphenyl moiety: structural, thermal, electrochemical and morphological characteristics”, Polymer International, Vol. 60, No. 1, 2010, pp. 85-92.
[https://doi.org/10.1002/pi.2914]

-
K. Rabaey and W. Verstraete, “Microbial fuel cells: novel biotechnology for energy generation”, Trends Biotechnology, Vol. 23, No. 6, 2005, pp. 291-298.
[https://doi.org/10.1016/j.tibtech.2005.04.008]

-
W. Kong, Q. Guo, X. Wang, and X. Yue, “Electricity generation from wastewater using an anaerobic fluidized bed microbial fuel cell”, Industrial & Engineering Chemistry Research, Vol. 50, No. 21, 2011, pp. 1225-12232.
[https://doi.org/10.1021/ie2007505]

-
J. R. Kim, S. Cheng, S. E. Oh, and B. E. Logan, “Power generaion using different cation, anion, and ultrafiltration membrane in microbial fuel cells”, Environ. Sci. Technol., Vol. 41, No. 3, 2007, pp. 1004-1009.
[https://doi.org/10.1021/es062202m]

-
M. Grzebyk and G Poźniak, “Microbial fuel cells (MFCs) with interpolymer cation exchange membranes”, Separation and Purification Technology, Vol. 41, No. 3, 2005, pp. 321-328.
[https://doi.org/10.1016/j.seppur.2004.04.009]

-
M. Rahimnejad, A. Adhami, S. Darvari, A. Zirepour, and S. E. Oh, “Microbial fuel cell as new technology for bioelectricity generation: a review”, Alexandria Engineering Journal, Vol. 54, No. 3, 2015, pp. 745-756.
[https://doi.org/10.1016/j.aej.2015.03.031]

- T. H. Choi, H. W. Kim, and H. B. Park, “Current research trends in microbial fuel cell based on polymer electrolyte membranes”, The Membrane Society of Korea, Vol. 20, No. 3, 2010, pp. 173-184. Retrieved from http://203.250.217.22/article/JAKO201009654401239.pdf, .
-
I. H. Park, G. G. Kumar, A. R. Kim, P. Kim, and K. S. Nahm, “Microbial electricity generation of diversified carbonaceous electrodes under variable mediators”, Bioelectrochemistry, Vol. 80, No. 2, 2011, pp. 99-104.
[https://doi.org/10.1016/j.bioelechem.2010.06.007]

-
J. X. Leong, W. R. W. Daud, M. Ghasemi, K. B. Liew, and M. Ismail, “Ion exchange membranes as separators in microbial fuel cells for bioenergy conversion: a comprehensive review”, Renewable and Sustainable Energy Reviews, Vol. 28, 2013, pp. 575-587.
[https://doi.org/10.1016/j.rser.2013.08.052]

-
A. R. Kim, J. C. Gavunada, and D. J. Yoo, “Amelioration in physicochemical properties and single cell performance of sulfonated poly(ether ether ketone) block copolymer composite membrane using sulfonated carbon nanotubes for intermediate humidity fuel cells”, International Journal of Energy Research, Vol. 43, No. 7, 2019, pp. 2974-2989.
[https://doi.org/10.1002/er.4494]

-
S. P. Jung, E. Kim, and B. Koo, “Effects of wire-type and mesh-type anode current collectors on performance and electrochemistry of microbial fuel cells”, Chemosphere, Vol. 209, 2018, pp. 542-550.
[https://doi.org/10.1016/j.chemosphere.2018.06.070]

-
C. W. Lin, C. H. Wu, Y. H. Chiu, and S. L. Tsai, “Effects of different mediators on electricity generation and microbial structure of a toluene powered microbial fuel cell”, Fuel, Vol. 125, 2014, pp. 30-35.
[https://doi.org/10.1016/j.fuel.2014.02.018]

-
D. H Park and J. G Zeikus, “Electricity generation in microbial fuel cells using neutral red as an electronophore”, Applied and Environmental Microbiology, Vol. 66, No. 4, 2000, pp. 1292-1297.
[https://doi.org/10.1128/AEM.66.4.1292-1297.2000]

-
B. E. Logan, B. Hamelers, R. Rozendal, U. Schröder, J. Keller, S. Freguia, P. Aelterman, W. Verstraete, and K. Rabaey, “Microbial fuel cells: methodology and technology”, Environmental Science & Technology, Vol. 40, No. 17, 2006, pp. 5181-5192.
[https://doi.org/10.1021/es0605016]

- C. J. Park, A. R. Kim, and D. J. Yoo, “Preparation and charaterization of SPAES/SPVdF-co-HFP blending membranes for polymer electrolyte membrane fuel cells”, Trans Korean Hydrogen New Energy Soc, Vol. 30, No. 3, 2019, pp. 227-236.
-
N. Eaktasang, C. S. Kang, S. J. Ryu, Y. Suma, and H. S. Kim, “Enhanced current production by electroactive biofilm of sulfate-reducing bacteria in the microbial fuel cell”, Environmental Engineering Research, Vol. 18, No. 4, 2013, pp. 277-281.
[https://doi.org/10.4491/eer.2013.18.4.277]

-
N. Uria, I. Ferrera, and J. Mas, “Electrochemical performance and microbial community profiles in microbial fuel cells in relation to electron transfer mechanisms”, BMC Microbiology, Vol. 17, 2017, pp. 208.
[https://doi.org/10.1186/s12866-017-1115-2]

-
D. A. Nguyen, N. Pham, and H. T. Pham, “Wastewater treatment performance and microbial community of anode electrodes of membrane and membrane-less MFCs under effect of sunlight”, Journal of Water Process Engineering, Vol. 42, 2021, pp. 102159.
[https://doi.org/10.1016/j.jwpe.2021.102159]

-
W. Wang, Q. Zhao, J. Ding, K. Wang, and J. Jiang, “Develpoment of an MFC-powered BEF system with novel Fe-Mn-Mg/CF composite cathode to degrade refractory pollutants”, Journal of Clearner Production, Vol. 326, 2021, pp. 129348.
[https://doi.org/10.1016/j.jclepro.2021.129348]