암모니아 개질에 대한 Ni 촉매 특성: Ni 함량과 공간속도 비교
2021 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
A reforming catalyst for hydrogen production from ammonia is being studied. Non-novel metal based Ni catalysts for use in ammonia reforming processes are being developed. In this study, the ammonia reforming characteristics according to Ni content of the alumina pellet supported catalyst in the mid-temperature region were investigated under different space velocity. 20 Ni and 3,000 h-1 showed the best catalytic activity with ammonia conversion of 63% among all conditions.
Keywords:
Ammonia, Hydrogen, Reforming, Catalyst, Nickel키워드:
암모니아, 수소, 개질, 촉매, 니켈1. 서 론
전 세계적으로 급격한 산업 발전 등에 의하여 에너지 수요가 증가하였다. 이에 따른 화석연료(석유, 천연가스 및 석탄)의 연소를 통한 에너지원으로 사용이 증가하였다. 화석연료의 연소를 통한 에너지 사용은 지구 환경에 부하가 걸리는 문제점이 있다. 전 세계의 국가들이 파리기후협약을 통한 지구 환경오염의 해결방안으로 신재생에너지 시스템으로의 전환이 필수적임을 제시하였다. 신재생에너지는 태양광, 풍력 및 기타 신재생에너지 부분이 있으나 태양광이나 풍력 발전 등의 자연으로부터의 에너지 공급은 안정적인 공급이 어렵다는 단점이 있다. 이러한 전력의 안정적 공급을 위한 방안으로 수소로의 에너지 저장 형태가 제시되고 있다. 수소의 경우 물 또는 유기물질로부터 생산이 되며, 그 양이 거의 무한정에 가깝고 날씨의 영향과 지역적 편중이 없으며 장기간 대용량 저장이 가능하다.
생산된 수소는 생산방법에 따라 각각 그레이 수소(grey hydrogen), 블루 수소(blue hydrogen), 그린 수소(green hydrogen)로 분류할 수 있다1). 그레이 수소의 경우 천연가스, 수증기 개질(steam methane reforming, SMR), 석탄가스화와 같은 화석연료 기반에서 추출하며 대량의 이산화탄소를 포함한다2). 블루 수소는 화석연료 기반으로 추출된 그레이 수소 기반으로 대량의 이산화탄소를 포함하고 있는 그레이 수소에서 capture and storage (CO2 CCS) 방법을 통해 일부 이산화탄소를 제거하여 추출된 수소이다3). 위 두 가지 방법의 경우 지구온난화의 주요 문제인 이산화탄소를 포함하고 있다. 그린 수소의 경우 재생에너지(태양광, 풍력 등)를 이용한 물의 전기분해나 촉매를 사용한 암모니아(NH3)의 분해를 통해 생산되며 이산화탄소의 발생이 없는 수소로 지구 환경의 부하를 감소시키며 에너지를 생산하는 방법으로 주목받고 있다4,5).
현재 촉매를 사용하여 암모니아의 분해를 통한 수소생산 연구가 활발히 진행되고 있다. 암모니아의 개질은 중온 영역 대략 500oC 부근에서 진행되나 현재 암모니아 개질 촉매의 경우 귀금속 촉매인 Ru 기반의 촉매가 가장 뛰어난 촉매 활성을 나타내며 많이 연구되고 있다6-8). 공정에서 촉매에 대한 비용 감축을 위해서는 기존 귀금속 기반의 촉매보다 촉매 비용을 낮출 수 있는 비귀금속계 촉매의 개발이 필요하다. 비귀금속계 암모니아 개질 촉매의 경우, nickel, cobalt, iron 등이 사용되고 있으며, 그중 Ni은 비귀금속계 촉매 중 뛰어난 암모니아 개질 활성을 가진다7).
본 연구에서는 비귀금속계 촉매 중 뛰어난 성능을 가진 Ni에 대해 중온 영역에서의 암모니아 개질 반응의 특성을 확인하고자 하였다. 비교군으로 기존 시판되고 있는 Ru 기반의 상용 개질 촉매를 선정하였다. 암모니아 개질 공정에 사용하기 위해 pellet 형태의 암모니아 지지체를 기반으로 하여 Ni의 함량과 공간속도에 따른 암모니아 개질 반응의 특성을 확인하고 최적의 Ni 함량을 찾고자 하였다.
2. 실 험
2.1 암모니아 분해 촉매 선정 및 제조
기존 귀금속 촉매와의 암모니아 개질에 대한 촉매의 성능 비교를 위해 시중에 판매되고 있는 S사의 알루미나 지지체에 2 wt% Ru을 담지한 구형의 상용 개질 촉매를 사용하였다. Ni 기반의 촉매의 경우, Al2O3 pellet 지지체에 Ni nitrate hexa-hydrate (Ni[NO3]2×6H2O) 전구체를 사용하여 함침법을 통해 제조하였다. 전체 질량에 대해 각각 10, 20, 30 wt% 함량만큼의 Ni metal을 계산하여 제조하였다. 이후 모든 샘플들은 함량에 따라 2 Ru, 10 Ni, 20 Ni, 30 Ni로 표기하였다.
2.2 실험 장치 구성 및 평가 방법
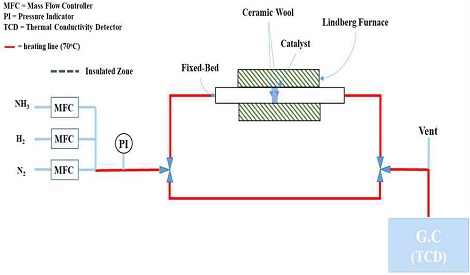
Fig. 1은 개질촉매의 특성을 확인하기 위해 사용된 장치 개략도이다. 반응기의 경우 lindberg 형태의 반응기를 사용하였으며, mass flow controller (MFC)를 통해 반응 가스 및 환원 가스의 유량을 조절하였으며, gas chromatography (GC)를 통해 가스 분석을 진행하였다. GC 컬럼은 Porapak-Q를 사용하여 암모니아와 수소가스를 분리하였고, 특히 암모니아 분석을 통해 전환율을 계산하였다. Inject의 온도는 120℃로 하였으며, 캐리어 가스는 질소 가스를 사용하였다. 가스 검출기는 thermal conductivity detector (TCD)를 사용하였고 운전온도는 180℃로 하였다.
모든 촉매의 평가는 0.1 g 기준으로 고정층 반응기에서 공간속도 30,000 h-1의 H2와 N2를 50:50으로 혼합하여 30-500oC까지 분당 5oC의 속도로 승온하여 500oC에서 2시간 동안 환원 후 평가를 진행하였다. 촉매의 암모니아 개질 특성 평가는 모든 촉매에서 온도 조건을 500oC로 고정하여 평가하였다. 반응 가스는 MFC를 통하여 각 공간속도 3,000 h-1과 30,000 h-1을 기준으로 하여 전체 유량을 조절하였고, NH3와 N2 가스를 43.5:56.5의 비율로 혼합하여 주입하였다.
H2-temperature programmed reduction (H2-TPR)의 경우 thermogravimetric analysis (TGA)를 통해 H2 100 voL% 분위기에서 30-800oC까지 5oC/min의 속도로 승온하면서 측정하였다. 촉매의 격자상 특성은 X-ray Diffraction (XRD)을 통하여 측정하였고, nickel 입자의 크기는 scherrer equation을 통해 계산하였다.
3. 결과 및 고찰
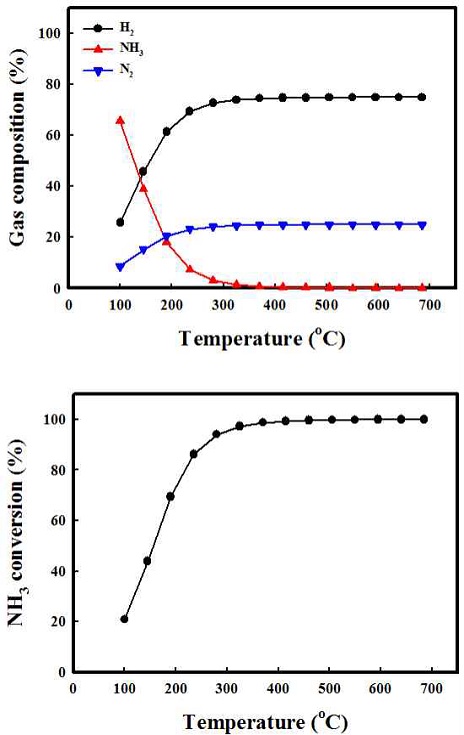
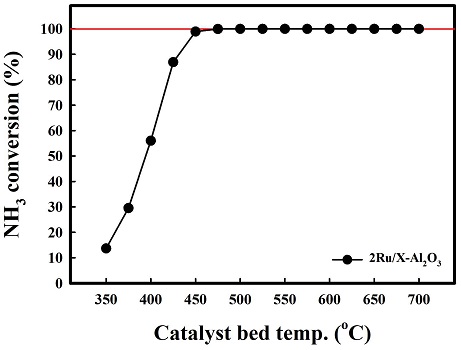
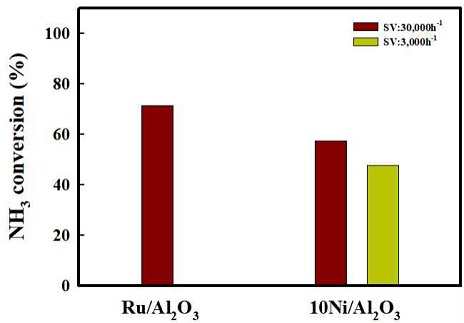
Fig. 2는 암모니아의 개질 반응에 대한 온도에 따른 열역학적 전환율과 가스의 함량을 나타내었다. 암모니아 개질 반응은 흡열 반응으로 온도가 높아짐에 따라 암모니아의 개질 반응이 전환율이 증가 되는 것으로 나타난다. 암모니아의 개질 반응은 대략 425oC 조건에서 이론적 암모니아 전환율 100%를 나타냄을 확인하였다. Fig. 3은 암모니아 개질촉매로 사용되고 있는 2 Ru/X-Al2O3를 350oC에서 700oC까지의 암모니아를 통한 개질 반응을 진행한 결과이다. 앞선 열역학적 값을 통한 암모니아의 전환율은 대략 425oC 정도에서 전환율 100%에 도달하였다. 개질 촉매를 통한 암모니아의 전환율은 낮은 온도에서는 비교적 열역학적 전환율에 비해 낮은 결과를 보이나 온도 상승에 따라 전환율이 증가하였고, 475oC 부근에서 암모니아 전환율 100%에 도달하는 것으로 확인하였다. Fig. 4는 고정층 반응기에서 상용 귀금속 촉매 2 Ru/Al2O3와 10 Ni/Al2O3 촉매의 공간속도 30,000 h-1, 500oC의 조건에서 촉매 성능평가 결과를 나타내었다. 구슬 형태의 상용 촉매 2 Ru/Al2O3의 경우 74% 암모니아 전환율을 보였다. Pellet 형태의 10Ni/Al2O3 촉매의 경우 공간속도 30,000 h-1에서는 47% 암모니아 전환율을 보였고, 공간속도 3,000 h-1에서는 57%를 보였다. 상용 촉매의 경우 귀금속인 Ru를 기반으로 하여 암모니아 개질 반응에서 높은 성능을 보이나 공정 운용을 위한 가격적 측면에서는 비교적 가격이 싼 비귀금속의 개발이 필요하다. 이에 Ni/Al2O3 기반에 대한 각각 10, 20, 30 wt% Ni 촉매의 함량과 공간속도 3,000 h-1, 30,000 h-1를 제어하여 촉매의 암모니아 개질 특성을 평가하였다.
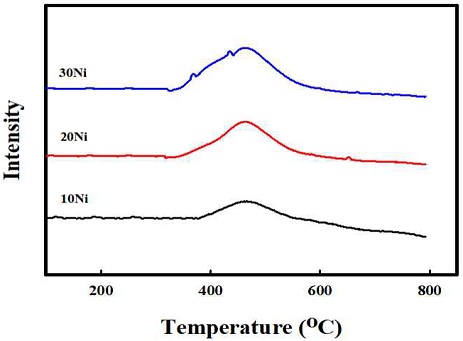
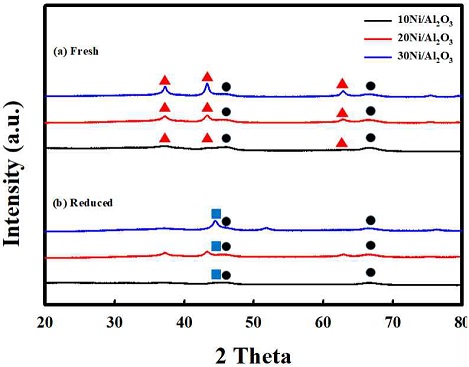
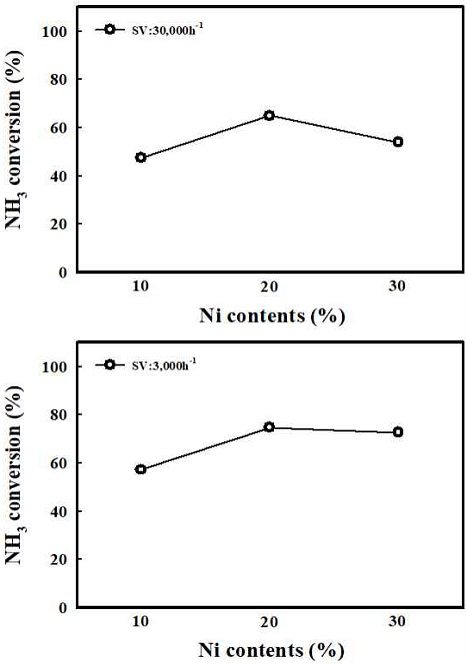
Fig. 5는 Ni 함량 10, 20, 30의 각각에 대한 H2-TP R 결과를 나타내었다. 모든 함량에서 약 400oC 이전에서 환원이 진행되었고, 600oC 이전에 모든 샘플의 환원이 종료됨을 확인하였다. Ni의 함량이 증가 될수록 Ni과 Al2O3 사이에 상호작용이 적은 NiO가 많아지고, 따라 Nickel의 환원 시작 온도가 감소하는 것을 확인하였다. Fig. 6은 모든 함량의 샘플들에 대한 환원 전과 환원 후의 XRD 결과를 나타내었다. 먼저 fresh에서 모든 샘플에 대해 NiO가 담지되었음을 확인하였고, 미리 계산된 Ni 함량의 증가에 따라 NiO의 피크도 점점 커짐을 확인하였다. Reduced의 XRD를 결과를 보면 H2 분위기에서 2시간 동안 환원을 진행한 후 모든 Ni 샘플들의 NiO 피크는 활성 상태의 Nio 피크로 모두 전환됨을 확인하였다. Table 1은 환원 진행 후 XRD 결과에 대해 Nio의 입자 크기를 scherrer-equation으로 계산하여 정리하였다. 10 Ni과 20 Ni의 경우 5.9 nm와 5.5 nm로 비교적 작은 Ni의 입자 크기를 나타내었으나 30 Ni로 함량이 증가하였을 경우 Ni의 입자 크기가 18.3 nm로 대략 3배 증가하였음을 확인하였다. Fig. 7은 반응온도 500oC의 고정 조건에서 Ni 기반의 개질 촉매의 함량과 공간속도에 따른 암모니아 개질 특성 평가 결과를 나타내었다. 공간속도 3,000 h-1과 30,000 h-1의 조건에서 각각 Ni 함량=10, 20, 30을 비교하였다. 먼저 공간속도 30,000 h-1에서는 20 Ni에서 전환율 63%로 가장 높은 전환율을 보였다. 공간속도 3,000 h-1에서는 20 Ni에서 73%과 30 Ni 71%의 전환율를 보였고, 10Ni에서는 비교적 낮은 전환율을 나타내었다. 개질 촉매의 함량과 공간속도에 따른 개질 특성 평가 결과를 통해 모든 조건에서 20 Ni에서 가장 뛰어난 촉매 활성을 보임을 확인하였다. 함량 증가에 따라 촉매 활성이 증가하는 경향을 보였으나 30 Ni에서 감소한 것은 앞선 Ni 입자 크기는 함량에 대해 각각 5.9 nm, 5.5 nm, 18.3 nm로 나타남을 확인하였다. 10 Ni과 20 Ni의 경우 10 nm 미만의 작은 Nio의 입자 크기를 보이나 30 Ni의 경우 18.3 nm로 큰 입자 크기를 보였다. 30 Ni에서의 Ni metal은 환원 후 입자의 뭉침으로 인해 개질 반응의 활성이 20 Ni의 함량에서보다 감소하였음을 확인하였다.
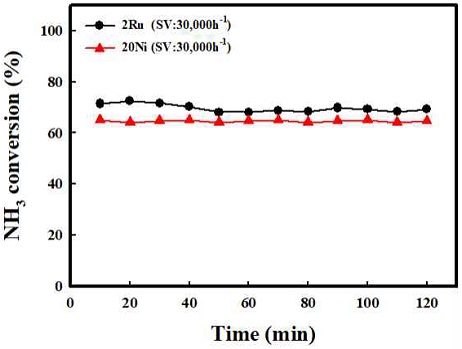
앞선 Ni의 함량과 공간속도의 비교를 통해 20Ni 함량 조건에서 가장 뛰어난 촉매 개질 특성을 보임을 확인하였다. Fig. 8은 가장 뛰어난 개질 특성과 안정성을 가지는 20 Ni과 상용 귀금속 촉매 2 Ru/Al2O3의 500oC의 반응온도 및 공간속도 30,000 h-1 조건에서 2시간 동안 안정성 평가 결과를 나타내었다. 2 Ru은 초기 전환율 73%였으나 2시간 평가 후 미세한 감소를 보였다. Ni 기반의 촉매와 상용 귀금속 촉매인 2 Ru과 비교하였을 때, 10 Ni에서는 비교적 낮은 전환율을 보였으나 20 Ni에서 전환율 63%로 Ni의 함량 조절을 통해 일정 수준 이상의 암모니아 전환율의 증가와 개질 반응에 대한 안정성를 확인할 수 있다.
4. 결 론
본 연구는 Ni의 함량과 공간속도에 따른 암모니아 개질 특성을 확인하기 위해 진행되었다. 상용 개질 촉매 2 Ru/Al2O3와 alumina pellet을 지지체로 하여 Ni 함량 10, 20, 30 wt%를 담지한 촉매에 대해 각각의 함량에 따른 개질 특성과 공간속도 3,000과 30,000 h-1의 조건에서의 촉매 성능을 평가하였다.
1) 공간속도 3,000 h-1의 조건에서는 10 Ni에서 20, 30 Ni에서의 암모니아 전환율이 증가하나 20 Ni 이상부터는 전환율 73%로 비슷하며 함량 증가에 따른 전환율이 일정 수준 감소함을 보였다. 30 Ni에서는 Ni의 입자 크기가 급격히 증가하였고, 이에 따른 촉매 활성의 감소를 확인하였다. 현재 사용 중인 alumina pellet 지지체에서 20 Ni의 촉매함량이 가장 뛰어난 암모니아 개질 활성을 나타내었고, 지지체에 담지될 수 있는 최적 함량임을 확인하였다.
2) 암모니아 개질 공정에 사용되기 위한 촉매 개발에서 Ni을 기반으로 한 촉매의 함량과 공간속도에 대한 영향을 확인하였으나 실질적으로 전환율의 큰 변화를 확인하지 못하였다. 이는 암모니아 개질 공정의 운전온도를 낮추기 위해서는 일부 전환율을 증대를 위한 고활성을 가지는 귀금속 촉매의 첨가가 필수적임을 알 수 있다. 추후 Ni과 alumina pellet 지지체를 기반으로 하여 일부 귀금속 촉매의 첨가를 통한 촉매의 활성을 개선시킬 연구가 필요함을 알 수 있다.
Acknowledgments
본 연구는 ㈜원익머트리얼즈의 “암모니아 개질을 위한 비금속계 촉매 개발” 과제로 수행되었으며, 이에 감사드립니다.
References
-
F. Dawood, M. Anda, and G. M. Shafiullah, “Hydrogen production for energy: an overview”, International Journal of Hydrogen Energy, Vol. 45, No. 7, 2020, pp. 3847-3869.
[https://doi.org/10.1016/j.ijhydene.2019.12.059]

-
Z. N. Anguita, D. G. Gusano, J. Dufour, and D. Lribarren, “Revisiting the role of steam methane reforming with CO2 capture and storage for long-tem hydrogen production”, Science of the Total Environment, Vol. 771, 2021, pp. 145432.
[https://doi.org/10.1016/j.scitotenv.2021.145432]

-
Y. Yan, D. Thanganadar, P. T. Clough, S. Mukherjee, K. Patchigolla, V. Manovic, and E. J. Anthony, “Process simulations of blue hydrogen production by upgraded sorption enhanced steam methane reforming (SE-SMR) processes”, Energy Conversion and Management, Vol. 222, 2020, pp. 113144.
[https://doi.org/10.1016/j.enconman.2020.113144]

-
J. M. Han, J. W. Kim, K. K. Bae, C. S. Park, S. G. Jeong, K. J. Jung, K. S. Kang, and Y. H. Kim, “Intermittent operation induced deactivation mechanism for HER of Ni-Zn-Fe electrode for alkaline electrolysis”, Trans Korean Hydrogen New Energy Soc, Vol. 31, No. 1, 2020, pp. 8-22.
[https://doi.org/10.7316/KHNES.2020.31.1.8]

-
S. G. Lee, Y. Choi, C. W. Park, H. S. Kim, Y. D. Lee, and Y. S. Kim, “A study on ammonia reforming catalyst and reactor design for 10 kW class ammonia-hydrogen dual-fuel engine”, Trans Korean Hydrogen New Energy Soc, Vol. 31, No. 4, 2020, pp. 372-379.
[https://doi.org/10.7316/KHNES.2020.31.4.372]

-
S. F. Yin, B. Q. Xu, X. P. Zhou, and C. T. Au, “A mini-review on ammonia decomposition catalysts for on-site generation of hydrogen for fuel cell applications”, Applied Catalysis A, General, Vol. 277, No. 1-2, 2004, pp. 1-9.
[https://doi.org/10.1016/j.apcata.2004.09.020]

-
J. C. Ganley, F. S. Thomas, E. G. Seebauer, and R. I. Masel, “A priori catalytic activity correlations: the difficult case of hydrogen production from ammonia”, Catalysis Letters, Vol. 96, 2004, pp. 117-122.
[https://doi.org/10.1023/B:CATL.0000030108.50691.d4]

-
A. Boisen, S. Dahl, J. K. Norskov, and C. H. Christensen, “Why the optimal ammonia sythesis catalyst is not the optimal ammonia decomposition catalyst”, Journal of Catalysis, Vol. 230, No. 2, 2005, pp. 309-312.
[https://doi.org/10.1016/j.jcat.2004.12.013]