Mg2NiHx-5wt% CaO 복합재료의 수소화 속도
2021 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
Mg hydride has a relatively high hydrogen storage amount of 7.6wt%, and inexpensive due to abundant resources, but has high reaction temperature and long reaction time because of treble oxidation reactivity and upper activation energy. Their range of applications could be further extended if their hydrogenation kinetics and degradation behavior could be improved. Therefore, the effect of CaO has improved the hydrogenation kinetics and slowed down the degradation. This study focused on investigating whether to improve the hydrogenation kinetics by synthesizing Mg2NiHx-5wt% CaO composites. The Mg2NiHx-5wt% CaO composites have been synthesized by hydrogen induced mechanical alloying. The synthesized composites were characterized by performing X-ray diffraction, Scanning Electron Microscopy, Brunauer–Emmett–Teller, Thermogravimetric, and Sivert's type automatic pressure–composition–temperature analysis. Hydriding kinetics were performed using an automatic PCT measurement system and evaluated over the temperature range of 423 K, 523 K, and 623 K. As a result of calculating the hydrogen adsorption amount through the hydrogenation kinetics curve, it was calculated as about 0.42wt%, 0.91wt%, and 1.15wt%, the highest at 623 K and the lowest at 423 K.
Keywords:
Mg hydride, Hydrogen storage, Hydrogenation, Kinetics, Hydrogen induced mechanical alloying키워드:
마그네슘 수소화물, 수소저장, 수소화, 반응속도, 수소가압형 기계적 합금화1. 서 론
청정에너지 매개체인 수소는 연소 시 오염물을 배출하지 않아 에너지원으로서 환경문제와 자원전쟁을 동시에 해결할 수 있다. 그에 따른 미래 수소경제사회 구현을 목표로 수소의 제조, 저장, 이용 등의 분야에 대한 연구 개발이 진행되고 있다1,2). 그중 수소 저장은 수소경제의 중요한 축으로, 수소저장방식 중 금속수소화물(metal hydride)은 수소가 흡수 공정에 의해 고체 상태로 금속 상에 화학적으로 저장되는 화학 저장 시스템이다. 금속수소화물을 사용하여 고체 상태로 수소를 저장하는 것은 다른 저장 방법들에 비해 많은 장점을 제공한다. 이러한 장점 중 하나는 금속수소화물에서 수소의 높은 저장 밀도로 대량의 수소를 저장할 수 있고 대기 조건에서 수소를 저장할 수 있기 때문에 기계적 수소 저장 방법에 비해 본질적으로 더 안전하다는 점이다. 금속수소화물은 연료 전지 차량의 전형적인 온도 및 압력 조건에서 작동될 수 있고 온도를 높이거나 압력을 낮춤으로서 쉽게 수소를 방출시킬 수 있는 장점이 있다3-5).
또한, 수소를 금속과 직접 반응시키거나 전기화학적 반응에 의해 만들 수 있으며 다양한 화학량론적 비를 갖는 화합물 또는 비화학량론적 비의 화합물로 존재한다. 따라서 가역성이 우수하고, 반응속도도 빨라 반응열이 크다는 특징을 갖고 있다. 그러나 저장된 수소를 금속수소화물부터 다시 얻기 위해서는 금속과 수소간의 화학적 결합을 끊어야 하는데 일반적으로 높은 온도가 필요하다는 단점을 가지고 있다6-8).
대표적인 금속 수소화물로 마그네슘(Mg)은 수소와의 반응속도가 늦지만, 수소저장량 7.6wt%로 매우 큰 값을 갖는 MgH2가 된다. 또한, 자원적으로 풍부하고 경량이며, 비교적 값이 싸다는 장점을 갖고 있다. 그러나 Mg계 수소화물은 열역학적 안정성 및 높은 산화반응성 때문에 고온 및 고압에서 수소화/탈수소화가 이루어진다는 단점이 있다. 따라서 수소의 저장반응을 빠르게 하기 위해 여러 가지 금속을 혼합시켜 검토한 결과, Mg과 Ni을 2:1 비율로 혼합한 합금 Mg2Ni이 수소저장량이 3.6wt%로 MgH2보다 낮지만 수소의 저장, 방출의 반응을 빨리 진행하여 우수한 수소화 특성 결과를 나타내는 것을 선행 연구에서 보고한바 있다9,10). 이 금속수소화물(Mg2NiH4)의 열역학적 안정성을 변화시키기 위해 Mg2Ni 합금의 Mg와 Ni을 Ca, 희토류금속 등 여러 원소로 치환하여 수소의 저장 방출 특성 개선에 대해 연구한 사례도 존재한다11).
이러한 다양한 연구 중에서 기계적 합금화법(mechanical alloying, MA)은 미세구조의 개선, 비표면적 증가를 위해 널리 사용되어 왔다. 아울러 촉매 입자가 더욱 더 균질하게 분포되어 합금을 경제적으로 제조할 수 있다는 장점이 있다. 또한 전이금속을 분쇄하여 제조한 합금의 산화반응성 및 수소화, 탈수소화 반응속도가 개선될 수 있다는 보고가 있다. 따라서 내산화반응성 및 수소화 반응 거동을 수행할 것으로 기대된다12). 본 연구에서는 수소 가압형 기계적 합금화법을 이용하여 Mg2NiHx 수소화물에 알칼리 토금속 산화물인 CaO를 5wt% 첨가하여 Mg2NiHx-5wt% CaO 복합재료를 제조하였으며, CaO 첨가에 따른 수소화 반응속도의 개선 여부를 확인하고자 진행하였다.
2. 실험 방법
Mg (98%, Sigma-Aldrich, St. Louis, MO, USA) granular와 Ni (Sigma-Aldrich, 99.7%) 분말을 1/2인치 STS304 재질의 용기에 장입하였다. 이때 Mg와 Ni 분말의 중량비는 Mg-Ni 이원계 상태도를 참고하여 45:55로 설계하였다. 로터리 펌프를 이용하여 5×10-2Torr까지 진공상태로 만든 후 초기 활성화 공정을 배제할 수 있는 금속수소화물을 얻고자 순도 99.9999%의 수소를 3.0 MPa의 수소 분위기에서 기계적 합금화법인 유성형 볼밀(planetary ball mill, PULVERISETTE-5, FRITSCH Co, Idar-Oberstein, Germany)을 이용하여 200 rpm의 회전속도로 96시간 합금화하였다. 이때, 1/2인치 크롬 강구와 마그네슘 chip의 무게 비(ball to chips weight ratio, BCR)는 선행논문을 참고하여 66:1로 하였다13). 그 후 제조된 분말과 powder 형상의 5wt% CaO (Sigma-Aldrich, 99.9%) 분말을 용기에 장입하여 같은 조건으로 200 rpm의 회전속도로 24시간 합금화하였다. 합금화 공정을 통해 제조된 시료의 야금학적 분석을 위해 X선 회절분석기(X-ray diffractometer [XRD], D8 Advance, Bruker, Billerica, MA, USA)를 사용하여 시료의 결정구조와 상을 분석하였다. Taget은 1.5405 Å의 Cu Kα를 사용하였고, 주사속도는 5 deg/min였으며 주사범위는 20-80°였다. 합금화 시간에 따른 시료의 표면형상과 입자 크기를 관찰하기 위해 전계방사형 주사전자현미경(scanning electron microscopy [SEM], Quanta-400, FEI Company, Hillsboro, OR, USA)을 사용하여 관찰하였으며, 비표면적 측정 장비(brunauer-emmett-teller surface analysis [BET], Micromeritics-3-Flex, Micromeritics, Norcross, GA, USA)를 이용하여 수소 확산에 많은 영향을 주는 입자 비표면적을 측정하였다. 또한, 수소가압 분위기에서 합성한 시료의 탈수소화 개시온도를 확인하기 위해 열분석(thermogravimetric analysis [TGA], NETZSCH STA490PC, RT-1673K)을 실시하였다. 불활성 기체인 Ar을 50 mL/min 흘려주면서 산소와의 반응을 억제 하였으며, 1 K, 5 K, 10 K/min로 승온 속도를 다르게 하여 측정하였다. 그 후 탈수소화 온도를 통해 arrhenius plot을 그려 탈수소화 활성화 에너지를 측정하였다. 그리고 수소화 반응속도를 측정하기 위해 Sivert’s형 자동화 pressure-composition-temperature 장치를 사용하였고, 3.0 MPa의 일정한 수소압을 가하여 각각 1시간 동안 423 K, 523 K, 623 K의 온도범위에서 수소 흡착반응속도를 평가하였다.
3. 결과 및 고찰
Fig. 1은 합금화된 Mg2NiHx-5wt% CaO 복합재료의 XRD 분석 결과이다. 분석 결과, peak 모두 뚜렷하게 CaO와 마그네슘 수소화물을 나타냈으며, Mg2NiH4, Mg2NiH, CaO, MgO를 ICDD를 통해 확인하였다. Mg2NiHx는 단사정(monoclinic) 구조, Mg2NiH와 CaO 및 MgO와 CaO는 입방(cubic) 구조로 나타났다. 25-40°에서 비교적 회절 강도가 크고 좁은 면적의 peak가 나타났다14). 이후에 회절 패턴이 넓어지는 형상은 밀링 중에 입자 크기 감소 및 변형 축적으로 인한 것으로 추정된다15). 또한, 회절 peak의 면적이 넓게 나타남으로써 시료의 결정 구조가 나노화 혹은 비정질화 되어있는 것으로 판단되었다. 이는 기계적 합금화법을 통한 입자 크기 감소로 비표면적이 증가하여 수소 확산거리가 짧아져 수소화 특성이 개선될 것으로 나타난다16,17).
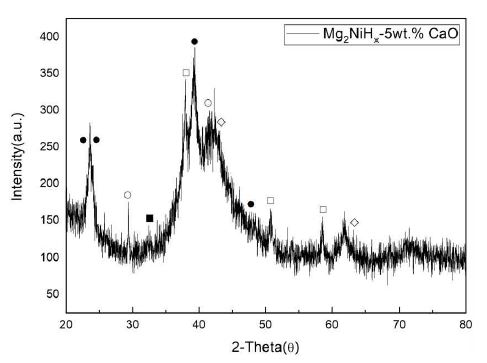
XRD patterns of Mg2NiHx-5wt% CaO composites (Mg2NiH4 (MonoClinic) : ●, MgNiH (Cubic) : ○, CaO (Cubic) : □, MgO (Cubic) : ◇)
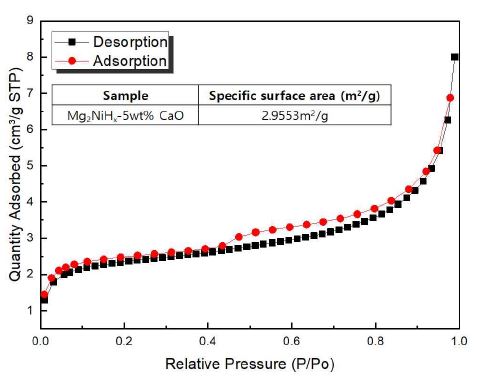
Fig. 2는 Mg2NiHx-5wt% CaO 복합재료의 질소 흡착 거동을 나타낸 비표면적 결과이다. 그 결과, Mg2NiHx-5wt% CaO의 비표면적 값은 2.9553 m2/g으로 계산되었다. 분쇄 효과로 인해 기계적 합금화 공정의 일반적 장점인 비표면적의 급격한 증가를 예상하였지만 Mg2NiHx에 CaO의 첨가함에 따라 입자 미세화로 인한 응집현상과 입자 크기가 더 커지게 되어 비표면적이 줄어든 것으로 나타난다18). 나노화된 입자의 비표면적 증대는 수소의 흡착과 탈착에 용이하지만 합금화 시간이 증가되어 입자의 크기가 감소하게 되면 나노 및 비정질상의 생성이 증가하여 수소저장량이 감소할 것으로 판단된다18).
Fig. 3은 Mg2NiHx-5wt% CaO 복합재료의 SEM 표면형상 관찰사진이다. 모두 1-10 µm의 크기를 갖고 있는 나노 크기의 비정질상의 입자들이 관찰되었으며 분쇄과정으로 인하여 입자가 뭉치는 경향을 확인하였다. 기계적 합금화 공정의 영향으로 입자 크기가 감소하고, 이로 인해 수소화 반응 속도를 향상시켜주는 비표면적과 결함의 증대를 기대할 수 있다19,20). 또한, 입자 크기가 작아질수록 수소의 확산길이가 짧아지고, 반응하는 표면적은 커지기 때문에 수소의 흡착과 탈착에 용이하나 내구성 등에는 다소 문제가 있을 것으로 보고된바 있다21).

SEM image of (a) Mg2NiHx-5wt% CaO (×2,500), (b) Mg2NiHx-5wt% CaO (×5,000), (c) Mg2NiHx-5wt% CaO (×10,000), and mapping image of (d) Mg2NiHx-5wt% CaO
Fig. 4(a)는 Mg2NiHx-5wt% CaO 복합재료의 TG 분석 결과를 나타낸 것이며, 탈수소화 개시 온도를 알 수 있었다. 1 K에서 486 K, 5 K에서 507 K, 10 K에서는 524 K에서 탈수소화가 진행되었으며, 이는 승온 온도가 증가함에 따라 탈수소화 온도가 증가함을 보여준다. Fig. 4(b)는 탈수소화 반응을 Van't Hoff plot 식을 전개하여 열역학적 특성을 규명한 결과이다. 즉, 486-524 K의 영역에서 활성화 에너지가 57.012±0.310 J/g 값으로 계산되었다. 이에 따라 Mg2NiHx의 탈수소화가 약 523 K에서 나타났다는 선행 연구의 결과들과 비교하였을 때 향상된 결과로 볼 수 있다. 이와 같이 탈수소화 개시 온도가 낮아진 것은 M.A 합성 공정으로 얻은 나노구조화 결정구조에서 수소화 반응속도가 향상되었으며,22) Ca에 의한 방출 속도 향상과 열 안정성 향상에 관한 선행 연구23)를 참고하였을 때 5wt% CaO 첨가에 의한 것으로 판단된다.
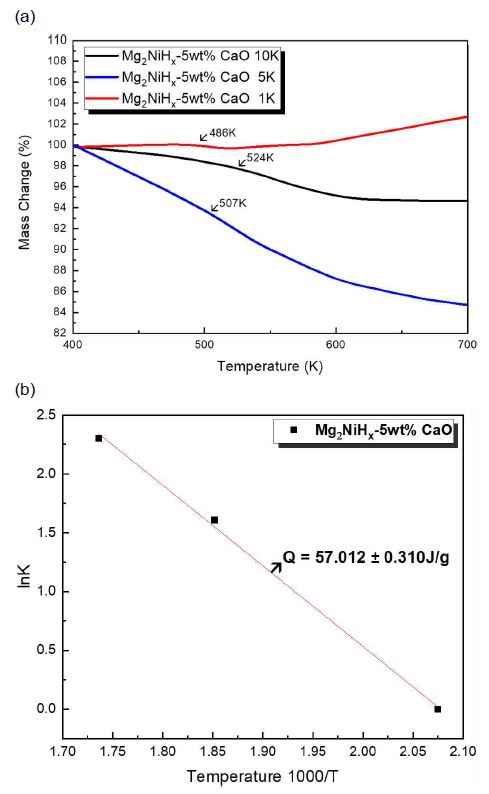
TGA results of (a) Mg2NiHx-5wt% CaO composites measured at 1 K, 5 K, 10 K heating temperature. The Arrows indicates the dehydriding temperature. (b) van’t Hoff plots of dehydriding reactions after TGA results of Mg2NiHx-5wt% CaO
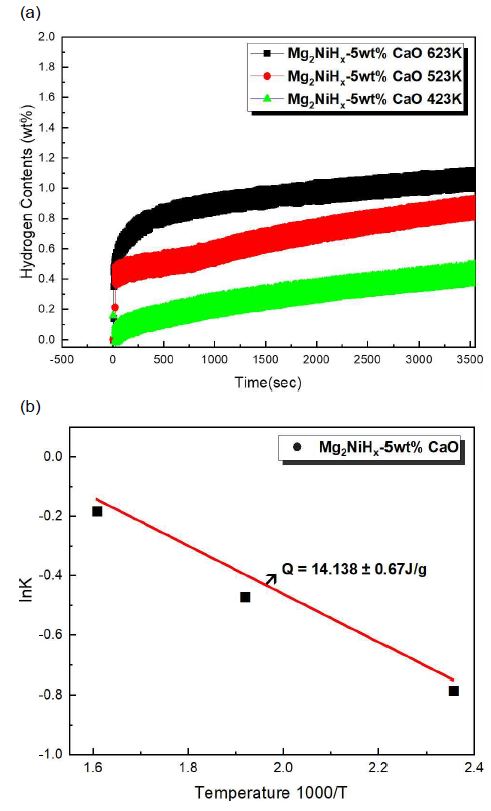
Fig. 5(a)는 Mg2NiHx-5wt% CaO 복합재료의 온도변화에 따른 수소화 반응속도 결과값이다. 423 K, 523 K, 623 K 온도별로 실험이 진행되었고, 3 MPa 수소 분위기에서 1시간 동안 노출하였을 때 시간에 따른 수소 흡착량을 보여주고 있다. 선행 연구에 따르면 일반적인 상업용 물질은 423 K 이하에서는 수소 흡수가 없으며 573 K에서도 최대 저장 용량의 절반에 도달하는 데 3,000초가 걸린다고 보고되었다24). 수소 흡수는 623 K에서 가장 높고 423 K에서 가장 낮게 나타났으며, 수소화 반응 곡선을 통해 유효수소 저장량을 계산해본 결과 423 K, 523 K, 623 K에서 각각 약 0.42wt%, 0.91wt%, 1.15wt%로 계산되었다. Fig. 5(b)는 이를 통해 arrhenius plot을 도식한 결과이고, van’t Hoff 방정식을 통해 계산된 활성화 에너지 값은 14.138±0.67 J/g로 계산되었다. 그 결과, Mg2NiHx보다 최대 수소저장량이 상대적으로 낮은데, 이는 CaO의 첨가로 인해 주 저장체인 Mg의 함량이 줄어드는 것과 더불어 긴 시간의 M.A로 인한 결정립의 나노구조화 등으로 수소저장량은 감소한다는 다른 연구자들의 보고와 일치하는 것으로 나타났다25,26).
4. 결 론
수소 가압형 기계적 합금화법을 이용하여 Mg2NiHx-5wt% CaO 복합재료를 제조하였으며 423 K, 523 K, 623 K의 온도범위와 3.0 MPa의 수소압에서 수소화 반응속도를 살펴본 결과 다음과 같은 결과를 도출할 수 있다.
1) Mg2NiHx-5wt% CaO 복합재료 XRD 분석 결과, peak 모두 뚜렷하게 CaO와 마그네슘 수소화물을 나타냈다. 그리고 Milling 공정에 의한 입자 크기 감소로 X-ray 회절강도가 줄어들고 회절 peak의 면적이 넓게 나타나 시료의 결정구조가 나노화 혹은 비정질화 되어있는 것으로 판단된다. 이로 인해 비표면적이 증가하여 수소 확산거리가 짧아져 수소화 특성이 개선될 것으로 나타난다.
2) SEM 및 BET 분석 결과, 모두 1-10 μm의 크기를 갖고 있는 나노 크기의 비정질상의 입자들이 관찰되었으며, 비표면적 값은 2.9553 m2/g으로 계산되었다. 분쇄 효과로 인한 기계적 합금화 공정의 일반적 장점인 비표면적의 급격한 증가를 예상하였지만 Mg2NiHx에 CaO를 첨가함에 따라 입자 미세화로 인한 응집현상과 입자 크기가 더 커지게 되어 비표면적이 줄어든 것으로 나타난다.
3) 열분석을 통하여 Mg2NiHx-5wt% CaO 복합재료의 탈수소화 개시 온도는 약 486-524 K로 나타났다. 활성화 에너지 값은 57.012±0.310 J/g 값으로 계산되었으며 탈수소화 개시 온도가 낮아진 것은 CaO가 촉매 역할을 하여 탈수소화 반응에 기여한 것으로 나타났다.
4) 수소흡착 반응속도를 측정한 결과 423 K, 523 K, 623 K에서 각각 약 0.42, 0.91, 1.15wt%로 계산되었다. 이때 활성화 에너지 값은 14.138±0.67 J/g로 계산되었다. 그 결과, CaO의 첨가로 인해 수소화 반응속도는 빨라졌지만, 주 저장체인 Mg의 함량이 줄어 Mg2NiHx보다 최대 수소저장량이 상대적으로 낮았다. 따라서 상용화 재료로 사용하기 위해서는 첨가되는 CaO 양의 고효율의 질량비를 탐색하거나, 금속간화합물 또는 전이금속 등의 촉매를 이용한 추가 개선 연구를 모색할 필요가 있다.
Acknowledgments
본 연구는 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구(2019R1F1A1041405)와 교육부에서 지원하는 한국기초과학연구원 보조금(2019R1A6C1010047)과 중소벤처기업부가 부여한 재원(S3045542)에 의해 수행되었으며, 이에 감사드립니다.
References
-
C. A. Grimes, O. K. Varghese, and S. Ranjan, “Hydrogen generation by water splitting”, Light, Water, Hydrogen, Springer, Germany, 2008, pp. 35-113.
[https://doi.org/10.1007/978-0-387-68238-9_2]

-
D. Y. Goswami and F. Kreith “Energy conversion”, CRC Press, 2007, pp. 2.1-2.21.
[https://doi.org/10.1201/9781420044324]

-
H. T. Hwang and A. Varma, “Hydrogen storage for fuel cell vehicles”, Current Opinion in Chemical Engineering, Vol. 5, 2014, pp. 42-48.
[https://doi.org/10.1016/j.coche.2014.04.004]

-
C. Z. Wu, P. Wang, X. Yao, C. Liu, D. M, Chen, G. Q. Lu, and H. M. Cheng, “Hydrogen storage properties of MgH2/SWNT composite prepared by ball milling”, J. Alloys and Compounds, Vol. 420, No. 1-2, 2006, pp. 278-282.
[https://doi.org/10.1016/j.jallcom.2005.10.028]

-
C. Milanese, A. Girela, G. Bruni, P. Cofrancesco, V. Berbenni, P. Mateazi, and A. Marini, “Mg–Ni–Cu mixtures for hydrogen storage: a kinetic study”, Intermetalics Vol. 18, No. 2, 2010, pp. 203-211.
[https://doi.org/10.1016/j.intermet.2009.07.012]

-
J. F. Fernández and C. R. Sánchez, “Rate determining step in the absorption and desorption of hydrogen by magnesium”, J. Alloys Compd, Vol. 340, No. 1-2, 2002, pp. 189-198.
[https://doi.org/10.1016/S0925-8388(02)00120-2]

-
N. Cui, P. He, and J. L. Luo, “Magnesium-based hydrogen storage materials modified by mechanical alloying”, Acta Mater., Vol. 47, No. 14, 1999, pp. 3737-3743.
[https://doi.org/10.1016/S1359-6454(99)00249-9]

-
T. S. Park and T. H. Lee, “The hydrogen binding property study by density functional theory for Zr, V, Fe and Al”, Trans Korean Hydrogen New Energy Soc, Vol. 25, No. 6, 2014, pp. 602-608.
[https://doi.org/10.7316/KHNES.2014.25.6.602]

-
C. Zhi, T. Chao, P. Hui, and Y. Huabin, “Rehydrogenation performance of an MgH2–Nb2O5 system modified by heptane and acetone”, Int. J. Hydrogen Energy, Vol. 35, No. 15, 2010, pp. 8289-8294.
[https://doi.org/10.1016/j.ijhydene.2009.12.016]

-
W. N. Yang, C. X. Shang, and Z. X. Guo, “Site density effect of Ni particles on hydrogen desorption of MgH2”, Int. J. Hydrogen Energy, Vol. 35, No. 10, 2010, pp. 4534-4542.
[https://doi.org/10.1016/j.ijhydene.2010.02.047]

- S. Y. Jang, K. M. Kang, O. Hayato, and K. Shigeharu, “Mg-based hydrogen storage alloy”, The Industry and Technology of Gas, Vol. 6, No. 1, 2003, pp. 40-47. Retrieved from https://www.dbpia.co.kr/journal/articleDetail?nodeId=NODE0205908, .
-
A. D. Rud and A. M. Lakhnik, “Effect of carbon allotropes on the structure and hydrogen sorption during reactive ball-milling of Mg–C powder mixtures”, Int. J. Hydrogen Energy, Vol. 37, No. 5, 2012, pp. 4179-4187.
[https://doi.org/10.1016/j.ijhydene.2011.11.123]

- T. W. Hong, J. W. Lim, S. K. Kim, Y. J. Kim, and H. S. Park, “Effect of atmospheric hydrogen pressure on Mg2NiHx synthesis”, Trans Korean Hydrogen New Energy Soc, Vol. 10, No. 1, 1999, pp. 27-40. Retrieved from https://scienceon.kisti.re.kr/commons/util/originalView.do?cn=JAKO199921040976766&oCn=JAKO199921040976766&dbt=JAKO&journal=NJOU00291568, .
-
K. I. Kim and T. W. Hong, “Evaluations of hydrogen properties on MgHx-Nb2O5 composite by mechanical alloying”, Materials Science Forum, Vol. 620-622, 2009, pp. 9-12.
[https://doi.org/10.4028/www.scientific.net/MSF.620-622.9]

-
C. J. Koroneos and E. A. Nanaki, “Life cycle environmental impact assessment of a solar water heater”, J. Cleaner Production, Vol. 37, 2012, pp. 154-161.
[https://doi.org/10.1016/j.jclepro.2012.07.001]

-
Z. G. Huang, Z. P. Guo, A. Calka, D. Wexler, C. Lukey, and H. K. Liu, “Effects of iron oxide (Fe2O3, Fe3O4) on hydrogen storage properties of Mg-based composites”, J. Alloy. Comp, Vol. 422, No. 1-2, 2006, pp. 299-304.
[https://doi.org/10.1016/j.jallcom.2005.11.074]

-
M. Dirnheim, S. Doppiu, G. Barkhordarian, U. Boesenberg, T. Klassen, O. Gutflesich, and R. Bormann, “Hydrogen storage in magnesium-based hydrides and hydride composites”, Scripta Mater, Vol. 56, No. 10, 2007, pp.841-846.
[https://doi.org/10.1016/j.scriptamat.2007.01.003]

-
S. K. Sahoo, S. Parveen, and J. J Panda, “The present and future of nanotechnology in human health care”, Nanomedicine: Nanotechnology, Biology and Medicine, Vol. 3, No. 1, 2007, pp. 20-31.
[https://doi.org/10.1016/j.nano.2006.11.008]

- M. W, Jung, J. H. Park, K. W. Cho, K. I. Kim, J. H. Chol, S. H. Kim, and T. W. Hong, “Hydrogenation properties of MgHx-V2O5 composites by hydrogen induced mechanical alloying”, Trans Korean Hydrogen New Energy Soc, Vol. 21, No. 1, 2010, pp. 58-63.
-
J. K. Lee and S. K. Kim, “Effect of CaO addition on the ignition resistance of Mg-Al alloys”, Materials Transactions, Vol. 52, No. 7, 2011, pp. 1483-1488.
[https://doi.org/10.2320/matertrans.M2010397]

-
X. Yao, C. Wu, A. Du, G. Q, Lu, H. Cheng, S. C. Smith, J. Zou, and Y. He, “Mg-based nanocomposites with high capacity and fast kinetics for hydrogen storage”, J. Phys. Chem. B, Vol. 110, No. 24, 2006, pp. 11697-11703.
[https://doi.org/10.1021/jp057526w]

-
M. Y. Song, E. I. Ivanov, B. Darriet, M. Pezat, and P. Hagenmuiler, “Hydriding properties of a mechanically alloyed mixture with a composition Mg2Ni”, Int. J. Hydrogen Energy, Vol. 10, No. 3, 1985, pp. 169-178.
[https://doi.org/10.1016/0360-3199(85)90024-2]

-
L. Zaluski, A. Zaluska, P. Tessier, J. O. Ström-Olsen, and R. Schulz, “Catalytic effect of Pd on hydrogen absorption in mechanically alloyed Mg2Ni, LaNi5 and FeTi”, J. Alloys Compd, Vol. 217, No. 2, 1995, pp. 295-300.
[https://doi.org/10.1016/0925-8388(94)01358-6]

-
G. Liang, J. Huot, S. Boily, A. Van. Neste, and R. Schulz, “Hydrogen storage properties of the mechanically milled MgH2–V nanocomposite”, J. Alloys Compd, Vol. 291, No. 1-2, 1999, pp. 295-299.
[https://doi.org/10.1016/S0925-8388(99)00268-6]

-
S. Orimo and H. Fujii, “Hydriding properties of the Mg2Ni-H system synthesized by reactive mechanical grinding”, J. Alloys Compd, Vol. 232, No. 1-2, 1996, pp. L16-L19.
[https://doi.org/10.1016/0925-8388(95)02079-9]

-
S. Orimo, H. Fujii, K. Ikeda, Y. Fujikawa, and Y. Kitano, “Hydriding properties of a nano-/amorphous-structured Mg–Ni–H system”, J. Alloys Compd, Vol. 253-254, 1997, pp. 94-97.
[https://doi.org/10.1016/S0925-8388(96)02995-7]