컴팩트 개질기용 수성가스전이 반응을 위한 Cu-CeO2 촉매에 대한 Nb2O5의 영향
2020 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
The water-gas shift reaction for the compact reformer was carried out at a gas hourly space velocity of 72,152 h-1 over the Cu-Nb-CeO2 catalysts prepared by co-precipitation method. In order to investigate the effect of Nb2O5 promotion over a Cu-CeO2 catalyst, the Nb2O5 loading amount was systematically changed from 0 to 5 wt.%. Among the prepared catalysts, the Cu-Nb-CeO2 (1%) catalyst showed the highest catalytic activity (CO conversion=61% at 400℃) as well as 100% CO2 selectivity. The high activity and stability of Cu-Nb-CeO2 (1%) catalyst are correlated to high Brunauer–Emmett–Teller surface area, small metallic Cu crystallite size, and enhanced redox property.
Keywords:
Compact reformer, Water gas shift reaction, Nb2O5 loading amount, Redox property키워드:
컴팩트 개질기, 수성가스전이반응, Nb2O5 담지량, 산화·환원능력1. 서 론
최근 들어 지구온난화의 가속화에 따른 기후변화문제와 화석연료 고갈로 인한 에너지안보 문제가 날로 심각해짐에 따라 글로벌 위기의식이 높아지고 신·재생에너지에 대한 관심이 급격히 증가하고 있다1,2). 신에너지 중 하나인 수소(H2)는 연소 시 온실가스인 CO2 및 공해물질을 배출하지 않고 오직 물만을 배출하는 청정에너지로 각광받고 있다1,2). 현재 대용량 규모의 수소생산 기술은 상업화 단계에 있으나, 연료전지를 기반으로 한 낮은 경제성과 제한적인 반응온도로 인해 효율적인 수소공급 인프라 구축을 위한 중소 규모의 고순도 수소생산 기술의 개발이 진행되고 있다3). 중소 규모의 수소생산 기술 개발을 위해서는 시스템의 컴팩트화가 핵심적으로 요구되고 있으나, 시스템 컴팩트화에 따른 열효율 저하 문제로 인해 기술 개발에 어려움을 겪고 있다4). 상기 문제를 해결하기 위해서 국제에너지기구(International Energy Agency, IEA)에서 수소 실행프로그램을 통해 중소형 수소생산시스템 개발을 진행하고 있으며, 통합형 수소생산 엔지니어링 기술이 제시되고 있다4).
수소생산시스템은 탄화수소 연료의 개질을 통하여 수소를 생산하는 것이 일반적이며 천연가스(CH4) 수증기 개질을 통한 수소생산이 전체 생산량의 약 49%를 차지한다5). 그러나 천연가스 수증기 개질 공정에서는 일산화탄소(CO)가 부가적으로 생산되며 연료 전지에 직접 적용할 경우, 연료전지 내 촉매 및 전극을 피독시켜 연료전지의 효율을 급격히 감소시킬 수 있다6,7). 따라서 개질 공정 이후 생산된 합성가스(H2+CO) 내 CO를 수성가스전이반응(water gas shift, WGS; CO+H2O ↔ CO2+H2; ΔH=-41.2 kJ/mol)을 통해 허용 가능한 수준으로 낮추어야 한다8,9).
WGS 반응 공정은 열역학적 평형을 고려하여 고온전이반응(high temperature shift, HTS; 350-500℃)과 저온전이반응(low temperature shift, LTS; 200-300℃)으로 구성되어 있으며, 각각 Fe2O3-Cr2O3 촉매와 Cu-Zn-Al2O3 촉매가 사용되고 있다1,10). 그러나 상업용으로 사용되고 있는 WGS 촉매는 반응온도 영역이 제한적이고, 공정 조건 변화에 민감해서 컴팩트 개질기에 적용 시 쉽게 비활성화 되는 문제점이 있다11).
기술 제한요소를 극복하기 위해 귀금속(Pt, Pd, Au)을 적용한 컴팩트 개질기 맞춤형 WGS 촉매에 대한 연구가 다양하게 진행되었다12-16). 그러나 귀금속을 이용한 촉매는 높은 비용으로 인한 낮은 경제성과 반응온도가 제한적이어서 비귀금속을 이용하면서 산소저장능력(oxygen storage capacity, OSC)이나 산화·환원능력(redox property)을 높여 촉매의 활성을 증진시키는 연구가 활발히 진행되고 있다2,8,11,17).
최근 LTS에서 Cu계 촉매는 우수한 CO 산화능력 및 H2O 해리능력으로 인해 많은 연구가 수행되었다18-22). 다양한 금속 산화물(CeO2, ZrO2, MgO 및 Al2O3)에 담지된 Cu 촉매의 성능을 비교하였다18,19). 다양한 금속 산화물로 제조된 Cu계 촉매 중 Cu-CeO2 촉매는 높은 표면적과 강한 산화·환원능력으로 인해 우수한 활성을 나타내는 것으로 보고되었다19,20). 또한 제조방법을 달리하여 Cu-CeO2 촉매 성능을 비교한 결과, 공침법(co-precipitation method)으로 제조된 Cu-CeO2 촉매가 높은 BET 표면적, 작은 결정크기 그리고 우수한 산화·환원능력으로 인해 36,201 h-1의 공간속도에서 60%의 전환율로 20시간 이상 유지하는 결과를 나타내었다21). 그러나 Cu-CeO2 촉매는 귀금속을 이용한 촉매에 비해 여전히 낮은 활성과 안정성을 나타내고 있기 때문에 성능 개선을 위한 연구가 필요한 실정이다.
Nb2O5는 우수한 화학적 안정성 및 열적 안정성으로 인해 다양한 공정에서 사용되는 촉매의 성능을 개선시키기 위한 조촉매로 사용되고 있다23-25). Ramírez-Cabrera 등25)은 CeO2와 Nb2O5가 담지된 Nb-CeO2 촉매의 메탄에 대한 반응성에 대해 연구하였다. 그 결과 Nb2O5가 CeO2의 산화·환원능력을 증가시킨다는 것을 입증하였다25).
본 연구에서는 Nb2O5를 도입한 Cu-CeO2 촉매를 제조하고 Nb2O5 담지량을 0-5 wt.%로 변화시켜 72,152 h-1의 높은 기체공간속도(gas hourly space velocity, GHSV)에서 LTS 반응에 대한 성능을 비교 검토하였다. Cu-Nb-CeO2 촉매에 대한 Nb2O5의 영향 및 담지량에 따른 성능을 비교 분석하기 위해 BET, XRD 그리고 H2-TPR을 통해 촉매의 물리화학적 특성을 분석하였으며, 고정층 석영반응기를 이용하여 LTS 반응에서의 촉매의 활성 및 안정성을 평가하고 특성분석 간의 상관관계를 해석하였다.
2. 연구방법
2.1 Catalyst preparation
Nb2O5의 영향을 평가하기 위하여 Cu의 담지량을 25 wt.%로 고정하여 Cu-CeO2 및 Cu-Nb-CeO2 촉매를 공침법으로 제조하였으며, Nb2O5 담지량에 따른 성능을 비교하기 위해 Nb2O5의 담지량을 각각 1, 2, 3, 5 wt.%로 촉매를 제조하였다. Cu-Nb-CeO2 촉매 제조를 위하여 copper nitrate (99%, Aldrich, St. Louis, USA), niobium chloride (99%, Aldrich) 그리고 cerium nitrate (99%, Aldrich)를 전구체로 사용하였다. 화학 양론적으로 정량된 Cu 및 Ce 전구체를 증류수에 녹이고 Nb 전구체는 에탄올에 용해시켰다. 이 용액에 침전제인 15% KOH 용액을 넣어 pH 10으로 조절한 후 일정한 교반과 함께 80℃에서 72시간 숙성시켰다. 남아있는 K+이온을 제거하기 위해 수차례 증류수로 세척하였다. 준비된 침전물은 110oC에서 건조한 후 400℃에서 6시간 동안 소성하여 준비하였다. Nb2O5의 담지량에 따라 Cu-Nb-CeO2 (1%), Cu-Nb-CeO2 (2%), Cu-Nb-CeO2 (3%) 그리고 Cu-Nb-CeO2 (5%)라고 표기하였다.
2.2 Characterization
본 촉매의 특성분석은 BET, XRD 그리고 TPR을 수행하였다. BET 표면적은 ASAP 2010 (Micromeritics, Norcross, USA) 장비를 사용하여 -196oC에서 질소흡착정도를 측정하여 분석하였다. 촉매의 결정크기를 파악하기 위해 X-ray diffraction (XRD) 분석을 수행하였다. XRD 분석은 400℃에서 1시간 동안 5 vol.% H2/N2에서 활성화시킨 이후 X-ray diffractometer (X’PERT-PRO, Panalytical, Westborough, USA) 장치를 사용하여 Cu-Kα radiation를 40 kV, 30 mA로 수행하였다. 금속 Cu의 결정크기는 Debye-Scherrer's equation을 이용해 계산하였다. 촉매의 환원 특성을 비교하기 위하여 temperature programmed reduction (TPR) 분석을 수행하였다. TPR 분석은 Autochem 2920 (Micromeritics, Norcross, USA) 장치를 사용하여 10% H2/Ar 분위기에서 승온율 10℃/min로 상온에서 250℃까지 측정하였다.
2.3 Catalytic reaction
촉매 반응실험은 온도범위 240-400℃에서 고정층 석영반응기를 이용하여 수행하였다. 촉매는 30 mg을 주입하였고 열전대를 촉매층에 설치하여 실제 반응 온도를 측정할 수 있도록 하였다. 각각의 촉매 반응 전에, 촉매를 5% H2/N2 분위기로 실온에서 400℃까지 3.3℃/min로 승온 후 1시간 유지하여 환원시켰다. 이후 온도를 240℃로 낮추고 혼합가스를 흘려주면서 WGS 반응을 수행하였다. 혼합가스의 성분은 CO: 9.00%, CO2: 9.99%, CH4: 1.00%, H2: 60.00% 그리고 N2: 20.01%이다. Steam reforming methane (SRM)에서 탄소침적을 방지하기 위해 H2O/CH4 비가 3.0이기 때문에 본 반응에서는 H2O/(CH4+CO+CO2) 비를 2.0으로 고정하였다26). GHSV는 72,152 h-1에서 수행하였다. LTS 반응을 위한 H2O는 syringe pump (KD scientific 100, KD scientific, Holliston, USA)를 이용하여 180℃로 예열된 스테인리스 관을 통과하여 수증기 형태로 반응기에 공급되었다. 반응 후 나온 가스는 Chiller (JSRC-22C, JS Research Inc., Gonggju, Korea)를 거쳐 냉각시키고, moisture trap을 통과시켜 가스 내 잔류 수분을 제거시킨 다음, micro-gas chromatograph (Agilent 490 Micro GC, Agilent, Santa Clara, USA)를 사용하여 온라인으로 분석하였다. LTS 반응에 있어 CO 전환율과 CO2 및 CH4 선택도는 다음 식들을 이용하여 계산하였다.
3. 결과 및 고찰
3.1 Catalyst characterization
Table 1에는 환원된 Cu-CeO2 및 Cu-Nb-CeO2 촉매의 특성분석 결과를 나타내었다. Cu-Nb-CeO2 (1%)가 가장 높은 BET 표면적(172.30 m2/g)을 보였으며 Cu-Nb-CeO2 (5%) 촉매는 가장 낮은 BET 표면적(159.18 m2/g)을 나타내었다. 1 wt.% Nb2O5가 담지된 Cu-CeO2 촉매만이 Cu-CeO2 촉매보다 높은 BET 표면적을 갖는다. 이 결과는 소량의 Nb2O5가 Cu-CeO2 촉매의 BET 표면적을 증가시키는 것을 보여준다24,27). Nb2O5의 양이 증가함에 따라 BET 표면적이 감소함을 알 수 있다. CeO2에 과량의 Nb2O5를 첨가하면 Cu와 CeO2 사이의 강한 상호 작용으로 인해 Cu의 응집을 일으킬 수 있다24). 결과적으로 Cu-CeO2 및 Cu-Nb-CeO2 촉매의 BET 표면적은 다음과 같은 순서로 감소하였다: Cu-Nb-CeO2 (1%)- 172.30 m2/g > Cu-CeO2- 169.45 m2/g > Cu-Nb-CeO2 (2%)- 165.76 m2/g > Cu-Nb-CeO2 (3%)- 161.60 m2/g > Cu-Nb-CeO2 (5%)- 159.18 m2/g. 또한, 기공부피의 변화는 BET 표면적과 동일한 경향을 따른다. Cu-Nb-CeO2 (1%) 촉매만 Cu-CeO2 촉매보다 더 높은 기공부피(0.49 cm3/g)를 가지고, 다른 Cu-Nb-CeO2 촉매는 더 작은 기공부피 값을 나타낸다.
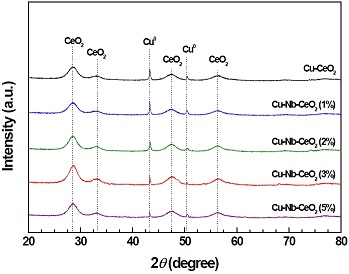
Fig. 1에는 제조된 촉매의 XRD 분석 결과를 나타내었다. 28.6o (111), 33.3o (200), 47.5o (220) 그리고 56.3o (311)에서의 결정 피크는 입방체 구조(cubic phase)인 CeO2 (JCPDS # 34-0394)에 해당된다. 또한 제조된 모든 촉매는 43.3o (111) 및 50.4o (200)에서 LTS 반응에서 활성 종인 금속 Cu 결정 피크(JCPDS # 04-0836)를 나타내었다. Nb2O5의 결정 피크는 적은 양의 담지량으로 인해 식별되지 않았다. 금속 Cu의 결정 크기를 비교하기 위해 Debye-Scherrer's equation을 사용하였고, 결과를 Table 1에 나타내었다. 제조된 촉매 중 Cu-Nb-CeO2 (1%)가 가장 작은 결정크기 (12.8 nm)를 나타내었다. 반면, Cu-Nb-CeO2 (5%)는 19.7 nm로 가장 큰 결정크기를 가졌으며, 다음과 같은 순서로 결정크기가 증가하였다: Cu-Nb-CeO2 (1%) < Ce-CeO2 < Cu-Nb-CeO2 (2%) < Cu-Nb-CeO2 (3%) < Cu-Nb-CeO2 (5%). 이 결과는 제조된 Cu-Nb-CeO2 촉매 사이에서 Nb2O5의 담지량이 증가함에 따라 과잉의 Nb2O5가 Cu 및 CeO2 결정 표면을 덮고 Cu의 응집을 발생시키기 때문이다.
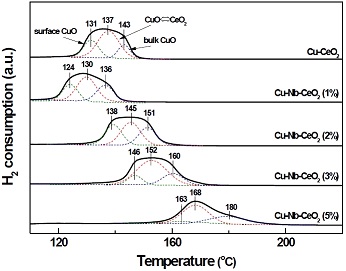
Fig. 2는 Cu-CeO2와 Cu-Nb-CeO2 촉매의 TPR 분석결과를 나타내었다. 제조된 모든 촉매는 100oC에서 200oC 사이에서 넓은 환원 피크가 나타났으며, 3개의 피크로 구분될 수 있다. 첫 번째 피크는 표면에 분산된 CuO의 환원에 해당된다. 두 번째 피크는 CeO2와 상호작용하는 CuO의 환원 피크이다. 마지막으로 세 번째 피크는 bulk CuO의 환원에 기인한 것이다. Cu-Nb-CeO2 (1%) 촉매에 대한 모든 환원 피크는 Cu-CeO2 촉매에 비해 더 낮은 온도로 이동하였다. 결과적으로 CeO2에 적절한 양의 Nb2O5가 담지된 경우, Ce4+를 Nb5+로 대체하고 Cu2+를 함입함으로써 전자 이동 능력을 향상시킬 수 있으며, 이는 촉매 환원성을 향상시킬 수 있다23,25). 그러나 Cu-CeO2 촉매에 1 wt.% 이상의 Nb2O5가 담지되는 경우, 산화·환원반응이 억제되는 것을 확인할 수 있다. 이것은 과잉의 Nb2O5가 Cu 및 CeO2 결정 표면에서 산화·환원반응을 방해하기 때문이다26).
3.2 Catalytic performance
Cu-Nb-CeO2 촉매에 대한 Nb2O5의 영향 및 담지량에 따른 성능을 파악하기 위해, 제조된 촉매를 GHSV 72,152 h-1에서 LTS 반응을 수행하였다. Fig. 3은 Cu-CeO2 및 다양한 Nb2O5 담지량으로 제조된 Cu-Nb-CeO2 촉매의 온도에 따른 CO 전환율을 나타내었다. 반응온도 240oC에서는 Nb2O5 담지량이 0 wt.%에서 5 wt.%로 증가하였으나, CO 전환율은 10-12%로 거의 무시할만한 차이가 나타났다. 280oC에서는 제조된 촉매 중에 Cu-Nb-CeO2 (1%) 촉매가 가장 높은 CO 전환율을 나타내었다. 400oC의 반응온도에서도, Cu-Nb-CeO2 (1%) 촉매는 72,152 h-1의 GHSV에서 가장 높은 CO 전환율로 61%까지 도달하였다. 240-400℃의 반응 온도 범위 내에서, 제조된 촉매의 CO 전환율은 Cu-Nb-CeO2 (1%) > Cu-CeO2 > Cu-Nb-CeO2 (2%) > Cu-Nb-CeO2 (3%) > Cu-Nb-CeO2 (5%)의 순서대로 낮게 나타났다. 1 wt.%의 Nb2O5가 담지된 Cu-Nb-CeO2 촉매는 담지되지 않은 Cu-CeO2 촉매보다 높은 CO 전환율을 나타내지만, 1 wt.% 이상의 Nb2O5가 담지된 Cu-Nb-CeO2 촉매는 Nb2O5의 담지량이 증가함에 따라 촉매 활성이 감소하는 것을 확인할 수 있다. 그 결과, Cu-Nb-CeO2 (5%) 촉매가 가장 낮은 활성을 나타내었다. 따라서 LTS 반응에서 Nb2O5의 담지량이 Cu-CeO2 촉매의 활성에 영향을 미친다는 것을 알 수 있다.
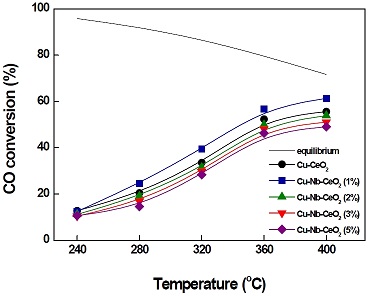
CO conversion with reaction temperature over Cu-CeO2 and Cu-Nb-CeO2 catalysts (reaction condition: GHSV= 72,152 h-1; H2O/(CH4+CO+CO2) = 2.0)
Fig. 4는 다양한 담지량으로 제조된 Cu-Nb-CeO2 촉매와 Cu-CeO2 촉매의 온도에 따른 CO2 및 CH4에 대한 선택도를 나타내었다. 2차 생성물인 CH4의 형성은 WGS의 부반응이며, 이는 H2 수율을 감소시키기 때문에 바람직하지 않다28). 제조된 촉매들은 모든 온도 영역에서 0% CH4 선택도 및 100% CO2 선택도로 반응하였다. 따라서 Cu-CeO2 및 Cu-Nb-CeO2 촉매는 메탄화 반응 없이 CO를 선택적으로 CO2로 전환하여 LTS 반응에 적합한 촉매임을 확인하였다.
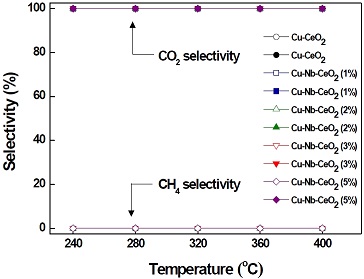
Selectivity to CO2 and CH4 with reaction temperature over Cu-CeO2 and Cu-Nb-CeO2 catalysts (reaction condition: GHSV= 72,152 h-1; H2O/(CH4+CO+CO2) = 2.0)
Cu-Nb-CeO2 (1%) 촉매 및 Cu-CeO2 촉매의 안정성을 비교하기 위해 GHSV 72,152 h-1에서 35시간 동안 LTS 반응을 수행한 결과를 Fig. 5에 나타내었다. 흥미롭게도 Cu-Nb-CeO2 (1%) 촉매는 초기 13시간 동안 60% 이상의 CO 전환율을 유지하여 촉매의 비활성화가 거의 일어나지 않았다. 이후 35시간까지 조금씩 활성이 감소하여 61%에서 55%까지 감소하였다. 그러나 Cu-CeO2 촉매는 15시간 동안 CO 전환율이 55%에서 47%까지 감소하였다. 결과적으로 일반적인 LTS 반응 조건보다 24배 높은 공간속도(GHSV=72,152 h-1)에서 Cu-Nb-CeO2 (1%) 촉매가 Cu-CeO2 촉매보다 안정적인 활성을 나타내었다.
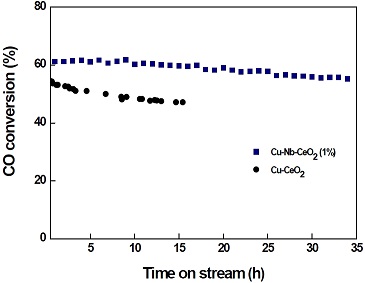
CO conversion with time on stream over Cu-CeO2 and Cu-Nb-CeO2 (1%) catalysts (reaction condition: T= 400℃, GHSV= 72,152 h-1; H2O/(CH4+CO+CO2) = 2.0).
상기 LTS 반응 결과는 촉매의 특성분석 결과를 통해 설명할 수 있다. 결정크기는 촉매의 활성과 안정성에 영향을 미치는 중요인자이며, BET 표면적 및 기공부피는 결정크기와 직접적인 관계가 있다29,30). BET 표면적 및 기공부피가 가장 큰 Cu-Nb-CeO2 (1%) 촉매는 결정크기가 작게 형성되어 높은 활성 및 안정성을 나타내었다31). 또한 산화·환원능력이 우수할 경우, 이동성 산소(mobile oxygen)의 공급(CO+O* → CO2)을 가속화하여 높은 CO 전환율을 나타낼 수 있다32). 결과적으로 촉매의 성능은 촉매 환원 특성과 밀접한 상관관계가 있다. 따라서 Cu-Nb-CeO2 (1%) 촉매는 우수한 산화·환원능력으로 인해 가장 높은 CO 전환율을 나타내었다. 그러나 과잉의 Nb2O5 첨가는 Cu 및 CeO2의 결정 표면을 덮어 Cu의 응집을 발생시키고, 산화·환원능력을 억제시켜 Cu-CeO2 촉매보다 낮은 CO 전환율을 나타내었다.
4. 결 론
본 연구에서는 Nb2O5를 도입하여 Cu-CeO2 촉매를 제조하고 Nb2O5 담지량에 따른 촉매의 성능을 분석하였다. 제조된 촉매 중 Cu-Nb-CeO2 (1%) 촉매가 가장 높은 CO 전환율, 0% CH4 선택도 그리고 100% CO2 선택도를 나타내었다. 또한, 매우 높은 GHSV 72,152 h-1에서 35시간 동안 비교적 안정한 활성을 나타내었다. 이러한 결과는 높은 BET 표면적, 작은 결정 크기, 향상된 산화·환원능력에 기인한다. 그러나 과량의 Nb2O5가 담지된 촉매는 Cu와 CeO2의 결정 표면을 덮어 BET 표면적 및 기공부피를 작게 만들며 산화·환원능력을 억제시킨다. 따라서 Cu-CeO2의 촉매 성능을 향상시키기 위해 적절한 양의 Nb2O5가 담지되어야 한다. 결과적으로 Cu-Nb-CeO2 촉매의 특성 및 성능은 도입된 Nb2O5 담지량과 밀접한 상관관계를 가지며, 컴팩트 개질기용 WGS 반응에서 Cu-Nb-CeO2 촉매의 최적 Nb2O5 담지량은 1 wt.%인 것으로 확인되었다.
Acknowledgments
이 논문은 2019년도 정부(과학기술정보통신부)의 재원으로 한국연구재단의 기초연구사업 지원을 받아 수행된 것입니다(NRF-2019R1C1C1005022). 본 연구는 환경부의 폐자원에너지화 재활용 전문인력 양성사업으로부터 지원을 받았습니다(YL-WE-19-001).
References
-
C. Ratnasamy and J. P. Wagner, “Water gas shift catalysis”, Catalysis Reviews Science and Engineering, Vol. 51, No. 3, 2009, pp. 325-440.
[https://doi.org/10.1080/01614940903048661]

- J. H. Park, J. H. Baek, G. H Jo, and K. B. Yi, “Catalytic characteristic of water-treated Cu/ZnO/MgO/Al2O3 catalyst for LT-WGS reaction”, Trans. of Korean Hydrogen and New Energy Society, Vol. 30, No. 2, 2019, pp. 95-102.
-
A. Chougule and R. R. Sonde, “Modelling and experimental investigation of compact packed bed design of methanol steam reformer”, Int. J. Hydrogen Energy, Vol. 44, No. 57, 2019, pp. 29937-29945.
[https://doi.org/10.1016/j.ijhydene.2019.09.166]

-
D. W. Jeong, J. O. Shim, W. J. Jang, and H. S. Roh, “A study on Pt-Na/CeO2 catalysts for single stage water gas shift reaction”, Trans. of the Korean Hydrogen and New Energy Society, Vol. 23, No. 2, 2012, pp. 111-116.
[https://doi.org/10.7316/KHNES.2012.23.2.111]

- D. J. Seo, W. L. Yoon, K. S. Kang, and J. W. Kim, “Patent trend for hydrogen production technology by steam reforming of natural gas”, Trans. of the Korean Hydrogen and New Energy Society, Vol. 18, No. 4, 2007, pp. 464-480. Retrieved from http://www.koreascience.or.kr/article/JAKO200710736976806.page, .
-
K. H. Kim, K. Y. Koo, U. H. Jung, and W. L. Yoon, “Preferential CO oxidation over Ce-promoted Pt/γ-Al2O3 catalyst”, Trans. of the Korean Hydrogen and New Energy Society, Vol. 23, No. 6, 2012, pp. 640-646.
[https://doi.org/10.7316/KHNES.2012.23.6.640]

-
J. L. Ayastuy, M. P. González-Marcos, and M. A. Gutiérrez-Ortiz, “Promotion effect of Sn in alumina-supported Pt catalysts for CO-PROX”, Catalysis Communications, Vol. 12, No. 10, 2011, pp. 895-900.
[https://doi.org/10.1016/j.catcom.2011.02.011]

- J. O. Shim, H. S. Na, S. Y. Ahn, W. J. Jang, and H. S. Roh, “An optimization of aging time for low-temperature water-gas shift over Cu-Zn-Al catalyst”, Trans. of Korean Hydrogen and New Energy Society, Vol. 30, No. 2, 2019, pp. 103-110.
-
J. H. Kim, Y. S. Jang, J. C. Kim, and D. H. Kim, “Anodic aluminum oxide supported Cu-Zn catalyst for oxidative steam reforming of methanol”, Korean J. Chem. Eng., Vol. 36, No. 3, 2019, pp. 368-376.
[https://doi.org/10.1007/s11814-018-0211-9]

-
Y. T. Seo, D. J. Seo, J. H. Jeong, and W. L. Yoon, “Development of compact fuel processor for 2 kW class residential PEMFCs”, J. Power Sources, Vol. 163, No. 1, 2006, pp. 119-124.
[https://doi.org/10.1016/j.jpowsour.2006.05.022]

- H. M. Kim, K. W. Jeon, H. S. Na, W. J. Jang, and D. W. Jeong, “The effect of Cu loading on the performance of Cu-Ce0.8Zr0.2O2 catalysts for single stage water gas shift reaction”, Trans. of Korean Hydrogen and New Energy Society, Vol. 28, No. 4, 2017, pp. 345-351.
- Y. S. Oh, T. Y. Song, Y. S. Baek, and L. S. Choi, “Efficiency analysis of compact type steam reformer”, Trans. of Korean Hydrogen and New Energy Society, Vol. 13, No. 4, 2002, pp. 313-321. Retrieved from http://www.koreascience.or.kr/article/JAKO200230360539783.page, .
- S. B. Kim, M. S. Kim, S. W. Kim, and S. C. Hong “Reaction characteristics of Cu/CeO2 catalysts for CO oxidation”, Applied Chemistry for Engineering, Vol. 30, No. 5, 2019, pp. 620-626.
-
K. G. Azzam, I. V. Babich, K. Seshan, and L. Lefferts, “Single stage water gas shift conversion over Pt/TiO2—problem of catalyst deactivation”, Applied Catalysis A: General, Vol. 338, No. 1-2, 2008, pp. 66-71.
[https://doi.org/10.1016/j.apcata.2007.12.020]

-
K. R. Hwang, S. K. Ihm, S. C. Park, and J. S. Park, “Pt/ZrO2 catalyst for a single-stage water-gas shift reaction: Ti addition effect”, Int. J. Hydrogen Energy, Vol. 38, No. 14, 2013, pp. 6044-6051.
[https://doi.org/10.1016/j.ijhydene.2013.01.101]

-
C. A. Franchini, A. M. Duarte de Farias, E. M. Albuquerque, R. dos Santos, and M. A. Fraga, “Single-stage medium temperature water-gas shift reaction over Pt/ZrO2 – support structural polymorphism and catalyst deactivation”, Applied Catalysis B: Environmental, Vol. 117–118, 2012, pp. 302-309.
[https://doi.org/10.1016/j.apcatb.2012.01.028]

-
C. K. Byun, H. B. Im, J. H. Park, J. H. Baek, J. M. Jeong, W. R. Yoon, and K. B. Yi, “Enhanced catalytic activity of Cu/Zn catalyst by Ce addition for low temperature water gas shift reaction”, Clean Technology, Vol. 21, No. 3, 2015, pp. 200-206.
[https://doi.org/10.7464/ksct.2015.21.3.200]

-
H. S. Na, D. W. Jeong, W. J. Jang, Y. L. Lee, and H. S. Roh, “A study on Cu based catalysts for water gas shift reaction to produce hydrogen from waste-derived synthesis gas”, Trans. of the Korean Hydrogen and New Energy Society, Vol. 25, No. 3, 2014, pp. 227-233.
[https://doi.org/10.7316/KHNES.2014.25.3.227]

-
J. A Rodriguez, P. Liu, X. Wang, W. Wen, J. Hanson, J. Hrbek, M. Pérez, and J. Evans, “Water-gas shift activity of Cu surfaces and Cu nanoparticles supported on metal oxides”, Catal. Today, Vol. 143, No. 1-2, 2009, pp. 45-50.
[https://doi.org/10.1016/j.cattod.2008.08.022]

-
L. Li, L. Song, H. Wang, C. Chen, Y. She, Y. Zhan, X. Lin, and Q. Zheng, “Water-gas shift reaction over CuO/CeO2 catalysts: effect of CeO2 supports previously prepared by precipitation with different precipitants”, Int. J. Hydrogen Energy, Vol. 36, No. 15, 2011, pp. 8839-8849.
[https://doi.org/10.1016/j.ijhydene.2011.04.137]

-
D. W. Jeong, W. J. Jang, J. O. Shim, W. B. Han, H. S. Roh, U. H. Jung, and W. L. Yoon, “Low-temperature water–gas shift reaction over supported Cu catalysts”, Renewable Energy, Vol. 65, 2014, pp. 102-107.
[https://doi.org/10.1016/j.renene.2013.07.035]

-
W. Yang, D. Li, D. Xu, and X. Wang, “Effect of CeO2 preparation method and Cu loading on CuO/CeO2 catalysts for methane combustion”, Journal of Natural Gas Chemistry, Vol. 18, No. 4, 2009, pp. 458-466.
[https://doi.org/10.1016/S1003-9953(08)60141-3]

-
S. B. T. Tran, H. Choi, S. Oh, and J. Y Park, “Defective Nb2O5-supported Pt catalysts for CO oxidation: promoting catalytic activity via oxygen vacancy engineering”, J. Catal., Vol. 375, 2019, pp. 124-134.
[https://doi.org/10.1016/j.jcat.2019.05.017]

-
F. Zhang, Q. Zheng, K. Wei, X. Lin, H. Zhang, J. Li, and Y. Cao, “Improved performance of Au/Fe2O3 catalysts promoted with ZrO2 and Nb2O5 in the WGS reaction under hydrogen-rich conditions”, Catal. Letters, Vol. 108, No. 3-4, 2006, pp. 131-136.
[https://doi.org/10.1007/s10562-006-0047-5]

-
E. Ramı́rez-Cabrera, A. Atkinson, and D. Chadwick, “Reactivity of ceria, Gd- and Nb-doped ceria to methane”, Applied Catalysis B: Environmental, Vol. 36, No. 3, 2002, pp. 193-206.
[https://doi.org/10.1016/S0926-3373(01)00299-5]

-
S. O. Choi and S. H. Moon, “Performance of La1−xCexFe0.7Ni0.3O3 perovskite catalysts for methane steam reforming”, Catal. Today Vol. 146, No. 1-2, 2009, pp. 148-153.
[https://doi.org/10.1016/j.cattod.2009.02.023]

-
J. Mi, J. Zhang, Y. Cao, C. Chen, X. Lin, J. Chen, and L. Jiang, “Sulfur resistant WGS catalyst for hydrogen production based on CoMo supported by Nb modified MgAl mixed oxide”, Int. J. Hydrogen Energy, Vol. 42, No. 50, 2017, pp. 29935-29943.
[https://doi.org/10.1016/j.ijhydene.2017.08.115]

-
X. Lin, C. Chen, J. Ma, X. Fang, Y. Zhan, and Q. Zheng, “Promotion effect of Nb5+ for Cu/CeO2 water–gas shift reaction catalyst by generating mobile electronic carriers”, Int. J. Hydrogen Energy, Vol. 38, No. 27, 2013, pp. 11847-11852.
[https://doi.org/10.1016/j.ijhydene.2013.07.001]

-
H. S. Roh, I. H. Eum, and D. W. Jeong, “Low temperature steam reforming of methane over Ni–Ce(1−x)Zr(x)O2 catalysts under severe conditions”, Renewable Energy, Vol. 42, 2012, pp. 212-216.
[https://doi.org/10.1016/j.renene.2011.08.013]

-
W. J. Jang, D. W. Jeong, J. O. Shim, and H. S. Roh, “The effect of calcination temperature on the performance of Ni-Ce0.8Zr0.2O2 catalysts for steam reforming of methane under severe conditions”, Trans. of the Korean Hydrogen and New Energy Society, Vol. 23, No. 3, 2012, pp. 213-218.
[https://doi.org/10.7316/KHNES.2012.23.3.213]

-
D. W. Jeong, W. J. Jang, J. O. Shim, W. B. Han, K. W. Jeon, Y. C. Seo, and H. S. Roh, “A comparison study on high-temperature water–gas shift reaction over Fe/Al/Cu and Fe/Al/Ni catalysts using simulated waste-derived synthesis gas”, J. Mater. Cycles Waste Manag., Vol. 16, No. 4, 2014, pp. 650–656.
[https://doi.org/10.1007/s10163-014-0272-8]

-
C. Pedrero, T. Waku, and E. Iglesia, “Oxidation of CO in H2–CO mixtures catalyzed by platinum: alkali effects on rates and selectivity”, J. Catal., Vol. 233, No. 1, 2005, pp. 242-255.
[https://doi.org/10.1016/j.jcat.2005.04.005]