대향류 화염에서의 합성가스 내 수소 함량에 따른 연소 특성 변화에 관한 수치해석 연구
2020 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
Various researches are being conducted to reduce greenhouse gases generated by the consumption of traditional energy resources. This study was conducted to numerically analyze the combustion characteristics and N-S reaction behavior with respect to the H2 content of syngas composed of CO and H2 in pressurized air combustion. A non-premixed opposed flow flame model was applied a modified detailed mechanism with S-chemistry was developed based on GRI 3.0 to simulate the syngas reaction. As the hydrogen content increased, the flame thickness increased due to the fast reactivity of hydrogen. In the rich region, NO and SO2 were reduced by reaction with H radical and H bonding of NO was suppressed by the formation of HOSO.
Keywords:
Syngas, Opposed-flow, Hydrogen (H2), S-chemistry, Pressurization키워드:
합성가스, 대향류, 황-반응, 가압1. 서 론
천연가스, 원유 그리고 석탄과 같은 전통 에너지원의 지속적인 소비로 인해 발생되는 이산화탄소가 지구 온난화를 유발하는 주요 원인으로 주목을 받으면서 이산화탄소 저감, 회수 및 저장 그리고 활용에 대한 연구가 활발히 진행되고 있다. 석탄 연료는 천연 가스 및 원유에 비해 상대적으로 운송이 용이하고, 비용이 저렴하여 집단 에너지 시설에서 대량으로 소비하고 있으며, 그에 따른 온실 가스 저감에 대한 부담이 증가하고 있는 실정이다.
온실 가스 저감을 위한 대안으로 석탄 및 바이오매스 가스화를 통한 연료 전환을 고려할 수 있다. 석탄 가스화는 공정 혹은 운전 조건에 따라 합성가스 내 수소 함량이 달라질 수 있으며1-3), 최근 정부의 수소 경제 활성화 정책4,5)과 연관되어 있다고 볼 수 있다.
합성가스는 기초연구에서부터 산업용 보일러, 내연기관, 발전용 터빈 연소 등 다양한 분야에서 활용될 수 있으며, 이에 대한 실험적 연구는 지속적으로 진행되고 있다6-9). 합성가스 내 수소 함량이 높을수록 NOx 배출량은 증가하나 저부하 운전에서도 CO 는 배출되지 않는다고 보고되었다7). 뿐만 아니라 합성가스로의 연료 전환 및 혼소에 따른 연소 특성 규명을 위해 수치해석 기법을 적용하여 합성가스의 화학적, 물리적 특성 규명도 함께 진행되고 있다10-13).
본 연구는 선행적으로 연구된 합성가스의 실험실 규모 가압 순산소 연소 특성에 대한 분석의 일환으로 수행되었으며, 고압 공기 연소 시 CO/H2로 구성된 합성가스의 H2 함량에 따른 비예혼합 화염의 연소 특성 및 NOx와 SOx의 화학적 연계 거동을 분석하기 위해 수행되었다.
2. 수치해석 방법 및 조건
2.1 수치해석 방법
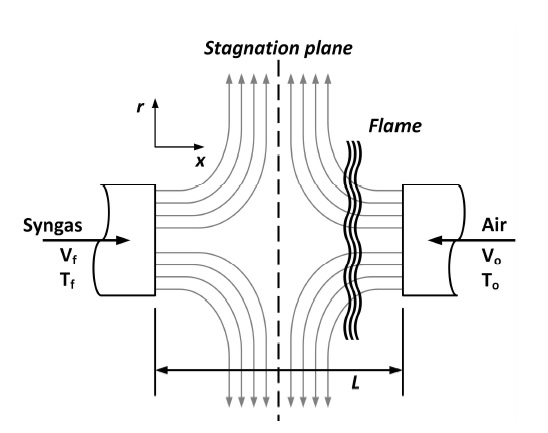
본 연구에서 적용된 대상 화염은 비예혼합 대향류 화염으로 Fig. 1과 같은 구조를 가지고 있다. 연료와 산화제가 서로 마주보는 두 노즐에서 분사되어 노즐 사이의 임의의 위치에서 정체면(stagnation plane)이 형성된다. 분사된 연료는 산화제 측으로 확산(diffusion)되며, 산화제의 혼합기를 형성하여 반응에 의해 비예혼합 화염이 형성되게 된다. 연료 및 산화제의 유동에 의해 정체면을 따라 화염이 늘어난 상태(stretch)로 존재하게 되며, 이를 통해 다양한 신장율에 대한 비예혼합 화염의 연소 특성 분석이 가능하다.
이와 같은 물리적 화염의 수치해석적 접근을 위해 Kee 등에 의해 개발된 CHEMKIN OPPDIF (CHEMKIN, Pennsylvania, United States)14)를 사용하였으며, 연료와 산화제의 간격은 모든 조건에서 2 cm로 동일하게 적용하였다. 합성가스 모사를 위한 상세 화학 반응메커니즘으로 53개의 화학종과 325개의 화학반응으로 구성된 GRI-Mech 3.0 반응 기구15)를 기준으로 하였다. GRI 3.0은 다양한 분야에서 메탄 및 합성가스 연소의 화학적 모델링과 N 반응 모사를 위해 활용11-13)되고 있으나, S 반응에 대한 고려가 부재되어 있어 본 연구를 위해 GRI 3.0에 포함되어 있는 합성가스 반응과 N 반응을 기반으로 S 반응 및 N-S 연계 반응을 추가하였으며, 구체적인 S 반응과 N-S 연계 반응은 Table 1과 같다. 최종적으로 C, H, O, N, S의 가스상 반응 모사를 위해 62개의 화학종과 366개의 화학반응으로 구성된 수정 상세 화학 반응 메커니즘을 본 연구에 도입하였다.
2.2 수치해석 조건
본 연구의 주된 목적은 고압조건에서 공기 연소 시 합성가스 내 H2 함량 변화에 따른 비예혼합 연소 시 합성가스의 화염 구조, 열방출 그리고 NOx, SOx 배출 특성을 분석하는 데 있다. 이를 달성하기 위해 Table 2와 같이 기준 합성가스 내에서의 운전 변경에 따른 H2 비율을 최소 10%에서 최대 40%까지 고려하였다. 연료와 산화제의 투입 온도는 모든 조건에서도 300 K로 동일하다. 참고로 Table 2에서 91의 의미는 CO와 H2의 부피 분율비가 9:1임을 의미한다.
기준 합성가스 연료 조성은 Uhde 사(Dortmund, Germany)의 The PRENFLO® (pressurised entrained-flow) direct quench 가스화 공정을 통해 생산되는 저열량 합성가스16)를 참고하였으며, CO와 H2 조성비를 7:3으로 가정하고 기타 조성은 무시하였다. 또한 선행적으로 수행된 가압 순산소 연소 시 합성가스와 NO의 화학적 거동 특성 분석 결과17)를 기반으로 N 성분과 S 성분의 연계 반응 모사를 위해 소량의 NO와 SO2를 고려하였으며, 부피 분율을 기준으로 각각 0.5%를 고려하였다. 참고로 NO와 SO2의 부피 분율을 대변하기 위해 AR을 첨가하였다.
전체 화염 신장율(global strain rate)은 Chelliah 등18)에 의해 제안된 식 (1)을 이용하여 모든 조건에서 35 s-1로 유지하였으며, 이를 위해 연료와 산화제의 초기 유속은 20 cm/s로 동일하게 적용하였다. 또한 고압 조건에서의 합성가스 연소 특성 분석을 위해 압력은 30 atm으로 고정되었다.
| (1) |
참고로 위 식에서 Fig. 1과 같이 아래첨자 f와 o는 각각 연료 및 산화제를 의미하며, V는 유속, ρ는 밀도 그리고 L은 연료와 산화제 노즐 사이의 간격을 의미한다.
3. 결과 및 고찰
3.1 화염 구조 및 주요 화학종 비교
Fig. 2는 단열, 정압 조건에서 Table 2의 F1과 F2에 대한 화염 구조를 예측, 비교한 결과이다. F1과 F2의 화염 구조를 보면, F1과 F2가 거의 일치하는 결과를 보이고 있다. 본 연구에서는 앞서 설명한 바와 같이 기준이 되는 GRI 3.0을 바탕으로 S 반응과 N-S 연계 반응을 포함한 수정 상세 화학 반응 메커니즘을 제안하였다. Fig. 2의 화염 구조 예측 결과를 바탕으로 기준 상세 화학 반응 메커니즘의 수정 과정에서 추가된 S 반응과 N-S 연계 반응이 주 연소 반응에 큰 영향을 주지 않았다는 것을 판단할 수 있다.
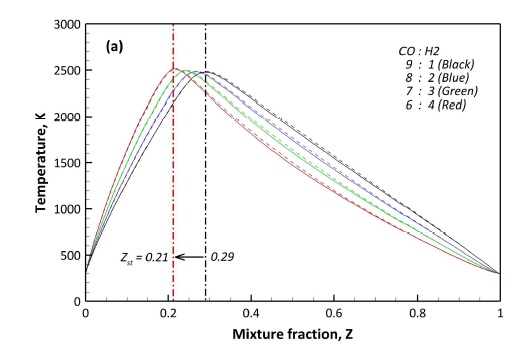
화염 구조는 연료 조성에 따라 큰 차이를 보이지 않고 대체적으로 유사한 경향을 보이고 있으나 농후 영역(Zst<Z≦1)에서 연료 내 H2 함량이 높을수록 온도 감소율이 다소 높게 나타났다. 이상 혼합 분율(stoichiometric mixture fraction, Zst)은 CO와 H2의 혼합비가 9:1인 경우 0.29이며 6:4인 경우 0.21로 H2 함량이 높을수록 혼합 분율의 농후 영역이 넓어지게 된다. 이는 CO에 비해 H2의 분자량이 작기 때문이다.
화염 구조는 이상혼합비 근처에서 최대 단열화염온도를 가지며, F1-91의 경우 2,475 K, F1-64의 경우 2,510 K로 약 40 K 정도 차이를 보인다. 이는 H2의 단열화염온도가 CO에 비해 높기 때문에 H2 함량이 높을수록 단열화염온도가 증가하게 된다.
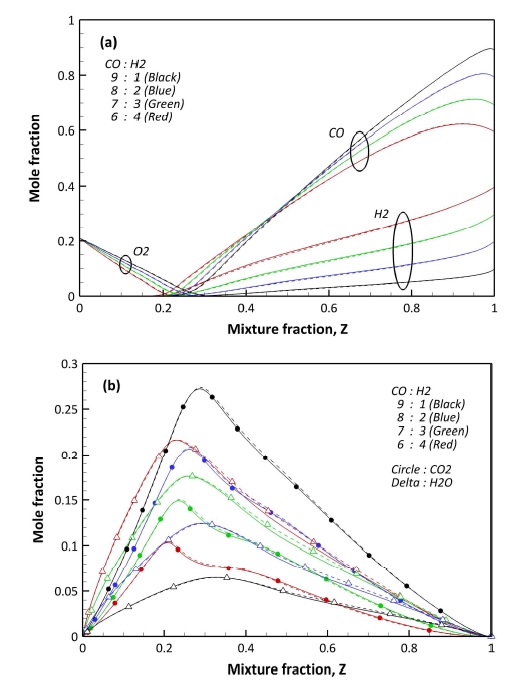
Fig. 3과 4는 F1과 F2의 혼합 분율에 대한 주요 화학종 및 라디칼을 비교한 결과이다. 먼저 반응물인 연료와 산화제는 화염 구조와 마찬가지로 F1과 F2의 분포에서 큰 차이를 보이지 않고 있다. 생성물인 H2O와 CO2 역시 동일한 결과를 보인다. 이를 통해 주요 화학종 예측 결과를 통해 수정 상세 화학 반응 메커니즘에 대한 신뢰성을 확인할 수 있다. H2 함량이 높아질수록 CO2의 생성량은 감소하고 H2O의 생성량은 증가하는 결과를 보인다. 이는 충분히 예측 가능한 결과이다.
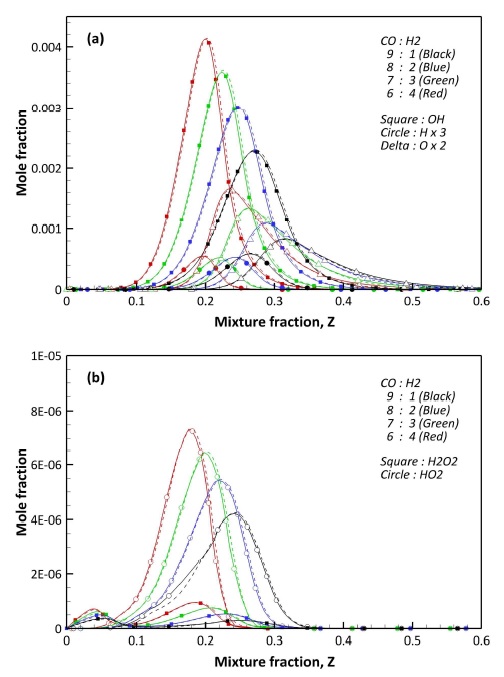
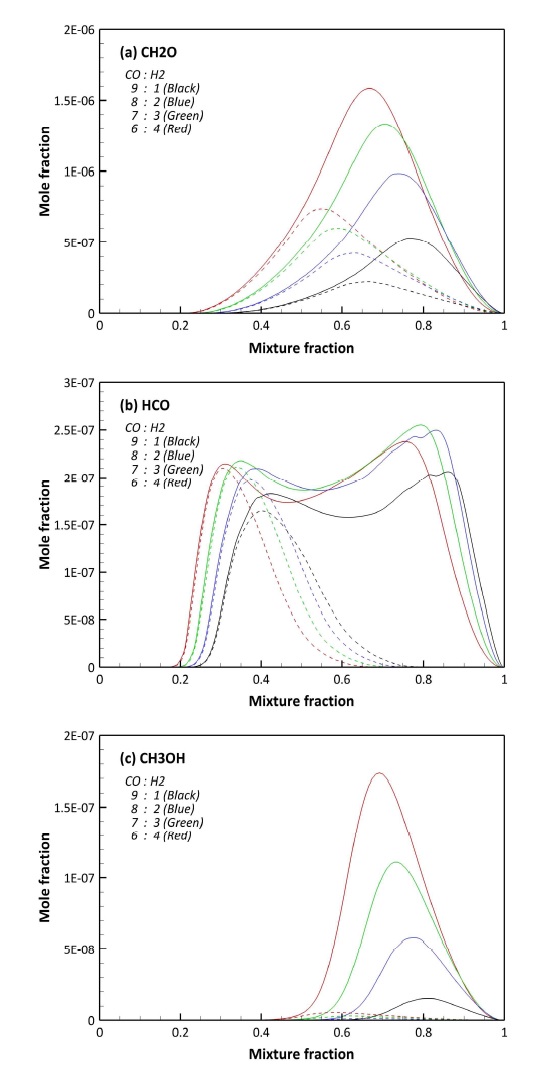
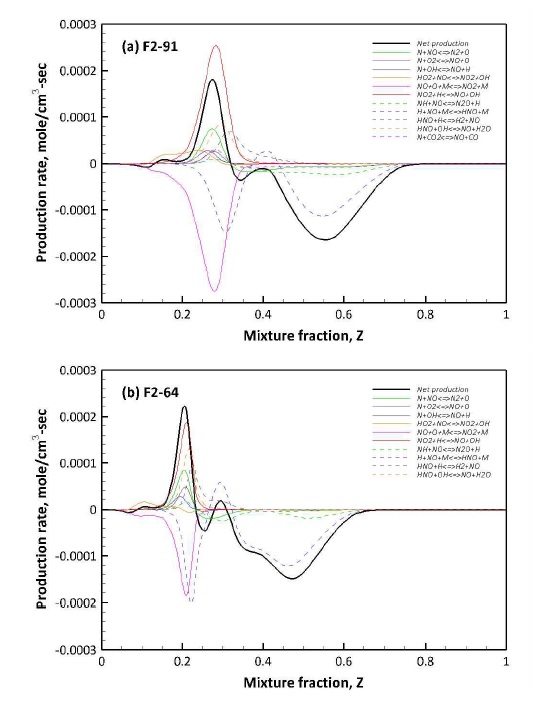
Fig. 5는 C, H, O로 구성된 라디칼 중 합성가스 연소 과정에서 생성되는 주요 중간 생성물을 예측, 비교한 것으로, Figs. 3, 4와 다르게 F1과 F2 사이에 큰 차이를 보이고 있다. Fig. 5(a)와 (b)에서 주요 연소 반응이 일어나는 이상혼합분율 근처에는 CH2O와 HCO의 차이가 없으나, 농후 영역에서 급격한 차이를 보이고 있다. 특히 NO와 SO2가 함께 고려된 F2의 경우 Fig. 5에서 공통적으로 농후 영역에서의 생성이 F1에 비해 낮은 결과를 보이고 있다. CH2O, HCO, 그리고 CH3OH의 경우 농후 영역에서 연료에서 기인한 H 라디칼에 의해 생성되는 중간 생성물이며, 결과적으로 NO와 SO2의 반응에 의해 H 라디칼이 소모된 결과로 판단된다. 이에 대한 구체적인 분석은 3.3절에서 후술하도록 한다.
3.2 연소 특성 및 열방출 비교
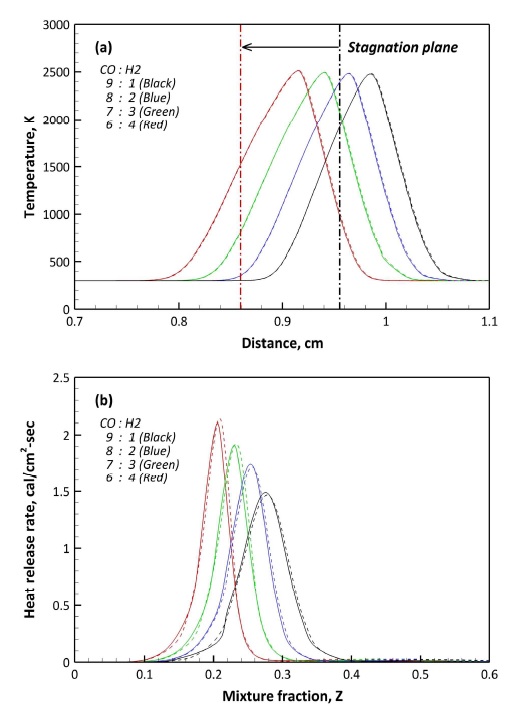
Fig. 6은 F1과 F2의 온도 분포 및 열방출을 비교한 결과이다. Fig. 6(a)에서 정체면은 모든 조건에서 2 cm의 연료와 산화제 노즐 간격 중앙인 1 cm에서 연료 쪽 노즐에 치우쳐 존재하게 된다. 특히 H2 함량이 높을수록 정체면이 연료 쪽으로 이동하는 결과를 보이고 있다. 이는 동일한 유속으로 분사되는 본 해석 조건에서 연료 내 H2 함량이 높아질수록 연료가 가지는 평균 분자량이 감소하게 되고 이로 인해 연료의 운동량이 감소하여 정체면이 연료 노즐 쪽으로 이동하게 된다.
앞서 설명한 바와 같이 일반적인 대향류 화염의 경우 정체면을 기준으로 산화제 노즐 쪽으로 화염이 형성된다. 온도 분포는 주 연소 반응을 동반하는 영역에서 증가하게 되며, 최대 온도는 정체면을 기준으로 오른쪽인 산화제 측에 존재하고 있다. 이를 바탕으로 본 연구에 적용된 합성가스 역시 일반적인 대향류 화염의 현상을 잘 모사하고 있음을 확인할 수 있다. 또한 H2 함량이 높을수록 정체면과 최대 온도의 간격이 증가함을 알 수 있으며, 정체면과 화염 사이의 간격이 멀어짐을 의미한다.
Fig. 6(b)의 연료별 열방출률 결과에서 특징적인 것은 H2 함량이 높아질수록 최대 열방출률이 증가하고, 좁은 영역의 혼합분율에서 열방출이 형성된다는 것이다. 이는 H2의 화학적 반응 특성과 연관되어 있다고 볼 수 있다. H2는 대표적인 빠른 화학적 반응(fast chemistry)에 해당하며 CO는 느린 화학적 반응(slow chemistry)에 해당한다. 빠른 화학적 반응을 동반한 H2 함량이 높은 경우 좁은 영역의 혼합분율에서 다량의 열을 방출하게 되나, 반대의 경우 CO 함량이 증가하게 되어 넓은 영역의 혼합분율에 대해 열을 방출하게 된다. 이로 인해 H2 함량이 높아짐에 따라 열방출률이 증가함과 동시에 열방출 범위가 좁아지게 된다. NO와 SO2가 포함되어 있는 F2의 연료의 경우 F1 연료의 열방출률과 거의 유사하며, H2 함량이 높은 경우 F1 연료 대비 최대 열방출률의 약 2%가량 증가하는 경향을 보인다. 이는 고압 조건에서 H2 함량이 높은 경우 NO의 추가 산화 및 H 라디칼과의 반응에 의해 발열 반응이 동반되며17), 이로 인해 F1 대비 F2의 열방출률이 다소 높아진 것으로 판단된다.
Table 3은 합성가스 연료 조성별 화염 두께를 정량화한 결과이다. 참고로 화염의 두께는 연료와 산화제의 초기 온도에서 온도 상승 50 K 지점 사이의 거리로 정의된다. 동일한 H2 함량에서는 NO와 SO2의 포함 여부가 화염 두께에 대한 영향력은 매우 미미하다. 이와 대조적으로 합성가스 내 H2 함량이 증가할수록 화염 두께가 두꺼워지는 경향을 보이고 있다. 본 연구에 적용된 전체 화염 신장율은 화염 두께의 물리적인 영향성을 무시할 수 있을 정도로 작게 설정되어 있어 결과적으로 화염 두께의 차이는 화학적 측면의 요인이 지배적이라는 것을 확인할 수 있다.
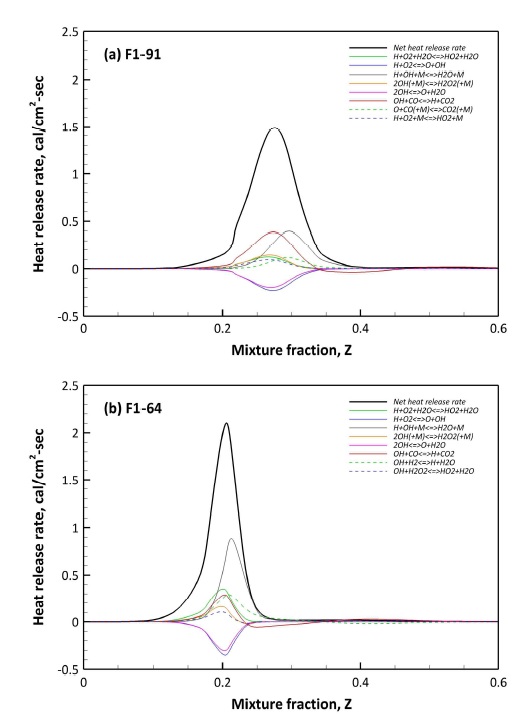
Fig. 7은 주요 화학 반응에 대한 열방출을 F1-91과 F1-64 조건에 대해 나타낸 것이다. 고압의 합성가스 연소 과정에서 H2 함량에 독립적으로 주요 발열과 흡열 반응을 동반하는 화학 반응은 다음과 같다.
Exothermal reaction
| (R1) |
| (R2) |
| (R3) |
Endothermal reaction
| (R4) |
| (R5) |
Fig. 7에서 H2 함량에 따라 열방출률의 정도에는 차이가 있으나 위의 다섯 가지의 반응이 합성가스 연소의 발열과 흡열 반응을 동반하는 것에는 차이가 없다. 참고로 위의 반응은 C, H로 구성된 기체 연료에서 대표적인 반응에 속하기도 한다. 대표적인 반응 중에서 H2 함량에 가장 큰 민감도를 보이는 반응은 R 1과 R 2이다. 특히 R 1의 경우 F1-64에서 전체 열방출률의 약 40%를 담당한다. 하지만 F-91에서는 약 20% 정도로 감소하게 된다. R 1 반응은 H와 OH의 결합 반응에 의해 H2O를 생성하며, 모든 화학종에 H가 관여된다. 결국 H2 함량이 높을수록 H가 늘어나게 되어 R 2의 반응이 활성화되는 것으로 볼 수 있다. R 1의 열방출률 저감 정도는 R 2와 동일하며, R 1 역시 H에 의한 영향으로 판단된다. 흡열 반응의 경우 H2 함량에 따라 다소 차이는 있으나 큰 차이는 보이지 않는다.
대표적인 반응 이외에 H2 함량에 따라 차별적으로 발열 반응을 보이는 반응은 다음과 같다.
F1-91
| (R6) |
| (R7) |
F1-64
| (R8) |
| (R9) |
F1-91의 경우 CO 함량이 높아 R 6와 같이 CO 산화에 의한 발열 반응의 비중이 F1-64에 비해 높다. 반면, H2 함량이 높은 F1-64는 H 라디칼 반응에 의해 생성되는 OH와 H2O2의 생성량이 F1-91에 비해 높아 OH와 H2O2에 의한 열방출률의 비중이 높아지게 된다. 결국 H2 함량 변화에서의 열방출률은 H에 의해 결정된다고 볼 수 있다.
3.3 NO 및 SO2 연관 반응 비교
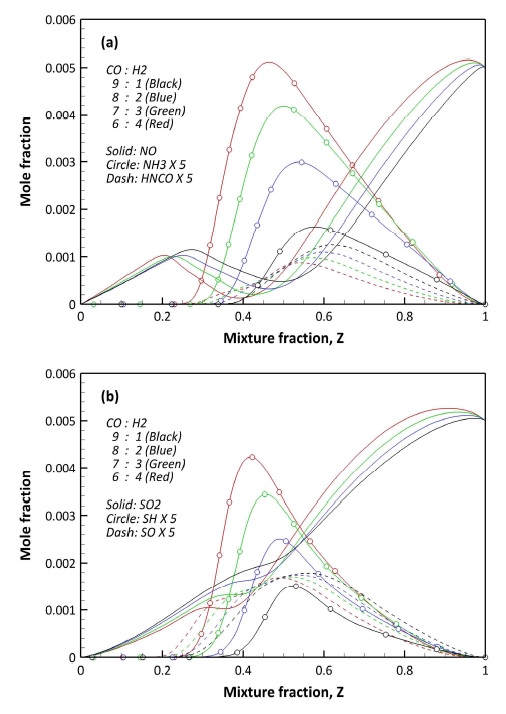
본 연구에서 적용된 S 반응이 고려된 수정 화학 반응 메커니즘에 대한 N-S 연관 화학종의 예측 결과를 Fig. 8에 도시하였다. Fig. 8(a)에서 NO는 농후 영역에서 이상 혼합분율에 근접할수록 지속적으로 감소되나, 주 연소 영역에서 다시 증가하는 결과를 보인다. 또한, 희박 영역(0≦Z<Zst)에서는 증가하는 결과를 보인다. 이는 농후 영역에서의 NO 감소는 화학적 반응에 의해 NO가 다른 형태의 질소화합물로 전환된 것으로 보인다. 또한, 희박 영역에서의 NO 증가는 공기에 기인한 N2가 고압, 고온 반응에 의해 생성되는 thermal NOx에 의한 증가로 판단된다.
반면 Fig. 8(b)에서 혼합분율이 감소함에 따라 SO2는 감소하는 경향을 보인다. 또한 주 연소 영역에서의 SO2 몰분율은 H2 함량이 높을수록 낮아지며, 이는 H2가 SO2의 화학적 전환을 촉진하는 것으로 판단된다.
NO와 SO2의 구체적인 반응 과정을 분석하기 위해 Figs. 9와 10에 NO와 SO2의 생성율에 관여하는 주요 화학 반응의 거동을 도시하였다. 참고로 생성율에서 양의 값은 생성을, 음의 값은 소모를 의미한다. Fig. 9에서 농후 영역에서의 NO 소모는 R 10의 H 라디칼과의 반응에 의해 HNO가 생성되는 과정이 지배적이다. 이와 같은 결과는 H2 함량이 높은 F2-64 조건에서 확실해진다. 또한 R 11의 NH에 의한 NO 소모는 반대로 H2 함량이 낮을수록 기여도가 높다. 이는 Fig. 8(a)와 연관지을 수 있다. NH는 H 라디칼과 반응하여 최종적으로 NH3를 생성한다. H2 함량이 높아질수록 Fig. 8(a)에서 NH3 생성량이 높아지는 것을 확인할 수 있다. 이를 통해 H2 함량이 높은 경우 NH가 NO보다 NH3 생성에 관여하기 때문에 상대적으로 NO 소모에 대한 기여도가 낮아지는 것으로 판단된다.
| (R10) |
| (R11) |
희박 영역에서는 아래 R 12와 R 13과 같이 NO의 산화에 의해 생성되는 NO2와 NO2와 H 라디칼과의 반응이 NO의 생성과 소모에 관여한다. 특히 H2 함량이 낮은 경우 NO2의 생성율이 높아지는데 이는 낮은 H2 함량에 의해 O와의 반응성이 상대적으로 낮아져 NO와의 산화 반응이 증대된 결과로 보인다. 결과적으로 고압 연소에서 NO의 산화에 따라 NO2의 생성율이 결정된다.
| (R12) |
| (R13) |
H2 함량에 따라 차별적으로 NO의 재형성에 기여하는 반응은 아래와 같이 R 14와 R 15이며, R 14의 경우 F2-91의 연소 후 CO2 분율이 높은 경우 한정적으로 NO 생성에 기여하며, R 15는 H2 함량이 높은 F2-64와 같이 H 라디칼이 풍족한 조건에서 NO 생성에 기여한다.
F1-91
| (R14) |
F1-64
| (R15) |
Fig. 10에서 농후 영역에서의 SO2 소모는 H 라디칼과의 반응인 R 16에 의해 지배적이나, SO2 생성에 관여하는 R 18, R 19와 복합적으로 작용한다. 특히, R 17은 혼합분율에 따라 소모과 생성 모두에 관여한다. Fig. 10에서 R 17과 R 18은 연계 반응으로 볼 수 있다. R 17에서 SO2의 H 결합에 의해 생성된 SO는 R 18에 의해 다시 SO2로 전환된다. 하지만 혼합분율이 0.4 근처인 주 연소 영역에 가까울수록 SO는 R 17에 의해 다시 SO2로 전환되며, 주 연소 영역에서 다시 SO2가 SO로 전환되는 복잡한 과정을 거치게 된다.
| (R16) |
| (R17) |
| (R18) |
| (R19) |
반면 H 라디칼은 주 연소 영역에서 F2-64와 같이 H2 함량이 높을수록 SO2 외 HO2, H2O2, OH와의 반응성이 높아 SO2 소모 반응은 F2-91의 조건에서 상대적으로 억제되는 것으로 판단된다.
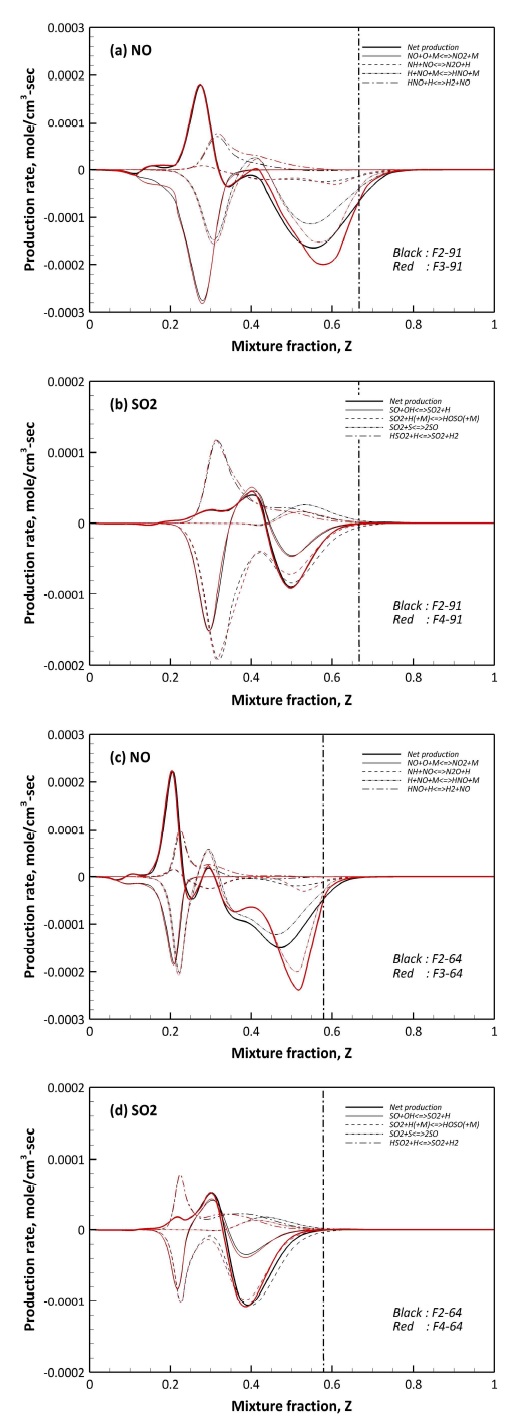
앞서 논의된 NO와 SO2에 연관되어 있는 반응은 NO와 SO2가 혼합된 경우인 F2 연료에 대해 분석되었다. 본 연구에는 NO와 SO2의 연계 반응을 포함하고 있어 NO와 SO2의 상호간 영향성을 분석할 필요가 있다. 이를 위해 Table 2에서 나타나 있는 바와 같이 NO와 SO2를 독립적으로 고려한 F3와 F4 연료에서의 NO와 SO2의 반응 거동에 대한 비교를 Fig. 11에 나타내었다. 참고로 Fig. 11은 F2 대비 F3와 F4에서 NO 및 SO2 생성율에 차이를 보이는 반응만을 비교하였다.
Fig. 11에서 희박 영역과 주 연소 영역에서의 F2, F3 그리고 F4의 NO와 SO2 생성율은 동일하였다. 그리고 Fig. 11(a)와 (c)에서 NO만을 고려한 F3 역시 농후 영역에서 R 10 반응에 의한 NO 소모가 지배적이었다. R 11의 경우 SO2와 상관없이 F2와 F3 모두 동일한 NO 소모율을 보였다. 하지만 H2 함량 차이와 상관없이 NO 소모율이 정량적으로 차이를 보이는 반응 역시 R 10이다.
SO2가 배제된 F3의 경우 농후 영역에서 R 10에 의한 NO 소모율은 급격히 증가하는 결과를 보였다. 특히, H2 함량이 높은 Fig. 11(c)에서 큰 차이를 보였다. 이와 같은 결과를 바탕으로 SO2에 의해 R 10 반응이 억제된다는 것을 도출할 수 있으며, 이는 R 10 반응의 핵심인 H 라디칼의 소모와 관련되어 있다고 볼 수 있다.
Fig. 11(b)와 (d)에 도시된 SO2 생성율의 경우 대부분의 혼합분율에서 F2와 F4 모두 유사한 결과를 보였으나 R 16, R 17 그리고 R 19의 생성율 위치가 F2에 비해 농후 영역으로 확장되었다. 특히, R 16에 의한 SO2 소모율 증가 위치가 확장됨과 동시에 증가되었다. 앞서 언급된 세 가지의 반응에 의해 SO2가 소모 혹은 생성되는 혼합분율의 위치는 F3는 Z=0.67, F4는 Z=0.57이며, 해당 위치는 Fig. 11(a)와 (c)에서 R 10의 반응이 교차되는 위치와 상당히 일치한다. 참고로 F3에서의 Z=0.67와 F4에서의 Z=0.57의 위치는 Fig. 11의 dash-dot에 해당한다. 이와 같은 분석을 통해 NO와 SO2가 혼합되어 있는 경우 농후 영역에서 R 16에 의해 H 라디칼이 선행적으로 소모되어 R 10에 의한 H 라디칼 소모가 약해지는 것으로 판단된다.
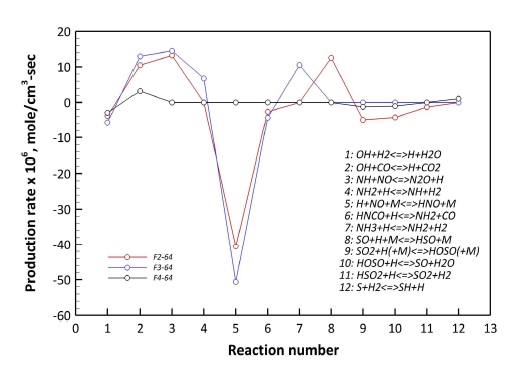
이에 대한 정확한 판단을 위해 Fig. 12에서 CO:H2=6:4, Z=0.57인 조건에 한정하여 H 라디칼의 생성율에 관여하는 주요 화학 반응의 생성율을 도시하였다. Fig. 12를 기준으로 F2-64에서 5번 반응(R 10)에 의한 H 라디칼의 소모가 가장 높게 나타났다. 하지만 F4-64에서 5번 반응에 의한 H 라디칼 소모가 감소하고, 9-11번 반응에 의한 H 라디칼 소모가 증가했다. 이는 Fig. 11에서 도출된 결과와 동일한 것으로 NO와 SO2가 혼합된 경우 R 16에 의해 H 라디칼이 선행적으로 소모되어 R 10의 반응이 억제되는 효과를 야기한 것으로 판단할 수 있다.
4. 결 론
본 연구는 고압 연소 시 CO/H2로 구성된 합성가스의 H2 함량에 따른 비예혼합 화염의 연소 특성 및 NOx와 SOx의 화학적 연계 거동을 예측하고, 주요 열방출과 NO 및 SO2의 연관 반응에 대한 비교, 분석하는 것에 의의가 있다. 수치해석 기법으로는 CHEMKIN의 대향류 비예혼합 연소 모델을 적용하였으며, S 반응 모사를 위해 GRI 3.0을 기반으로 수정 상세 화학 반응 메커니즘을 제안하였다.
1) 단열, 정압 조건에서 F1과 F2에 대한 화염 구조 및 주요 화학종을 예측, 비교하였으며, 화염 구조와 주요 화학종에 대해 F1과 F2의 예측 결과는 거의 일치하였다. 본 연구에서는 GRI 3.0을 기반으로 S 반응과 N-S 연계 반응을 포함한 수정 상세 화학 반응 메커니즘을 제안하였으며, 화염 구조 및 주요 화학종의 예측 결과를 바탕으로 기준 상세 화학 반응 메커니즘의 수정 과정에서 추가된 S 반응과 N-S 연계 반응이 주 연소 반응에 큰 영향을 주지 않았다는 것을 판단할 수 있다.
2) 합성가스 내 H2 함량이 증가할수록 화염 두께가 두꺼워졌으며, 전체 화염 신장율은 화염 두께의 물리적인 영향성을 무시할 수 있을 정도로 작아 화염 두께의 차이는 화학적 측면의 요인이 지배적인 것으로 판단된다. 열방출률에서 H2 함량에 가장 큰 민감도를 보이는 반응은 R 1과 R 2로 H2 함량이 낮아질수록 총 열방출률에 대한 기여도가 감소한다. 결과적으로 R 1과 R 2에서 H2 함량이 높을수록 H가 늘어나게 되어 열방출률이 증가된 것이다.
3) 농후 영역에서의 NO와 SO2의 소모은 H 라디칼과의 반응에 의해 결정되며, H2 함량이 높을수록 농후 영역에서의 H 라디칼의 영향력이 증가한다. 희박 영역에서 주 연소 반응에 의해 NO는 생성율이 크게 증가하나, SO2의 생성율 증가는 미미하다. 또한 NO와 SO2가 혼합되어 있는 경우 각각 고려된 조건과 비교해 희박 영역에서는 큰 차이가 없으나, 농후 영역에서 S 반응에 의해 H 라디칼이 선행적으로 소모되어 N 반응에 의한 H 라디칼 소모가 억제되었다.
Acknowledgments
본 논문은 한국생산기술연구원 기관주요사업 “전주기적 자원순환 대응 친환경생산시스템 기술개발(KITECH EO-20220)”의 지원으로 수행되었습니다.
References
-
A. Arregi, M. Amutio, G. Lopez, J. Bilbao, and M. Olazar, “Evaluation of thermochemical routes for hydrogen production from biomass: a review”, Energy Convers. Manag., Vol. 165, 2018, pp. 696–719.
[https://doi.org/10.1016/j.enconman.2018.03.089]

-
K. Liu, C. Song, and V. Subramani, “Hydrogen and syngas production and purification technologies”, A John Wiley & Sons, Inc., USA, 2010, pp. 127-155.
[https://doi.org/10.1002/9780470561256]

- M. Binder, M. Kraussler, M. Kuba, and L. Luisse, “Hydrogen from biomass gasification”, IEA Bioenergy, 2018. Retrieved from https://www.ieabioenergy.com/wp-content/uploads/2019/01/Wasserstoffstudie_IEA-final.pdf, .
- Ministry of Trade, Industry and Energy, “Roadmap to vitalize the hydrogen economy”, Ministry of Trade, Industry and Energy, 2019. Retrieved from http://www.motie.go.kr/motie/py/td/tradeinvest/bbs/bbsView.do?bbs_cd_n=72&cate_n=2&bbs_seq_n=210222, .
- Ministry of Trade, Industry and Energy, “Roadmap to develop the hydrogen technology”, Ministry of Trade, Industry and Energy, 2019. Retrieved from http://www.motie.go.kr/motie/ne/presse/press2/bbs/bbsView.do?bbs_cd_n=81&bbs_seq_n=162264, .
-
Y. Qian, S. Sun, D. Ju, X. Shan, and X. Lu, “Review of the state-of-the-art of biogas combustion mechanisms and applications in internal combustion engines”, Renew. Sust. Energ. Rev., Vol. 69, 2017, pp. 50-58.
[https://doi.org/10.1016/j.rser.2016.11.059]

-
M. C. Lee, S. B. Seo, J. H. Chung, S. M. Kim, Y. J. Joo, and D. H. Ahn, “Gas turbine combustion performance test of hydrogen and carbon monoxide synthetic gas”, Fuel, Vol. 89, No. 7, 2010, pp. 1485-1491.
[https://doi.org/10.1016/j.fuel.2009.10.004]

-
Y. H. Jiang, G. X. Li, H. M. Li, L. Li, and G. P. Zhang, “Experimental study on the turbulent premixed combustion characteristics of 70% H2/30% CO/air mixtures”, Int. J. Hydrog. Energy, Vol. 44, No. 26, 2019, pp. 14012-14022.
[https://doi.org/10.1016/j.ijhydene.2019.03.232]

-
C. Linderholm, A. Cuadrat, and A. Lyngfelt, “Chemical-looping combustion of solid fuels in a 10 kWth pilot–batch tests with five fuels”, Energy Procedia, Vol. 4, 2011, pp. 385-392.
[https://doi.org/10.1016/j.egypro.2011.01.066]

-
S. Sun, S. Meng, Y. Zhao, H. Xu, Y. Guo, and Y. Qin, “Experimental and theoretical studies of laminar flame speed of CO/H2 in O2/H2O atmosphere”, Int. J. Hydrog. Energy, Vol. 41, No. 4, 2016, pp. 3273-3283.
[https://doi.org/10.1016/j.ijhydene.2015.11.120]

-
M. Fischer and X. Jiang, “A chemical kinetic modelling study of the combustion of CH4–CO–H2–CO2 fuel mixtures”, Comb. Flame, Vol. 167, 2016, pp. 274-293.
[https://doi.org/10.1016/j.combustflame.2016.02.001]

-
S. F. Ahmed, J. Santner, F. L. Dryer, B. Padak, and T. I. Farouk, “Computational study of NOx formation at conditions relevant to gas turbine operation, part 2: NOx in high hydrogen content fuel combustion at elevated pressure”, Energy Fuels, Vol. 30, No. 9, 2016, pp. 7691-7703.
[https://doi.org/10.1021/acs.energyfuels.6b00421]

-
H. Li, G. Li, Z. Sun, Z. Zhou, Y. Li, and Y. Yuan, “Investigation on dilution effect on laminar burning velocity of syngas premixed flames”, Energy, Vol. 112, 2016, pp. 146-152.
[https://doi.org/10.1016/j.energy.2016.06.015]

-
R. J. Kee, J. A. Miller, G. H. Evans, and G. Dixon-Lewis, “A computational model of the structure and extinction of strained, opposed flow, premixed methane-air flames”, Symposium (International) on Combustion, Vol. 22, No. 1, pp. 1479-1494, 1988.
[https://doi.org/10.1016/S0082-0784(89)80158-4]

- G. P. Smith, D. M. Golden, M. Frenklach, N. W. Moriarty, B. Eiteneer, M. Goldenberg, C. T. Bowman, R. K. Hanson, S. Song, W. C. Gardiner, V. V. Lissianski, and Z. Qin. “How to cite GRI-MECH”, GRI-MECH. Retrieved from http://combustion.berkeley.edu/gri-mech/version30/text30.html, .
- K. Radtke and M. Heinritz-Adrian, “ThyssenKrupp Uhde's PRENFLO® and HTW™ Gasification Technologies: Global Update on Technology and Projects”, Gasification Technologies Conference, 2011. Retrieved from https://www.netl.doe.gov/sites/default/files/netl-file/16RADTKE.pdf, .
-
D. Kim, H. Ahn, K. Y. Huh, and Y. Lee, “Numerical analysis of chemical characteristics of homogeneous CO/H2/NO in pressurized oxy-fuel combustion”, Trans. of the Korean Hydrogen and New Energy Society, Vol. 30, No. 4, 2019, pp. 320-329.
[https://doi.org/10.7316/KHNES.2019.30.4.320]

-
H. K. Chelliah, C. K. Law, T. Ueda, M. D. Smooke, and F. A. Williams, “An experimental and theoretical investigation of the dilution, pressure and flow-field effects on the extinction condition of methane-air-nitrogen diffusion flames”, Symposium (International) on Combustion, Vol. 23, No. 1, 1991, pp. 503-511.
[https://doi.org/10.1016/S0082-0784(06)80297-3]

-
C. L. Rasmussen, P. Glarborg, and P. Marshall, “Mechanisms of radical removal by SO2”, P. Combust. Inst., Vol. 31, No. 1, 2007, pp. 339-347.
[https://doi.org/10.1016/j.proci.2006.07.249]

-
M. U. Alzueta, R. Bilbao, and P. Glarborg, “Inhibition and sensitization of fuel oxidation by SO2”, Combust. Flame, Vol. 127, No. 4, 2001, pp. 2234-2251.
[https://doi.org/10.1016/S0010-2180(01)00325-X]

-
M. A. Blitz, K. W. McKee, and M. J. Pilling, “Temperature dependence of the reaction of OH with SO”, P. Combust. Inst., Vol. 28, No. 2, 2000, pp. 2491-2497.
[https://doi.org/10.1016/S0082-0784(00)80664-5]

-
A. Goumri, J. D. R. Rocha, D. Laakso, C. E. Smith, and P. Marshall, “Characterization of reaction pathways on the potential energy surfaces for H + SO2 and HS + O2”, J. Phys. Chem. A, Vol. 103, No. 51, 1999, pp. 11328-11335.
[https://doi.org/10.1021/jp9924070]

-
K. Tsuchiya, K. Kamiya, and H. Matsui, “Studies on the oxidation mechanism of H2S based on direct examination of the key reactions”, Int. J. Chem. Kinet., Vol. 29, No. 1, 1997, pp. 57-66.
[https://doi.org/10.1002/(SICI)1097-4601(1997)29:1<57::AID-KIN7>3.0.CO;2-K]

-
M. A. Blitz, K. J. Hughes, M. J. Pillling, and S. H. Robertson, “Combined experimental and master equation investigation of the multiwell reaction H+ SO2”, J. Phys. Chem. A, Vol. 110, No. 9, 2006, pp. 2996-3009.
[https://doi.org/10.1021/jp054722u]

-
J. Naidoo, A. Goumri, and P. Marshall, “A kinetic study of the reaction of atomic oxygen with SO2”, Proc. Combust. Inst., Vol. 30, No. 1, 2005, pp. 1219-1225.
[https://doi.org/10.1016/j.proci.2004.08.214]

-
A. Yilmaz, L. Hindiyarti, A. D. Jensen, P. Glarborg, and P. Marshall, “Thermal dissociation of SO3 at 100-1400K”, J. Phys. Chem. A, Vol. 110, No. 21, 2006, pp. 6654-6659.
[https://doi.org/10.1021/jp0557215]

-
M. A. Blitz, K. J. Hughes, and M. J. Pilling, “Determination of the high-pressure limiting rate coefficient and the enthalpy of reaction for OH+SO2”, J. Phys. Chem. A, Vol. 107, No. 12, 2003, pp. 1971-1978.
[https://doi.org/10.1021/jp026524y]

-
G. B. Bacskay and J. C. Mackie, “Oxidation of CO by SO2: a theoretical study”, J. Phys. Chem. A, Vol. 109, No. 9, 2005, pp. 2019-2025.
[https://doi.org/10.1021/jp045086n]

-
Y. Murakami, S. Onishi, T. Kobayashi, N. Fujii, N. Isshiki, K. Tsuchiya, A. Tezaki, and H. Matsui, “High temperature reaction of S + SO2 → SO + SO: Implication of S2O2 intermediate complex formation”, J. Phys. Chem. A, Vol. 107, No. 50, 2003, pp. 10996-11000.
[https://doi.org/10.1021/jp030471i]

-
O. I. Smith, S. Tseregounis, and S. N. Wang, “High‐temperature kinetics of the reactions of SO2 and SO3 with atomic oxygen”, Int. J. Chem. Kinet., Vol. 14, No. 6, 1982, pp. 679-697.
[https://doi.org/10.1002/kin.550140610]

-
P. Glarborg, D. Kubel, K. Dam-Johansen, H. M. Chiang, and J. W. Bozzelli, “Impact of SO2 and NO on CO oxidation under post‐flame conditions”, Int. J. Chem. Kinet., Vol. 28, No. 10, 1996, pp. 773-790.
[https://doi.org/10.1002/(SICI)1097-4601(1996)28:10<773::AID-KIN8>3.0.CO;2-K]

-
R. Atkinson, D. L. Baulch, R. A. Cox, R. F. Hampson Jr, J. A. Kerr, and J. Troe, “Evaluated kinetic and photochemical data for atmospheric chemistry: Supplement IV. IUPAC subcommittee on gas kinetic data evaluation for atmospheric chemistry”, J. Phys. Chem. Ref. Data, Vol. 21, No. 6, 1992, pp. 1125-1568.
[https://doi.org/10.1063/1.555918]

- W. B. DeMore, S. P. Sander, D. M. Golden, R. F. Hampson, M. J. Kurylo, C. J. Howard, A. R. Ravishankara, C. E. Kolb, and M. J. Molina, “Chemical kinetics and photochemical data for use in stratospheric modeling”, Evaluation Number 12, JPL Publication 97-4, 1997. Retrieved from https://jpldataeval.jpl.nasa.gov/pdf/Atmos97_Anotated.pdf, .
-
H. Shiina, A. Miyoshi, and H. Matsui, “Investigation on the insertion channel in the S(3P) + H2 reaction”, J. Phys. Chem. A, Vol. 102, No. 20, 1998, pp. 3556-3559, doi: https://doi.org/10.1021/jp980650d.
[https://doi.org/10.1021/jp980650d]

-
M. A. A. Clyne and P. D. Whitefield, “Atomic resonance fluorescence for rate constants of rapid bimolecular reactions. Part 7.—Sulphur atom reactions: S+O2→SO+O and S+NO2→SO+NO from 296 to 410 K”, J. Chem. Soc. Faraday Trans. 2, Vol. 75, 1979, pp. 1327-1340.
[https://doi.org/10.1039/F29797501327]

-
H. Freund and H. B. Palmer, “Shock‐tube studies of the reactions of NO2 with NO2, SO2, and CO”, Int. J. Chem. Kinet., Vol. 9, No. 6, 1977, pp. 887-905.
[https://doi.org/10.1002/kin.550090605]

-
J. Brunning and L. J. Stief, “Kinetic studies of the reaction of the SO radical with NO2 and ClO from 210 to 363 K”, J. Chem. Phys., Vol. 84, No. 8, 1986, pp. 4371-4377.
[https://doi.org/10.1063/1.450059]

-
A. Jacob and C. A. Winkler, “Kinetics of the reactions of oxygen atoms and nitrogen atoms with sulphur trioxide”, J. Chem. Soc. Faraday Trans. 1, Vol. 68, 1972, pp. 2077-2082.
[https://doi.org/10.1039/f19726802077]

-
R. Atkinson and J. N. Pitts Jr, “Kinetics of the reaction O(3P) + SO2 + M → SO3 + M over the temperature range of 299°-440°K”, Int. J. Chem. Kinet., Vol. 10, No. 10, 1978, pp. 1081-1090.
[https://doi.org/10.1002/kin.550101006]

-
K. Ravichandran, R. Williams, and T. R. Fletcher, “Atmospheric reactions of vibrationally excited greenhouse gases: SH+N2O (n, 0, 0)”, Chem. Phys. Lett., Vol. 217, No. 4, 1994, pp. 375-380.
[https://doi.org/10.1016/0009-2614(93)E1411-9]