우주탐사용 직접 수소화붕소나트륨/과산화수소 연료전지의 환원극 촉매
2020 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
This study investigated the cathode catalyst of direct borohydride/hydrogen peroxide fuel cells for space exploration. Various catalysts such as Au, Ag, and Ni were supported on multiwalled carbon nanotubes (MWCNTs). Various techniques, such as transmission electron microscopy, Brunauer-Emmett-Teller method, scanning electron microscopy, and X-ray diffraction were conducted to investigate the characteristics of the catalysts. Fuel cell tests were performed to evaluate the performance of the catalysts. Ag/MWCNTs exhibited better catalytic activity than the Ni/MWCNTs and better catalytic selectivity of the Au/MWCNTs. Ag/MWCNTs presented good catalytic activity and selectivity even at an elevated operating temperature. The performance of Ag/MWCNTs was also stable for up to 60 minutes.
Keywords:
Catalyst, Sodium borohydride, Hydrogen peroxide, Full cell, Space exploration키워드:
촉매, 수소화붕소나트륨, 과산화수소, 연료전지, 우주탐사1. 서 론
미국의 스페이스X는 유인 우주선을 2020년 5월 30일에 발사하였다. 민간 기업에서 개발한 유인 우주선의 최초 발사 성공으로 민간 우주탐사 시대가 열리게 되었다. 스페이스X뿐 아니라 미국의 연구기관과 민간 우주기업 역시 우주탐사를 위한 연구를 수행하고 있으며, 중국은 태양계 행성탐사 목표 하에 관련 연구를 진행하고 있다. 국가 간 우주탐사 경쟁이 심화됨에 따라 우주 환경에서 장기간 운용이 가능한 동력원의 필요성이 증대되고 있다1,2). 따라서 이미 우주탐사 계획을 수립한 국가는 높은 에너지 밀도를 갖는 동력원에 대한 연구를 활발히 진행하고 있다.
화학에너지를 전기에너지로 변환하는 에너지 변환장치인 연료전지는 다양한 장점을 지녀 새로운 동력원으로 주목을 받고 있다. 연료전지는 반응과정에서 환경오염물질을 배출하지 않아 친환경적이다. 또한, 효율뿐 아니라 에너지 밀도도 우수하여 장기간 운용이 가능하다.
현재 소형 시스템에 널리 활용되는 연료전지는 고분자 전해질 연료전지(polymer electrolyte membrane fuel cell, PEMFC)이다. PEMFC는 수소와 산소를 이용하여 전기에너지와 물을 생성하므로 친환경적이다. 하지만 PEMFC를 무산소 환경인 우주에서 사용하기 위해서는 수소뿐 아니라 산소를 기체 또는 액체 상태로 저장해야 한다. 고압으로 가압하여 기체 상태로 저장하거나 극저온의 액체 상태로 저장하기 위해서는 별도의 장치가 필요하다. 이러한 장치로 인해 시스템의 복잡도가 증가하고 연료전지 시스템의 에너지 밀도는 감소한다. 따라서 순수한 수소와 산소를 연료로 사용하는 PEMFC는 우주탐사를 위한 장기간 운용 동력원으로는 적합하지 않다3).
직접 수소화붕소나트륨/과산화수소 연료전지(direct borohydride/hydrogen peroxide fuel cell, DBHPFC)는 식 (1)과 같이 수소화붕소나트륨(NaBH4)과 과산화수소(H2O2)의 직접 산화・환원 반응을 이용하여 화학에너지를 전기에너지로 변환한다. DBHPFC는 상온에서 액체 상태인 연료와 산화제를 사용하기 때문에 저장성이 비교적 우수하다. NaBH4와 H2O2의 취급성이 우수하여 연료 충전이 용이하다. 또한, DBHPFC는 타 연료전지에 비해 이론 전압(3.01 V)이 높고, 100℃ 이하의 온도에서 작동되기 때문에 시동 특성도 비교적 우수하다. DBHPFC는 많은 장점을 지녀 우주탐사용 동력원으로 주목을 받고 있다. 미국3-5), 중국6), 영국7), 포르투갈8), 이란9,10), 인도11)는 DBHPFC를 우주탐사용 동력원으로 활용하기 위해 2000년대 초반부터 기초 연구를 수행하고 있다.
하지만 DBHPFC는 문제점도 갖고 있다. 최대 동력밀도가 PEMFC보다 다소 낮다. DBHPFC의 최대 동력밀도를 향상시키기 위해서는 촉매의 반응성을 증가시켜야 한다. 따라서 대부분의 연구진이 촉매의 반응성을 높이기 위한 연구를 활발히 진행하고 있다. 그러나 DBHPFC 촉매는 식 (1)의 전기화학반응뿐 아니라 식 (2) 또는 (3)과 같은 NaBH4와 H2O2의 분해반응을 일으킨다. 식에서 볼 수 있듯이 분해반응으로 인해 수소와 산소뿐 아니라 열이 발생된다. 분해반응이 발생하면 화학에너지의 일부가 전기에너지가 아닌 열로 변환되고, 발생된 열은 주변으로 소산된다. 분해반응으로 인해 에너지가 손실되어 연료전지 시스템의 효율과 에너지 밀도가 감소한다. DBHPFC 시스템의 장기 구동을 위해서는 에너지 밀도가 중요하므로 촉매의 반응성 뿐 아니라 반응 선택성도 중요한 성능인자이다.
| (1) |
| (2) |
| (3) |
본 연구에서는 DBHPFC 환원극 촉매가 연료전지의 성능에 미치는 영향을 연구하였다. 본 연구진의 선행연구 결과를 참고하여 산화극에는 Pd을 사용하였고, 환원극에는 Au, Ag, Ni를 사용하였다12). 제작된 촉매를 분석하여 촉매의 특성을 확인하였으며, 연료전지의 성능평가를 수행하여 촉매의 반응성과 반응 선택성을 비교하였다. 촉매의 반응성을 비교하기 위해 연료전지의 동력밀도를 측정하였고, 촉매의 반응 선택성을 비교하기 위해 분해 반응으로 생성된 산소의 부피 유량을 측정하였다. 측정된 동력밀도와 산소의 부피 유량 데이터를 바탕으로 DBHPFC에 적합한 환원극 촉매를 선정하였다. 선정된 환원극 촉매를 갖는 연료전지를 활용하여 반응 온도와 반응 시간이 연료전지의 성능에 미치는 영향을 확인하였다.
2. 실 험
2.1 촉매 제작
산화극에는 다중벽 탄소나노튜브(multiwalled carbon nanotubes, MWCNTs)에 환원시킨 Pd 촉매를 사용하였으며, 환원극에는 MWCNTs에 환원시킨 다양한 촉매를 사용하였다. 먼저 촉매 전구체와 구연산나트륨(HOC(COONa)(CH2COONa)2·2H2O, Sigma-Aldrich, St. Louis, USA)을 사용하여 촉매 제작을 위한 용액을 준비하였다. 질산팔라듐(Pd(NO3)2·2H2O, Sigma-Aldrich), 염화금(AuCl3, Sigma-Aldrich), 질산은(AgNO3, Sigma-Aldrich), 염화니켈(NiCl2, Sigma-Aldrich)을 촉매 전구체로 사용하였으며, 촉매 전구체를 20 g의 증류수(Samchun Chemical, Seoul, Korea)에 용해시켰다. 이후 촉매 분산을 위해 몰 비율 1 (촉매):1 (구연산나트륨)의 구연산나트륨을 용해시켰다. 제작된 용액에 질량 비율 1 (촉매):5 (지지체)의 COOH 기능화 된 MWCNTs (US Research Nanomaterials, Houston, USA)를 첨가하였다. MWCNTs의 분산을 위해 초음파 세척기(US-2R, As One, Osaka, Japan)로 30분 동안 초음파 처리를 하였다.
촉매를 MWCNTs에 환원시키기 위해 NaBH4 (Samchun Chemical) 용액을 준비하였다. 먼저 몰 비율 1 (촉매):10 (NaBH4)의 NaBH4를 20 g의 증류수에 용해시켰다. 제작된 NaBH4 용액은 시린지 펌프(LSP02-2A, Longer Precision Pump, Baoding, China)를 사용하여 20 mL/h의 유량으로 촉매 용액에 주입하였다. 주입과 동시에 핫플레이트(RCT Basic, Ika, Königswinter, Germany)를 이용하여 24시간 동안 100 rpm으로 용액을 교반하였다. 교반 후 촉매를 여과하였고, 증류수와 에탄올(C2H5OH, Samchun Chemical)을 사용하여 세척하였다. 세척된 촉매는 40℃의 온도로 설정된 진공 건조기(C-DVD1, Changshin Science, Seoul, Korea)에서 충분히 건조하였다.
2.2 전극 제작
선행 연구와 유사한 방법으로 전극을 제작하였다12). 먼저 전극을 제작하기 위하여 촉매 슬러리를 준비하였다. 촉매 슬러리는 MWCNTs에 환원된 촉매, 5 wt% Nafion 수용액(D521, Chemours, Wilmington, USA), 에탄올을 이용하여 질량 비율 1:1:20으로 제작하였다. 제작된 촉매 슬러리는 핫플레이트에서 300 rpm의 속도로 30분 동안 교반하였다. 스프레이 건(Spray-Work Basic Airbrush, Tamiya, Shizuoka, Japan)을 사용하여 3.3×3.3 cm 크기의 탄소 천(CCP40, Fuel Cell Earth, Woburn, USA) 위에 1 mg/cm2의 촉매가 올라가도록 촉매 슬러리를 분사하였다. 제작된 전극은 40℃의 온도로 설정된 진공 건조기에 보관하였다.
2.3 전해질 세척
불순물을 제거하기 위하여 선행 연구와 동일한 방법으로 전해질을 세척하였다12). 전해질은 4.7×4.7 cm 크기의 Nafion 212 전해질(Chemours)을 사용하였다. 3 wt% H2O2 (Samchun Chemical)+3 wt% H2SO4 (Samchun Chemical)+94 wt% H2O의 조성을 갖는 세척 용액에 전해질을 넣고 80℃에서 1시간 동안 유지하였다. 이후 80℃의 증류수에서 다시 1시간 동안 유지하였다. 세척이 완료된 전해질은 연료전지 성능실험 전까지 증류수에 보관하였다.
2.4 연료전지
체결된 연료전지는 Fig. 1과 같다. 전해질은 0.5 mol/kg H2SO4 용액에서 연료전지 실험 직전에 2시간 동안 활성화하였다. 막-전극 접합체는 활성화된 전해질, 산화극 전극, 환원극 전극을 이용하여 제작하였다. 양극판은 흑연을 사용하였으며, 흑연 양극판의 연료공급 유로는 깊이와 폭이 1 mm인 사형 형태를 적용하였다. 연료 및 기체의 유출을 방지하기 위하여 두께 0.25 mm의 실리콘 가스킷(SGC30, Fuel Cell Earth)을 양극판과 막-전극 접합체 사이에 삽입하였다. 집전판은 알루미늄에 금을 도금하였고, 끝판은 스테인레스 강을 사용하였다. 연료전지 구성품은 토크렌치(50QL, Tohnichi, Tokyo, Japan)를 이용하여 20 kgf cm로 압착하였다.
2.5 촉매 및 전극 분석
MWCNTs에 환원된 촉매의 형태학적 특징은 투과전자현미경(transmission electron microscopy, JEM-2100F, Jeol, Tokyo, Japan)을 사용하여 분석하였다. MWCNTs에 환원된 촉매의 BET 비표면적은 비표면적분석기(Autosorb-iQ, Quantachrome Instruments, Boynton Beach, USA)를 이용하여 측정하였다. 전극 표면의 형태학적 특징은 주사전자현미경(scanning electron microscopy, MIRA1 LMH, Tescan, Brno, Czech Republic)을 통해 확인하였고, 전극의 구조는 X선 회절분석기(X-ray diffraction, X’Pert PRO MPD, Malvern Panalytical, Malvern, UK)를 사용하여 파악하였다.
2.6 연료전지 성능평가
연료전지의 성능을 평가하여 환원극 촉매에 따른 반응성과 반응 선택성을 확인하였다. 실험 장치는 선행 연구와 유사하게 구성하였다12,13). 연료전지는 산화 반응과 환원 반응을 통해 전기를 생산하므로 산화극과 환원극의 실험장치 구성은 동일하다. 펌프(9QQ, Boxer, Ottobeuren, Germany)를 이용하여 연료를 10 mL/min의 공급률로 연료전지에 주입하였고, 주입된 연료는 전극에서 촉매와 반응하여 전자를 생성하였다. 전기화학반응으로 생성된 전자는 전자부하장치(3315F, Prodigit, New Taipei City, Taiwan)로 소비하였고, 액체 생성물은 삼각 플라스크에 저장하였다. 기체 생성물은 실리카겔(SiO2, Samchun Chemical)을 통과시켜 수분을 제거하였고, 이후 부피 유량계(수소: FMA-1606A, 산소: FMA-1605A, Omega, Norwalk, USA)를 이용하여 유량을 측정하였다. 연료전지와 생성물의 온도는 K타입 열전대를 사용하여 측정하였다. 측정된 데이터는 데이터 획득 장치(GL240, Graphtec, Yokohama, Japan)로 수집하여 컴퓨터에 저장하였다.
연료전지 성능평가에 사용된 연료 조성은 선행연구 결과를 참고하여 결정하였다13). 수산화나트륨(NaOH, Samchun Chemical)과 인산(H3PO4, Samchun Chemical)은 연료의 안정성을 위해 사용하였다. 산화극에는 5 wt% NaBH4+10 wt% NaOH+85 wt% H2O의 조성을 갖는 연료를 공급하였으며, 환원극에는 20 wt% H2O2+5 wt% H3PO4+75 wt% H2O의 조성을 갖는 산화제를 공급하였다. 연료와 산화제의 온도는 핫플레이트를 사용하여 일정하게 유지하였다.
0-400 mA/cm2의 범위에서 전류밀도를 25 mA/cm2씩 증가시켜 가며 연료전지의 성능을 측정하였다. 부하를 1분간 인가한 후에는 1분 동안 무부하 상태를 유지하고 다시 부하를 인가하였다. 각 전류밀도에서 평균 전압을 구하여 동력밀도를 계산하였다. 부하를 인가하면 연료전지의 온도가 증가하고, 증가된 온도는 촉매의 활성에 영향을 준다. 따라서 반응 온도의 영향을 가급적 배제하기 위해서 33.5±2.0℃ 또는 55.0±1.6℃의 온도를 유지하며 성능을 평가하였다.
3. 실험 결과
3.1 환원극 촉매와 전극 분석
Fig. 2는 촉매의 형태학적 특성을 확인하기 위해 투과전자현미경을 사용하여 환원극 촉매를 촬영한 이미지이다. 촉매 분산을 위해 구연산나트륨을 첨가하였지만 촉매 일부는 뭉쳐진 상태로 환원이 되었다. 촉매 입자의 크기는 반응성에 영향을 준다. 따라서 촉매의 분산 특성을 향상시키기 위한 후속 연구가 필요하다고 판단된다.
Table 1은 촉매의 비표면적을 분석한 결과이다. 비표면적은 Ag가 156.7 m2/g으로 가장 우수하였다. Au의 비표면적은 124.1 m2/g이었고, Ni의 비표면적은 115.9 m2/g으로 가장 작았다.
Fig. 3은 전극의 형태학적 특성을 확인하기 위해 주사전자현미경을 사용하여 환원극을 촬영한 이미지이다. 3개 전극은 비슷한 형상을 보였으며 탄소천 위에 촉매층이 비교적 균일하게 도포되었다. 또한, 미세 공극이 존재하여 연료가 촉매층 아래까지 침투할 수 있을 것으로 사료된다.
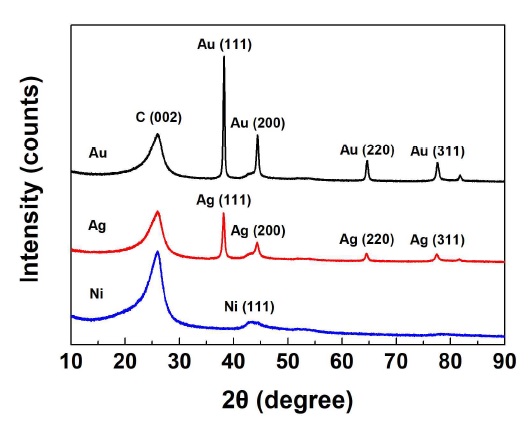
Fig. 4는 X선 회절분석기로 분석한 촉매의 결정구조이다. 각각의 전극에 도포된 촉매와 지지체의 결정구조가 확인되었다. 따라서 촉매가 적절히 환원되어 전극에 도포된 것으로 판단하였다.
3.2 환원극 촉매의 성능평가
장기간 운용을 위한 연료전지 시스템에서는 연료전지 스택과 연료가 가장 큰 비중을 차지한다. 연료전지의 성능인자 중에서 동력밀도는 연료전지 스택과 관련이 있으며, 연료 이용률은 연료와 관련이 있다. 동력밀도가 높을수록 연료전지 스택의 무게와 부피가 감소하고, 연료 이용률이 높을수록 연료의 무게와 부피가 감소한다. 따라서 동력밀도와 연료 이용률이 높을수록 연료전지 시스템의 에너지 밀도가 증가한다. 다양한 환원극 촉매를 갖는 연료전지의 성능을 평가하여 동력밀도와 생성된 산소 유량을 측정하였으며, 측정된 데이터를 바탕으로 환원극에 적합한 촉매를 선정하고자 하였다. 촉매를 제외한 모든 조건은 동일하였고, 연료전지의 성능은 33.5±2.0℃의 온도 범위에서 평가하였다.
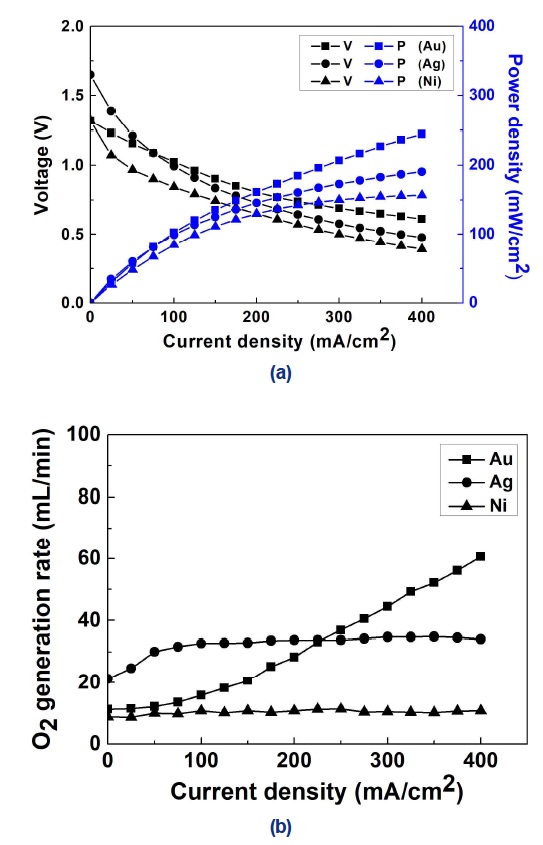
Fig. 5(a)는 다양한 환원극 촉매를 갖는 연료전지의 성능을 나타낸다. 그림에서 확인할 수 있듯이 전압손실에 의해서 모든 촉매의 개회로 전압은 이론전압(3.01 V)보다 낮게 측정되었다. 전류밀도 400 mA/cm2에서의 동력밀도는 Au (244.4 mW/cm2)>Ag (190.8 mW/cm2)>Ni (156.8 mW/cm2)의 순서로 확인되었다. Au의 동력밀도는 Ag보다 28% 높았으며, Ni보다 56% 우수하였다. 따라서 반응성은 Au가 가장 우수하였다.
Performance of fuel cells with X/MWCNTs (X=Au, Ag, Ni): (a) performance curve and (b) oxygen generation rate
Fig. 5(b)는 전류밀도에 따라 환원극 촉매에서 생성되는 산소의 부피 유량을 나타낸다. 전류밀도 400 mA/cm2에서 생성된 산소의 유량은 Au (60.5 mL/min)>Ag (34.1 mL/min)>Ni (10.8 mL/min) 순서로 측정되었다. Au에서 생성된 산소의 유량은 Ag보다 77% 높게 측정되었고, Ni 보다 460% 많았다. 따라서 반응 선택성은 Ni이 가장 우수하였다.
연료전지가 주로 작동하는 높은 전류밀도 영역에서는 Au의 동력밀도가 타 촉매보다 우수하여 연료전지 스택의 경량화 및 소형화에 유리할 것으로 사료된다. 하지만 생성된 산소가 많아 장기간 운용을 위해서는 많은 연료가 필요하다. 따라서 전체 시스템의 무게와 부피가 증가하게 된다. Table 2에서 확인할 수 있듯이 높은 전류밀도에서 Ag와 Ni의 반응성은 Au보다 낮아 연료전지 스택의 소형화에 다소 불리하다. 그러나 반응 선택성이 우수하여 연료의 손실이 작기 때문에 연료의 무게와 부피를 줄일 수 있다. 선행연구 결과에 따르면 장기간 운용을 위한 DBHPFC 시스템에서는 연료전지 스택보다 연료의 비중이 크다2). 따라서 연료 이용률이 우수한 Ag와 Ni이 장기간 운용을 위한 우주탐사용 DBHPFC의 환원극 촉매에 적합할 것으로 예상된다. 더불어 Ag와 Ni은 Au보다 상대적으로 가격이 저렴하기 때문에 연료전지 스택을 저렴한 비용으로 제작할 수 있는 장점이 있다.
3.3 온도에 대한 영향
반응온도가 증가하면 촉매의 활성이 증가한다. 만약 증가된 반응온도에서 Ag의 동력밀도가 Au보다 우수하고 Ag의 산소 발생률이 Au보다 작다면, 연료전지 스택과 연료의 무게를 모두 줄일 수 있다. 반응온도가 촉매의 전기화학반응과 분해반응 활성에 미치는 영향을 확인하기 위하여 Ag 촉매를 갖는 연료전지의 성능을 55.0±1.6℃의 온도 범위에서 평가하였다. 촉매를 제외한 모든 조건은 동일하였다.
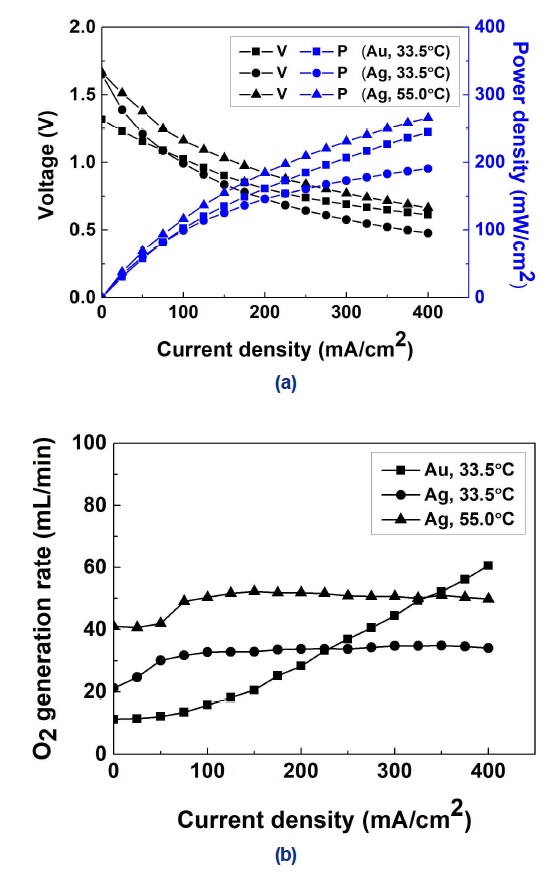
Fig. 6은 반응온도에 따른 연료전지의 성능을 보여준다. 비교를 위해 Fig. 5에 제시된 33.5℃에서의 연료전지 성능을 Fig. 6에 다시 제시하였다. 반응온도가 33.5℃에서 55.0℃로 증가함에 따라 전류밀도 400 mA/cm2에서의 Ag의 동력밀도는 190.8 mW/cm2에서 265.7 mW/cm2로 증가하였고, Ag의 산소 발생률은 34.1 mL/min에서 49.7 mL/min로 증가하였다. 반응온도가 증가함에 따라 전기화학반응 뿐 아니라 분해반응에 대한 활성이 모두 증가하였다. 그러나 Table 3에서 볼 수 있듯이 연료전지가 주로 작동되는 높은 전류밀도에서 반응온도 55℃의 Ag는 반응온도 32℃의 Au보다 반응성 및 반응 선택성 모두 비교적 우수하였다.
Performance of fuel cells with X/MWCNTs (X=Au, Ag): (a) performance curve and (b) oxygen generation rate
열공급 장치로 반응온도를 증가시키면 Ag는 동력밀도가 증가하여 소형화된 연료전지 스택을 제작할 수 있다. 뿐만 아니라 Ag는 높은 전류밀도에서 비교적 우수한 반응 선택성을 가지므로 연료의 무게 절감이 가능하다. 따라서 Au 대신 Ag를 환원극 촉매로 사용하고 경량 열공급 장치를 사용한다면 전체 연료전지 시스템의 에너지 밀도를 향상시킬 수 있을 것이다.
Table 4는 다른 연구진이 DBHPFC 연구를 수행하여 달성한 최대 동력밀도이다. 중국과 영국 연구진이 달성한 최대 동력밀도보다는 높았으나, 미국과 인도 연구진이 달성한 최대 동력밀도보다는 다소 낮은 수준이었다. 따라서 후속 연구를 수행하여 성능을 개선시킬 필요가 있다고 판단된다.
3.4 안정성 평가
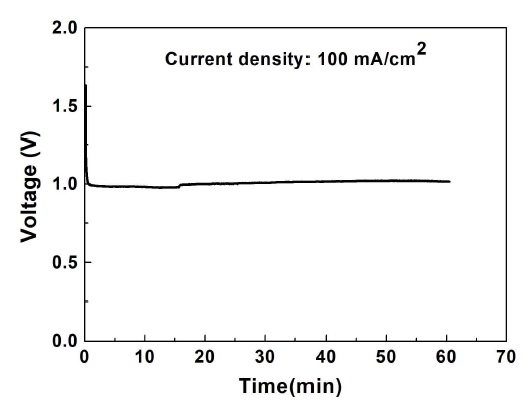
장기간 운용을 위해서 촉매는 일정한 성능을 유지해야 한다. 따라서 산화극 촉매 Pd와 환원극 촉매 Ag를 사용하여 100 mA/cm2의 전류밀도에서 안정성을 확인하였다. 연료전지의 성능은 33.0±1.4℃의 온도 범위에서 평가하였다.
Fig. 7에서 나타난 것과 같이 개회로전압은 1.63 V로 측정되었다. 100 mA/cm2의 전류밀도에서 작동전압은 0.98-1.03 V로 60분 동안 비교적 일정하게 유지되었고, 생성된 산소의 평균 발생률은 36.9 mL/min으로 측정되었다. 따라서 Ag 촉매의 안정성은 비교적 우수하다고 사료된다.
4. 결 론
우주탐사용 DBHPFC의 장기간 운용에 적합한 환원극 촉매를 선정하기 위해 다양한 촉매의 성능을 평가하였다. Au은 반응성이 우수하였지만 반응 선택성은 좋지 않았다. Ni은 반응 선택성은 우수하였지만, 반응성이 다소 낮았다. Ag의 반응성은 Ni보다 우수하였고, Ag의 반응 선택성은 Au보다 우수하였다. 반응온도를 증가시키면 높은 전류밀도에서 Ag는 Au보다 반응성과 반응 선택성이 모두 우수하였다. 따라서 경량의 열공급 장치를 사용하여 반응온도를 증가시킬 수 있다면, 연료전지 스택과 연료의 무게가 감소하여 연료전지 시스템의 에너지 밀도가 향상될 수 있다. 또한, Ag는 100 mA/cm2의 전류밀도에서 60분 동안 안정적으로 반응하였다. 뿐만 아니라 Ag는 Au보다 가격이 저렴하기 때문에 연료전지 스택의 제작비용을 감소시킬 수 있다. 따라서 환원극 촉매 Ag가 DBHPFC의 장기간 운용에 적합하다고 사료된다.
Acknowledgments
이 논문은 2019-2020년도 창원대학교 자율연구과제 연구비 지원으로 수행된 연구결과입니다.
References
-
T. H. Oh, “Design specifications of direct borohydride–hydrogen peroxide fuel cell system for space missions”, Aerosp. Sci. Technol., Vol. 58, 2016, pp. 511-517.
[https://doi.org/10.1016/j.ast.2016.09.012]

-
T. H. Oh, B. Jang, and S. Kwon, “Estimating the energy density of direct borohydride-hydrogen peroxide fuel cell systems for air-independent propulsion applications”, Energy, Vol. 90, No. 1, 2015, pp. 980-986.
[https://doi.org/10.1016/j.energy.2015.08.002]

-
G. H. Miley, N. Luo, J. Mather, R. Burton, G. Hawkins, L. Gu, E. Byrd, R. Gimlin, P. J. Shrestha, G. Benavides, J. Laystrom, and D. Carroll, “Direct NaBH4/H2O2 fuel cells”, J. Power Sources, Vol. 165, No. 2, 2007, pp. 509-516.
[https://doi.org/10.1016/j.jpowsour.2006.10.062]

-
L. Gu, N. Luo, and G. H. Miley, “Cathode electrocatalyst selection and deposition for a direct borohydride/hydrogen peroxide fuel cell”, J. Power Sources, Vol. 173, No. 1, 2007, pp. 77-85.
[https://doi.org/10.1016/j.jpowsour.2007.05.005]

-
Z. Wang, J. Parrondo, C. He, S. Sankarasubramanian, and V. Ramani, “Efficient pH-gradient-enabled microscale bipolar interfaces in direct borohydride fuel cells”, Nat. Energy, Vol. 4, No. 4, 2019, pp. 281-289.
[https://doi.org/10.1038/s41560-019-0330-5]

-
W. Haijun, W. Cheng, L. Zhixiang, and M. Zongqiang, “Influence of operation conditions on direct NaBH4/H2O2 fuel cell performance”, Int. J. Hydrogen Energy, Vol. 35, No. 7, 2010, pp. 2648-2651.
[https://doi.org/10.1016/j.ijhydene.2009.04.020]

-
C. P. León, F. C. Walsh, C. J. Patrissi, M. G. Medeiros, R. R. Bessette, R. W. Reeve, J. B. Lakeman, A. Rose, and D. Browning, “A direct borohydride–peroxide fuel cell using a Pd/Ir alloy coated microfibrous carbon cathode”, Electrochem. Commun., Vol. 10, No. 10, 2008, pp. 1610-1613.
[https://doi.org/10.1016/j.elecom.2008.08.006]

-
R. C. P. Oliveira, M. Vasić, D. M. F. Santos, B. Babić, R. Hercigonja, C. A. C. Sequeira, and B. Šljukić, “Performance assessment of a direct borohydride-peroxide fuel cell with Pd-impregnated faujasite X zeolite as anode electrocatalyst”, Electrochim. Acta, Vol. 269, 2018, pp. 517-525.
[https://doi.org/10.1016/j.electacta.2018.03.021]

-
M. G. Hosseini and R. Mahmoodi, “Improvement of energy conversion efficiency and power generation in direct borohydride-hydrogen peroxide fuel cell: the effect of Ni-M core-shell nanoparticles (M = Pt, Pd, Ru)/multiwalled carbon nanotubes on the cell performance”, J. Power Sources, Vol. 370, 2017, pp. 87-97.
[https://doi.org/10.1016/j.jpowsour.2017.10.017]

-
R. Mahmoodi, M. G. Hosseini, and H. Rasouli, “Enhancement of output power density and performance of direct borohydride-hydrogen peroxide fuel cell using Ni-Pd core-shell nanoparticles on polymeric composite supports (rGO-PANI) as novel electrocatalysts”, Appl. Catal. B-Environ., Vol. 251, 2019, pp. 37-48.
[https://doi.org/10.1016/j.apcatb.2019.03.064]

-
R. K. Raman, N. A. Choudhury, and A. K. Shukla, “A high output voltage direct borohydride fuel cell”, Electrochem. Solid St., Vol. 7, No. 12, 2004, pp. A488-A491.
[https://doi.org/10.1149/1.1817855]

-
T. H. Oh, B. Jang, and S. Kwon, “Electrocatalysts supported on multiwalled carbon nanotubes for direct borohydride–hydrogen peroxide fuel cell”, Int. J. Hydrogen Energy, Vol. 39, No. 13, 2014, pp. 6977-6986.
[https://doi.org/10.1016/j.ijhydene.2014.02.117]

-
T. H. Oh, B. Jang, and S. Kwon, “Performance evaluation of direct borohydride–hydrogen peroxide fuel cells with electrocatalysts supported on multiwalled carbon nanotubes”, Energy, Vol. 76, 2014, pp. 911-919.
[https://doi.org/10.1016/j.energy.2014.09.002]