Mg2NiHx-10wt% CaF2 수소저장합금의 제조와 수소화 흡수평가
2020 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
It is possible that hydrogen could replace coal and petroleum as the predominant energy source in the near future, but several challenges including cost, efficiency, and stability. Mg and Mg alloys are attractive hydrogen storage materials because of their lightweight and high absorption capacity. Their range of applications could be further extended if their hydrogenation properties could be improved. The main emphasis of this study was to investigate their hydrogenation properties for Synthesis of 10wt.% CaF2 in Mg2NiHx systems. The effect of BCR (66:1) and MA time (96 hours) on the hydrogenation properties of the composite was investigated. also, Mg2NiHx-10wt% CaF2 composites prepared by Mechanical Alloying are used in this work to illustrate the effect of catalysts on activation energy and kinetics of Magnesium hydride.
Keywords:
Hydrogen storage, Hydrogenation properties, Mechanical alloying, Kinetics, Magnesium hydride키워드:
수소 저장, 수소화 특성, 기계적 합금, 동력학, 수소화 마그네슘1. 서 론
최근 화석 연료의 고갈과 심각한 환경오염 문제로 인해 정부와 연구원은 대체 에너지원을 개발하기 위해 노력하고 정책을 세워야한다. 수소에 대한 142 MJKg-1의 높은 에너지 밀도는 화석 연료를 대체할 유망한 에너지원이다. 수소의 최종 연소 생성물은 물이므로 매우 친환경적인 환경에너지원으로 이어져 대기 조성에 거의 영향을 미치지 않으며, 수소는 전기로 쉽게 전환할 수 있어 재생 에너지원(태양, 바람 및 지열)을 전기로 쉽게 전환할 수 있다1). 그럼에도 불구하고 효율적인 수소 저장의 어려움은 여전히 광범위한 응용 분야에서 실질적인 장애물이다. 복잡하고 통상적인 금속 수소화물 형태의 고체 상태 수소 저장은 부피 및 중량 측정 용량으로 인해 지난 수십 년 동안 상당한 관심을 끌었다. 금속 수소화물 중에서 수소화 마그네슘은 높은 중량 측정 용량(7.6 wt%), 가역성, 풍부성, 비교적 저렴한 비용 및 비독성 특성으로 인해 미래의 응용에 상당한 잠재력을 갖는다2). 하지만 마그네슘은 수소와 더불어 이온성 수소화물을 형성하여 반응속도론적 문제를 야기하고 산소와의 친화력이 강해 열화현상 및 초기 활성화를 초래하는 것으로 알려져 있다3). 이와 같은 문제점들을 개선하기 위해 금속첨가제로 전이 금속인 Ni, Fe, Co 등 전이원소의 첨가와 같은 합금설계와 기계적 합금화법과 같은 공정제어 기술 개발들이 다양하게 연구되고 있으며, 금속 간 화합물을 형성함으로써 크게 개선될 수 있다4-8). 따라서 본 연구에서는 다양한 선행 연구를 참고하여 Mg2NiHX에 열안정성의 향상과 더불어 흡수 방출 속도를 높이고, 산소 대신 불소가 결합되어 있는 불화물들을 이용함으로써 결합되어 있던 불소 이온들이 Mg와 결합하면서 생성된 MgF2 상이 표면에서 산화반응성을 억제해준다9-11). 이 점을 참고하여 CaF2를 첨가하였다12). 또한 기계적 합금화(mechanical alloying, MA)법 중에 하나이며, 반응성 분위기 조절이 용이한 유성형 볼밀법(planetary ball milling)을 사용하여 효과적인 합금을 제조한 후 활성화 처리를 포함하는 수소화 반응속도를 개선해 보고자 하였다.
2. 실험방법
Mg (Sigma-Aldrich 98%)와 Ni (Sigma-Aldrich 99.7%) powder를 밀링 용기에 장입한다. 밀링 용기는 STS304 재질로 니들형 밸브를 장착하여 수소가압 및 진공 분위기를 유지할 수 있도록 설계, 제작하였다. Mg과 Ni의 분말간 접촉면적의 극대화 및 상호 확산거리의 최소화를 도모하기 위해 각 재료를 96시간 pre-milling 하였으며, 이때 Mg:Ni의 중량비는 이원계 상태도를 참고하여 45:55가 되도록 하였다. 볼과 재료의 중량비(balls to raw materilas weight ratio)는 66:1이 되도록 장입한 후, 로터리 펌프를 이용하여 5×10-2torr까지 진공 탈기한 후 초기 활성화 공정을 배제할 수 있는 금속 수소화물을 얻고자 순도 99.9999%의 수소를 3.0 MPa로 가압하였다. 합금화를 위해 유성형 볼밀(planetary ball mill, PULVERISETTE-5, FRITSCH, Germany)을 사용하여 200 rpm의 회전속도로 합금화 하였다. 그 후 회수된 분말과 powder 형상의 10 wt.% CaF2 (Sigma-Aldrich, 99.9%)를 용기에 장입하여 같은 조건으로 24시간 합금화 하였다. 제조된 시료의 야금학적 분석을 위하여 Mascience Co. (Germany)의 M18톨-SRA X-ray diffractometer (XRD)를 사용하였다. Target은 1.5405 Å의 Cu Kα를 사용하였다. 주사속도는 10 deg/min이었으며 주사범위는 20-80°였다. 시료의 표면형상과 입자 크기를 관찰하기 위해 FEI Corp (Nederland)의 quanta – 400 주사전자현미경을 사용하여 관찰하였으며, 복합 재료의 미세구조를 관찰하기 위해 FEI Tecnai의 F20 G2 투과전자현미경을 사용하였다. 탈수소화 개시온도와 상변화 온도 및 활성화 에너지 값을 알기 위해 Thermo Gravimetric/Differential Scanning Calorimetry (TG/DSC, Netzsch, Germany, STA409 PC) 분석을 하였으며, 수소화 특성평가를 하기 위해 Sivert’s형 자동화 pressure-composition-temperature (PCT) 장치를 사용하여 자동부피측정법에 의한 수소 흡착반응속도를 평가하였다. 이때, 온도 범위는 선행 연구를 참고하여 423, 523, 623 K로 평가하였다13).
3. 결과 및 고찰
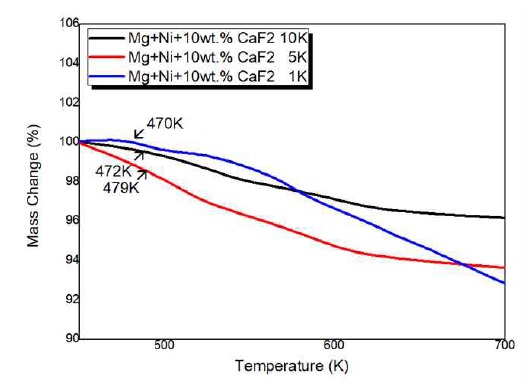
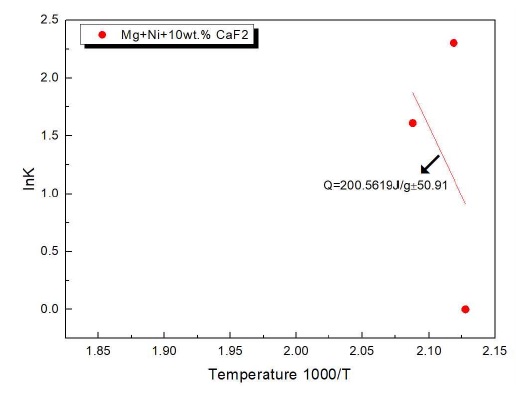
Fig. 1은 Mg2Ni 및 10 wt.%의 CaF2를 첨가하여 MA법을 통해 제조된 시료의 XRD 분석 결과이다. Mg2NiHx-10wt% CaF2 복합체에 대해 얻은 XRD 분석 결과는 고온 고압 분위기에서의 소결로 인해 Mg2NiHx의 회절 강도가 강하고 외관상으로 형성된 강한 Mg2NiHx를 나타냈다. 생성된 막이 높은 기계적 특성을 가짐을 나타냈으며, 20-45°에서 peak 세기가 강한 것을 확인할 수 있었는데, 이는 나노구조화에 의한 현상으로 생각된다. 또한 Mg2NiHx-10wt% CaF2 복합체는 CaF2 함량이 풍부한 것으로 추정되며, 그 이유는 밀링 동안에 입자 크기 감소 및 변형 축적으로 인해 회절 패턴이 넓어진 것으로 추정된다14). 하지만 불화물에서 해리된 F이온이 생성하는 MgF2상의 peak는 보이지 않았다. Fig. 2는 Mg2NiHx-10wt% CaF2의 FE-SEM 표면형상 관찰사진이다. Fig. 2(a)와 (b)는 볼 밀링된 샘플의 전형적인 형태로 CaF2 분말 입자는 Mg-matrix 입자 내에서 작은 크기 및 불균일한 분포를 시사한다. 전체적으로 응집 된 입자는 대략 1-10 µm 크기로 확인되었으며, 복합 재료는 Mg2NiHx와 CaF2가 조화가 잘 된 것으로 확인되었다. Fig. 3은 Mg2NiHx와 CaF2 복합재료의 질소흡탈착 거동으로 측정한 비표면적 분석 결과이다. 분쇄 효과로 인한 MA 공정의 일반적 장점인 비표면적의 급격한 증가를 예상하였지만 Mg2NiH4보다 CaF2의 입자크기가 더 크고 입자 미세화로 인한 응집현상으로 인하여 비표면적의 크기가 줄어든 것으로 판단된다15). Fig. 4는 Mg2Ni-(10 wt%)CaF2 복합재료의 TEM을 이용하여 SEAD Pattern 및 명시야상 분석 결과이다. 명시야상 결과 입계들의 크기가 10 nm 내외의 나노 결정 및 비정질로 구성되었음을 확인할 수 있었다. 또한 SEAD pattern 결과 연속적이고 넓은 원형 패턴인 것으로 보아 균일한 비정질 결정구조로 이루어진 것으로 판단된다16). Fig. 5는 Mg2NiHx-10wt% CaF2의 온도 변화에 따른 중량 변화(wt.%)를 결정하기 위한 TGA 분석 결과이다. TGA 측정은 분당 1 K, 5 K, 10 K 증가함에 따른 반응을 살펴보았다. 온도가 증가함에 따라 탈수소화로 인한 중량 손실이 확인될 수 있으며, 이는 산화로 인한 증가로 간주된다. 1 K에서는 470 K, 5 K에서는 479 K, 10 K는 472 K에서 탈수소화가 진행되었다. 이는 승수의 온도가 증가함에 따라 탈수소화 온도가 증가함을 보여준다. Fig. 6은 Mg2NiHx-10wt% CaF2시료의 수소화 반응을 plateau 평형압으로부터 van’t Hoff plot을 계산하여 열역학적 특성을 규명한 결과이다. 423-523 K의 비교적 저온범위에서 200.5619±50.91 J/g의 우수한 값을 보였으며, 이를 Table 1에 나타내었다.
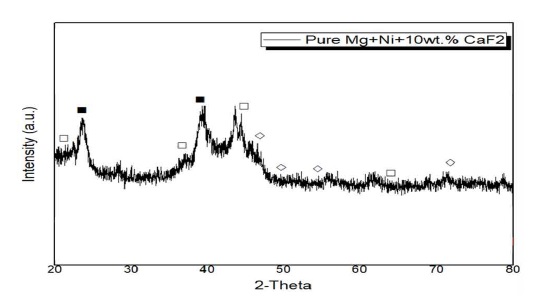
XRD patterns of Mg2Ni-(10 wt%)CaF2 hydride with BCR 96h 66:1 (Mg2NiH.29 [Hexagonal] : □, Mg2NiH4 [Orthorhombic] : ■, CaF2 [Tetragonal] : ◇)

Structure of Mg2Ni-(10 wt%)CaF2 powder were investigated through Scanning Electron Microscopy (SEM, FEI Corp, quanta – 400). (a) Mg2Ni-(10 wt%)CaF2 (×2,500) (b) Mg2Ni-(10 wt%)CaF2 (×5,000)
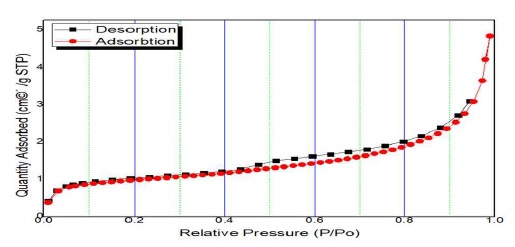
The following figure is BET curves showing the adsorption and desorption of hydrogen at relative pressures
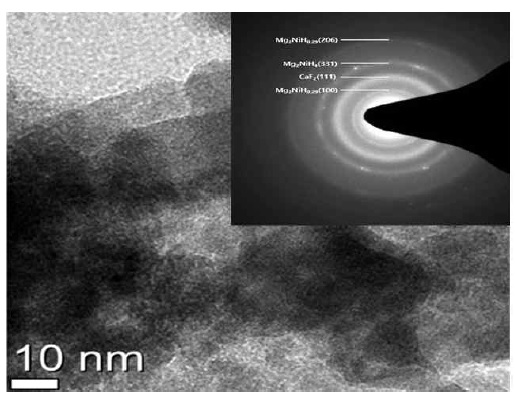
Structure of Mg2Ni-(10 wt%)CaF2 powder were investigated through Transmission Electron Microscopy (TEM, FEI Tecnai F20 G2)
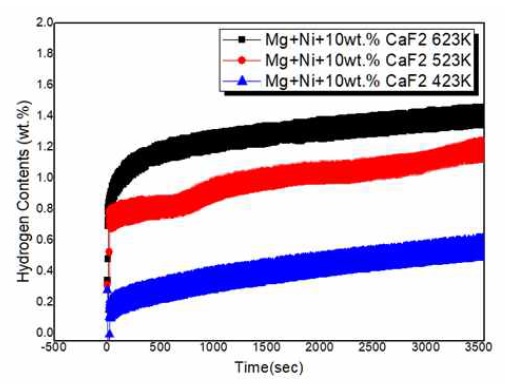
Fig. 7은 Mg2NiHx-10wt% CaF2 복합체의 3 MPa 수소 압력 및 423 K, 523 K, 623 K에서의 Kinetics를 보여준다. 423 K에서부터 수소흡수거동이 3,600 sec 이내에 최대저장량에 도달하게 되었는데, 이는 선행논문에서 보고와 일치하게 MA에 기인한 현상으로 보여 지며, 623 K에서도 열화 되지 않는 Kinetics 거동을 보여준다.
4. 결 론
본 연구에서는 Mg 수소화물인 Mg2NiHx에 10 wt%의 CaF2를 첨가한 Mg2NiHx-10wt% CaF2 복합체를 MA법을 이용하여 제조하였으며 제조된 샘플을 수소화 흡수 평가를 진행하였다. 기존의 Mg-Ni계 시편의 경우 대부분이 용융 및 응고과정을 거쳐 합금화가 진행된 반면 기계적 합급화법으로 제조하면 합금화가 손쉽게 이루어지고 미세구조 제어에도 용이하였다. Mg2NiHx-10wt% CaF2 시료를 수소 저장합금의 제조 및 수소화 흡수평가 한 결과 Mg2NiHx-10wt% CaF2는 불화물에서 해리된 F이온이 생성하는 MgF2상의 peak는 보이지 않았으며, Mg2NiHx에 비해 수소화 반응성 및 저장 측면에서 아쉬움을 보였다. 따라서 상용화 재료로 사용하기 위해서는 전이금속촉매 등을 이용한 추가 개선 연구를 진행해야 한다.
Acknowledgments
본 연구는 한국연구재단 기초연구지원사업 개인연구(2019R1F1A104140512), 중소벤처기업부의 기술개발사업 연구(S2928638)와 교육부에서 자금을 조달 받은 한국기초 과학 연구소(2019R1A6C1010047)의 지원을 받아 연구되었으며, 이에 감사드립니다.
References
-
X. Xie, C. Ni, B. Wang, Y. Zhang, X. Zhao, L. Liu, B. Wang, and W. Du, “Recent advances in hydrogen generation process via hydrolysis of Mg-based materials: a short review”, Journal of Alloys and Compounds, Vol. 816, 2020, pp. 152634.
[https://doi.org/10.1016/j.jallcom.2019.152634]

-
M. Gajdics, T. Spassov, V. K. Kis, E. Schafler, and Á. Révész, “Microstructural and morphological investigations on Mg-Nb2O5-CNT nanocomposites processed by high-pressure torsion for hydrogen storage applications”, Int. J. Hydrogen Energy, Vol. 45, No. 14, 2020, pp. 7917-7928.
[https://doi.org/10.1016/j.ijhydene.2019.06.165]

- F. A. Lewis and A. Aladjem, “Hydrogen metal systems I”, Scitec Publications, Switzerland, 1996.
-
R. Kirchheim, T. Mutschele, W. Kieninger, H. Gleiter, R. Birringer and T. D. Koble, “Hydrogen in amorphous and nanocrystalline metals”, Mater. Sci. Eng., Vol. 99, 1988, pp. 457-462.
[https://doi.org/10.1016/0025-5416(88)90377-1]

-
A. K. Singh, A. K. Singh and O. N. Srivastava, “On the synthesis of the Mg2Ni alloy by mechanical alloying.”, J. Alloy. Comp., Vol. 227, No. 63, 1995, pp. 63-68.
[https://doi.org/10.1016/0925-8388(95)01625-2]

-
L. Zaluski, A. Zaluska, and J. O. Ström-Olsen, “Nanocrystalline metal hydrides”, J. Alloy. Comp., Vol. 253-254, 1997, pp. 70-79.
[https://doi.org/10.1016/S0925-8388(96)02985-4]

-
C. Iwakura, S. Nohara, S. G. Zhang, and H. Inoue, “Hydriding and dehydriding characteristics of an amorphous Mg2Ni–Ni composite”, J. Alloy. Comp., Vol. 285, No. 1-2, 1999, pp. 246-249.
[https://doi.org/10.1016/S0925-8388(98)00966-9]

-
J. J. Reilly Jr. and R. H. Wiswall Jr., “Reaction of hydrogen with alloys of magnesium and nickel and the formation of Mg2NiH4”, Inorg. Chem., Vol. 7, No. 11, 1968, pp. 2254–2256.
[https://doi.org/10.1021/ic50069a016]

-
A. V. Rozhkov, G. Giavaras, Y. P. Bliokh, V. Freilikher, and F. Nori, “Electronic properties of mesoscopic graphene structures: charge confinement and control of spin and charge transport”, Physics Reports, Vol. 503, 2011, pp. 77-114.
[https://doi.org/10.1016/j.physrep.2011.02.002]

-
L. Liao and X. Duan, “Graphene–dielectric integration for graphene transistors”, Materials Science and Engineering, Vol. 70, No. 3-6, 2010, pp. 354-370.
[https://doi.org/10.1016/j.mser.2010.07.003]

-
P. A. Denis, R. Faccio, and F. Iribarne, “How is the stacking interaction of bilayer graphene affected by the presence of defects?”, Computational and Theoretical Chemistry, Vol. 995, 2012, pp. 1-7.
[https://doi.org/10.1016/j.comptc.2012.06.014]

- H. S. Ha, J. K. Lee, S. K. Kim, S. B. Jung, Y. J. Kim, and H. H. Jo, “Effects of CaO and Ca additions on Microstructure and Ignition Resistance of Pure Mg”, Journal of Korea Foundry Society, Vol. 26, No. 3, 2006, pp. 146-151.
-
L. M. Das, “Hydrogen engines: a view of the past and a look into the future”, Int. J. Hydrogen Energy, Vol. 15, No. 6, 1990, pp. 425-443.
[https://doi.org/10.1016/0360-3199(90)90200-I]

- K. W. Cho, J. H. Park, K. I. Kim, S. H. Kim, M. W. Jung, S. H. Kim, J. H. Choi, and T. H. Hong, “Hydrogenation Properties of Mg2Ni-(5, 10mass)NbHx Composites by Reactive Mechanical Alloying”, Trans. of the Korean Hydrogen and New Energy Society, Vol. 20, No. 6, 2009, pp. 512-518.
-
S. K. Sahoo, S. Parveen, and J. J. Panda, “The present and future of nanotechnology in human health care”, Nanomedicine: Nanotechnology, Biology and Medicine, Vol. 3, No. 1, 2007, pp. 20-31.
[https://doi.org/10.1016/j.nano.2006.11.008]

-
W. H. Suh, K. S. Suslick, G. D. Stucky, and Y. H. Suh, “Nanotechnology, nanotoxicology, and neuroscience”, PProgress in Neurobiology, Vol. 87, No. 3, 2009, pp. 133-170.
[https://doi.org/10.1016/j.pneurobio.2008.09.009]