전기분해공정을 이용한 유기물저감 및 수소 생산을 위한 최적 조건에 관한 연구
2020 The Korean Hydrogen and New Energy Society. All rights reserved.
Abstract
In this study, optimization research was conducted through statistical analysis with the aim of maximizing the efficiency of organic matter reduction and hydrogen production by applying electrolysis process at sewage treatment plant. Statistical analysis and optimal operating conditions of organic matter removal efficiency and H2 generation, which varied with various conditions in the electrolysis process, were derived using response surface methodology. As a result, 1,268 μS/cm of conductivity, 350 A current, and pH 3.2 was found to be the optimum condition to reach the desired value as 38% of organic matter reduction and 2.58 L/min of H2 production. The experiment also determined that the optimization study was reliable. Base on this study, it was confirmed that the removal of organic matter and hydrogen production could be stably by applying the electrolysis process in the sewage treatment plant.
Keywords:
Sewage treatment plant, Electrolysis, Hydrogen, Chemical oxygen demand, Response surface methodology키워드:
하수처리장, 전기분해, 수소, 생물화학적 산소요구량, 반응표면분석법1. 서 론
최근 산업발전으로 인한 환경오염이 증가됨에 따라 사회적 관심이 높아지고 있으며 새로운 에너지 확보에 대한 중요성이 부각되고 있다1,2). 급속도로 발전하는 공업화로 인하여 수계로 배출되는 다양한 종류의 폐수가 늘어남에 따라 생물학적 처리공정으로 처리가 어려운 다양한 난분해성 물질이 하수처리장으로 유입되고 있는 실정이다3,4). 이러한 폐수에는 강한 독성을 포함한 난분해성 물질이 다량 함유되어 있어 기존 수처리 기술로의 처리 한계에 대한 문제가 대두 되고 있는 실정이다5). 수처리 분야에서 난분해성 물질을 처리하기 위한 고도처리방법은 고도산화처리(advanced oxidation process), Fenton 산화, 전기화학적 방법, 촉매습식산화 등 있으며 이러한 고도산화처리방법은 일반적으로 다량의 에너지 소비가 요구된다6). 이 중 전기화학적인 방법은 전극에 일정 에너지 이상의 전기에너지를 가하여 산화·환원 반응을 통해 오염물을 제거 하는 방법으로 전기분해(electrolysis), 전기응집(electro-coagulation), 전기부상(electro-flotation) 등이 있으며, 오염물 제거와 동시에 부생가스인 수소가 발생되어 에너지 생산이 가능한 기술이다7,8).
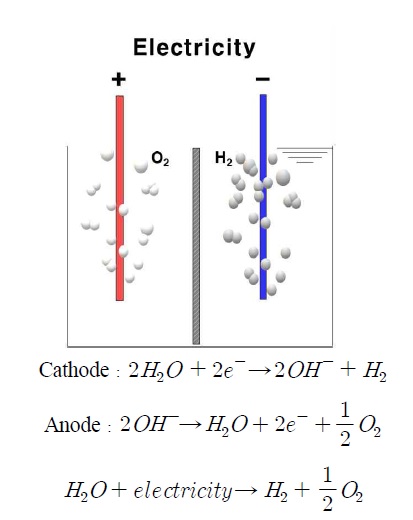
전기분해(electrolysis)는 양극에서 직접 오염물을 산화시켜 제거하는 직접산화법과 중간생성물에 의해 오염물을 제거하는 간접산화법이 있다. 직접양극산화(direct anodic oxidation)에서 오염물은 양극판에 근접하고 양성전자교환에 의해 파괴되며, 간접산화는 전기분해 시 전기·화학적으로 생성된 하이포아염소산과 같은 강한 산화물이 오염물을 파괴시킨다. 한편 cathode에서는 물이 환원반응을 통해 수소가 생성되면서 전기분해를 통해 난분해성 물질 분해(anode)와 부생가스로 수소 생산(cathode)이 동시에 이루어진다(Fig. 1)1).
이러한 전기화학적 특성을 이용한다면 유기물산화를 통한 유기물 저감과 동시에 물이 분해되어 발생되는 부생가스를 활용하여 에너지원으로 활용이 가능하다.
현재까지 진행되고 있는 전기분해공정 연구에 따르면 대부분 반응속도 주요영향 인자 도출 및 전극의 내구성에 대한 연구에 국한되어 있는 것으로 알려져 있으나, 전기화학반응은 유입되는 하수의 성상 및 전기분해장치의 운전 조건 변화에 따라 유기물 저감 및 수소 생산에 영향을 미치기 때문에 공정변수에 대한 최적화 연구가 필요하다9-11).
이에 본 연구에서는 하수처리장에서 전기분해공정을 적용 시 유기물저감 및 부생수소 생산 효율을 최대화시키는 데 목적을 두고 전기전도도, 전류, pH와 유기물저감 및 수소 생산의 상호영향을 관찰하였다.
또한, 전기분해공정 운영에 대한 최적화 설계 시 각 인자에 대한 불합리한 요소를 제거하고, 각 인자들의 영향을 정량적으로 규명하기 위하여 반응표면분석법을 이용한 공정 변수 최적화 연구를 수행하였다.
2. 실 험
2.1 실험장치 구성
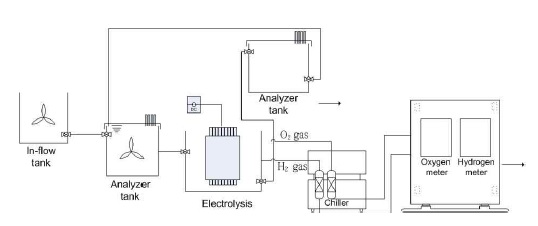
본 연구를 위해 설계된 pilot scale 규모의 전기분해공정을 Fig. 2에 도시하였고 구체적인 공정구성은 Table 1에 나타내었다. 전기분해장치는 30 L이며 전기분해장치로 유입되기 전 inflow tank에서 chemical oxygen demand (COD), pH 등 수질을 계측하였다. 전기분해장치 가동 시 발생되는 가스는 분리막에서 수소와 산소가 나누어지고 가스 내 수분은 칠러에서 제거시킨 후 유량계 및 순도계로 가스의 성상을 측정하였다. 전기분해장치에서 반응이 끝난 유출수는 후단에서 수질을 계측하여 유기물 저감량 등 수질변화를 관찰하였다.
2.2 실험 및 분석 방법
본 실험에서 사용되는 모사용액을 제조하기 위하여 증류수에 Potassium hydrogen phthalate (HOOCC6H4COOK, SAMCHUN Co., Seoul, Korea, 99.5%), Sodium sulfate (Na2SO4, SAMCHUN Co., 98.5%), Sodium hydroxide (NaOH, SAMCHUN Co., 98%) 또는 Sulfuric acid (H2SO4, SAMCHUN Co., 95%)를 용해하여 유입수로 사용하였다. 전기분해시 순수한 증류수는 전도성이 없기 때문에 유입수의 전기전도도를 높여주기 위하여 Na2SO4를 사용하였다. 또한 실제 폐수방류수를 유입수로 사용할 경우 pH의 변화폭이 크고 H+이온이 높을수록 반응속도가 빨라지기 때문에 pH 3-10으로 설정하여 실험을 진행하였다(Table 2).
유기물 저감량을 측정하기 위하여 수질공정시험법에 따라 CODcr을 분석하였으며, 수소 발생량은 유량계 및 순도계를 이용하여 측정·계산하였다.
2.3 반응표면 분석 방법
다양한 변수(X)들이 복합적인 작용을 통해 반응변수(Y)에 영향을 주고 있을 때 반응의 변화에 따른 예측값을 확인하고자 response surface methodology (RSM)를 이용하였다12). 중심합성법(central composite design)을 적용하였으며 통계적 실험설계 소프트웨어는 minitab release 14.20을 적용하였다. 매개 변수 최적화에 사용된 RSM의 설계 절차는 Box-Behnken Design (BBD)에 의해 진행되었으며 2차 다항식은 반응 표면을 설명하는 경험적 모델로 사용하였다(식 1).
| (1) |
본 연구에서 Y는 응답, β0, βi, βii와 βij는 각각 절편, 선형 제곱 및 상호작용효과의 계수이다. 설계에 사용된 factor는 3가지이며 독립변수로는 전기전도도(X1), 전류(X2). pH (X3)와 종속변수로는 유기물 제거효율(Y1), 수소 발생량(Y2)로 각각 설정하였다. 총 15개의 실험이 무작위 순서로 설계되었고 코드화는 Table 3에 표시하였다.
설계모델의 유효성은 analysis of variance (ANOVA) 분산분석을 사용하여 분석하였다. 유효성 있는 모델은 F-value (Fischer variation ratio), P-value (significant probability value)를 참조하였다. P-value는 0.05% 미만이어야 하고 적합성이 부족하지 않아야 한다. 본 연구에서는 BBD를 통한 실험설계를 기반으로 최적반응조건을 도출하고 독립변수에 따른 종속변수의 변화값을 분석하였다.
3. 결과 및 고찰
3.1 중심합성법에 의한 반응표면 분석
전기분해공정에서 다양한 조건에 따라 변화하는 유기물 제거효율, 수소 발생량에 대해 RSM을 이용하여 시뮬레이션하고 통계검증 및 최적 운영조건을 도출하였다. 세 가지 독립변수와 종속반응(Y1: 유기물 제거효율, Y2: 수소 발생량)의 설계모델의 최종 2차 방정식은 다음과 같다(식 2, 3).
| (2) |
| (3) |
모델로부터 얻은 예측값(Y1, Y2)은 Table 4에 나타내었다.
분산분석 결과 유기물 제거효율에 대한 결정계수(R2)는 99.2%, 수소 발생량에 대한 결정계수(R2)는 86.3%로 분석되었다. 결정계수(R2)은 실험값과 예측값 사이의 상관관계가 1에 가까울수록 결과값의 신뢰성이 우수함을 의미한다. 독립변수와 수소 발생량은 86.3%로 강한 상관관계의 유의성으로 확인되었으며 유기물 제거효율에 대한 결정계수는 99% 이상의 값으로 회귀방정식은 충분한 설명력이 있음을 확인하였다. 이 모델의 ANOVA 분석 결과는 Tables 5, 6에 제시되었다. 유기물 제거효율의 경우 P값이 0.000 (linear), 0.007 (square), 0.001 (interaction effects)로 매우 높은 유의성이 나타났으며 수소 발생량의 P값은 0.037 (linear), 0.085 (square), 0.925 (interaction effects)로 유의성이 있음을 확인하였다. 또한 주요 효과인자는 유기물 제거효율의 경우 전기전도도, 전류, pH 순으로 나타났지만 인자 간 영향력을 비교하였을 때 큰 차이가 없었으며 수소 발생량의 경우 전류, pH, 전기전도도 순서로 나타났다.
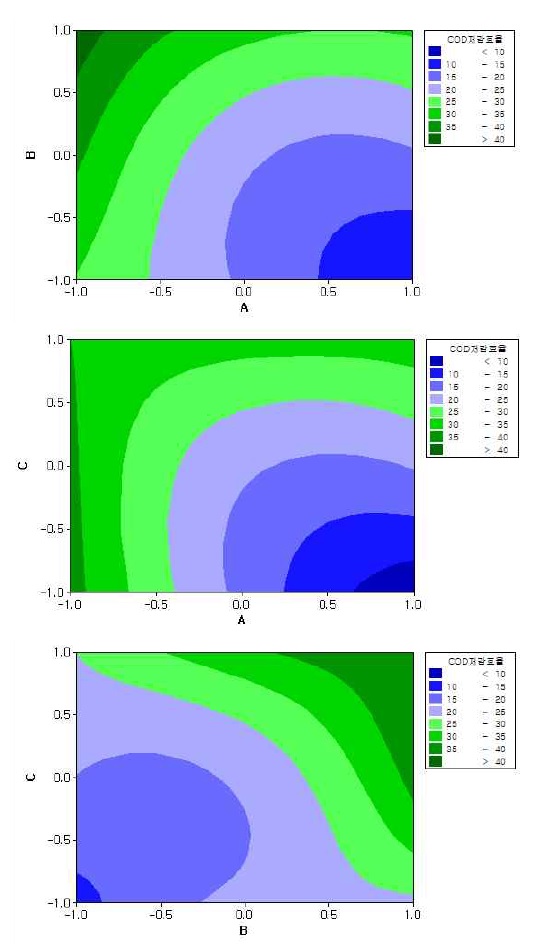
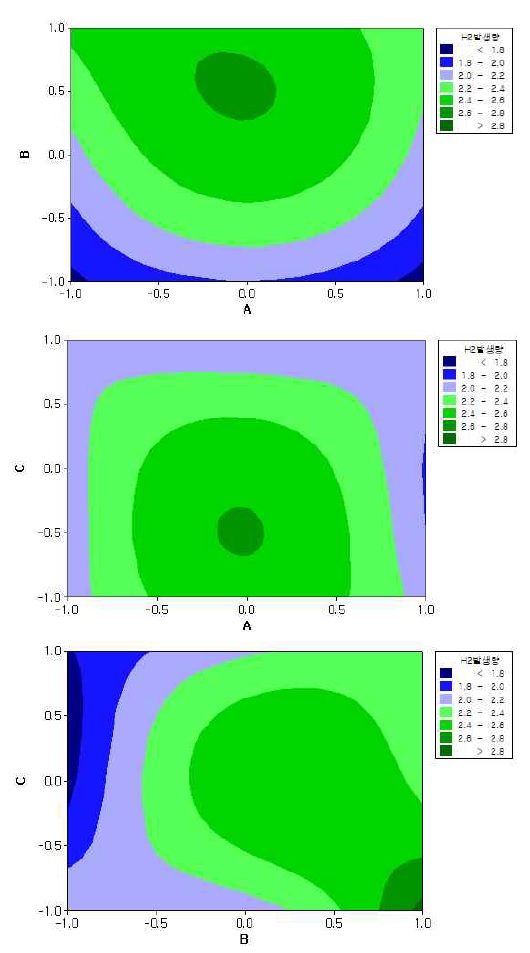
3.2 등고분석(contour plot)을 통한 최적화 연구
최적반응 조건을 도출하기 위해 반응표면설계를 이용하여 2D-반응표면도를 작성하였다. Figs. 3, 4는 반응표면 설계의 결과를 2D로 나타낸 등고선도이다. 각 등고선은 인자의 조합에 대한 반응 곡선을 나타내는 것으로 등고선의 모든 지점에서의 반응치 값은 동일하다13). Figs. 3, 4는 유기물 제거효율 및 수소 발생량에 대하여 전기전도도와 전류, 전기전도도와 pH, 전류와 pH 간의 반응 등고선도를 나타내고 있다. 각 반응 변수들의 hold value를 선정하여 각 요인별 반응영역을 바탕으로 여러 개의 반응변수의 목표값을 동시에 만족하는 최적 조건을 도출하였다. 최적 조건 탐색은 특정변수에 대해 목표값을 만족하는 조건을 탐색할 수 있는데, 본 연구에서는 유기물 제거효율(COD 저감율) 40%와 수소 발생량 2.6 L/min을 목표값으로 설정하였다. 전기전도도 1,268 μS/cm, 전류 350 A, pH 3.2 조건에서 유기물 제거효율(COD 저감율) 38%, 수소 발생량 2.58 L/min으로 약 89%의 만족도를 높이는 조건임을 확인하였다.
3.3 실험을 통한 신뢰성 평가
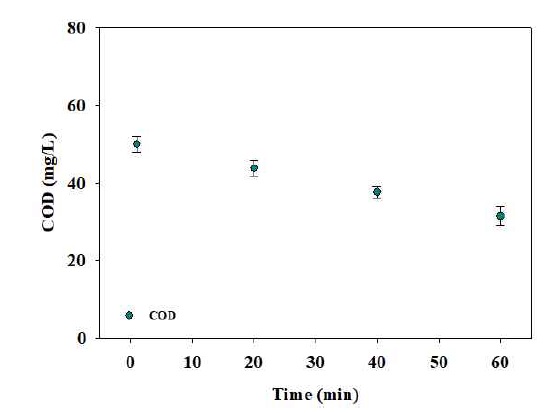
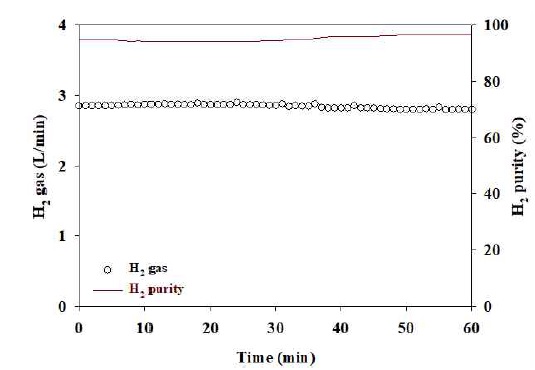
앞서 3.1, 3.2절을 통해 도출된 최적반응조건을 초기 운전값으로 설정하여 실험을 수행하였고, 통계에 대한 신뢰성을 평가하였다. 전기전도도 1,268 μS/cm, 전류 350 A, pH 3.2 조건에서 유기물 제거효율(COD저감율)을 관찰하기 위하여 매 20분마다 수질 측정하였으며, 수소 발생량은 매분마다 순도와 유량을 측정하여 발생되는 수소량을 계산하였다. 실험 결과, COD 저감효율은 60분 전기분해 후 약 32-36% 처리효율이 나타났으며, 수소의 경우 순도 94-96%, 유량 2.8-2.9 L/min로 약 2.7 L/min의 수소가 발생되는 것으로 나타났다(Figs. 5, 6). 이를 통해 통계분석을 통한 최적화 연구가 신뢰성이 있다고 판단된다.
4. 결 론
하수처리장 내 고도처리를 위하여 전기분해 공정 도입 시 공정변수에 따른 유기물 제거효율 및 수소 발생량을 평가하여 다음과 같은 결론을 얻을 수 있었다.
1) 본 연구는 하수처리장에서 전기분해공정을 적용 시 유기물 제거 및 부생수소 생산 효율을 최대화시키는 데 목적을 두고 반응표면법 및 등고분석을 통해 최적화를 구현하는 데 목적으로 하였다.
2) 반응표면법을 이용한 통계학적 분석에 의해 도출된 유기물 제거효율 모델식은 Y1=21.1333-8.10250X1+7.2950X2+6.4550X3+4.6833X12+2.3933X22+1.8483X32+1.9650X1X2+7.0650X1X3+0.9750X2X3이며, 수소 발생량 모델식은 Y2=2.54333-0.03125X1+0.29000X2-0.11375X3-0.32792X12-0.18042X22-0.08792X32-0.04500X1X2-0.01250X1X3-0.05000X2X3이며, 결정계수는 각각 99.2%, 86.3%로 분석되었다.
3) 유기물 제거효율(COD 저감율) 40% 저감과 수소 발생량 2.6 L/min을 목표값으로 설정하여 최적조건을 탐색한 결과 전기전도도 1,268 μS/cm, 전류 350 A, pH 3.2 조건에서 유기물 제거효율 38%, 수소 발생량 2.6 L/min으로 약 89%의 만족도를 높이는 조건임을 확인하였다.
4) 본 연구를 토대로 하수처리장 내 전기분해공정을 도입 시 안정적으로 유기물제거 및 수소 생산이 가능함을 확인할 수 있었으며, 추가적인 연구로 전기분해장치의 분리막 내구성을 확보 시 고순도 수소 생산을 통해 경제성 확보에 기여할 수 있을 것으로 예상된다.
Acknowledgments
본 연구는 2020년 경기대학교 대학원 연구원장학생 장학금 지원에 의하여 수행되었습니다(This work was supported by Kyonggi University's Graduate Research Assistantship 2020).
References
- J. Y. Lee, Y. M. Yi, and S. H. Uhm, “Understanding underlying processes of water electrolysis”, J. Korean Ind. Eng. Chem., Vol. 19, No. 4, 2008, pp. 357-365. Retrieved from https://www.koreascience.or.kr/article/JAKO200830335054206.page, .
- Y. J. Choi and K. Lee, “Advanced treatment of sewage and wastewater using an integrated membrane separation by porous electrode-typed electrolysis”, Journal of The Membrane Society of Korea, Vol. 22, No. 2, 2012, pp. 95-103. Retrieved from https://www.koreascience.or.kr/article/JAKO201216735814473.page, .
-
S. H. Jang, G. E. Kim, J. M. Bae, S. C. Hong, J. M. Suh, J. Y. Lee, J. S. Park, and C. Y. Moon, “Characteristics of total nitrogen removal in wasted soluble cutting fluids (SCF) by electrolysis/electro coagulation”, Journal of Korea Society of Waste Management, Vol. 34, No. 7, 2017, pp. 678-684.
[https://doi.org/10.9786/kswm.2017.34.7.678]

- S. W. Park and B. Y. Yoon, “The study of electrolysis of methylene blue using DSA electrode”, Journal of Nakdonggang Envionmental Research Institute, Vol. 12, No. 1, 2007, pp. 85-91. Retrieved from http://www.dbpia.co.kr/journal/articleDetail?nodeId=NODE01430500, .
- C. H. Shin, “Effect of indirect oxidation on the design of sewage/wastewater reuse system with an electrolysis reactor”, Journal of The Korean Society of Clean Technology, Vol. 15, No. 2, 2009, pp. 116-121. Retrieved from https://www.koreascience.or.kr/article/JAKO200926158875823.page, .
-
D. S. Kim and Y. S. Park, “Electrochemical degradation of phenol using dimensionally stable anode”, Journal of Environmental Science International, Vol. 22, No. 5, 2013, pp. 999-1007.
[https://doi.org/10.5322/JESI.2013.22.8.999]

- S. W. Park, S. K. Kim, and K. W. Lee, “A study on industrial wastewater treatment using the electrolysis”, Journal of Nakdong River Environmental Research Institute, Vol. 3, No. 1, 1998, pp. 131-142. Retrieved from http://www.dbpia.co.kr/journal/articleDetail?nodeId=NODE01428402, .
- D. W. Chung, H. S. Cho, D. W. Pak, J. B. Ju, and T. W. Son, “Treatment of nitrogen and organic compounds in wastewater using electrochemical method”, Journal of the Korean Institute of Chemical Engineers, Vol. 39, No. 5, 2001, pp. 661-665. Retrieved from https://www.cheric.org/research/tech/periodicals/view.php?seq=317560, .
- S. K. Kim, S. W. Park, and D. I. Hong, “A study on dye wastewater treatment using the electrolysis”, Journal of the korean Environmental Sciences Society, Vol. 8, 1999, pp. 539-545. Retrieved from https://www.koreascience.or.kr/article/JAKO199911920676594.pdf, .
- S. H. Son, H. K. Lee, D. C. Kwon, and D. W. Jung, “Developement of novel metal oxide catalyst electrode for wastewater treatment”, Journal of Korean Society Of Environmental Engineers, 2006, pp. 1257-1263. Retrieved from http://www.dbpia.co.kr/journal/articleDetail?nodeId=NODE06758035, .
- J. J. Yu, K. S. Min, and J. M. Park, “Treatment characteristics of refractory compounds in dyeing wasterwater by electrocatalytic electrode”, Journal of Korean Society of Environmental Engineers, Vol. 25, No. 10, 2003, pp. 1277-1282. Retrieved from http://www.dbpia.co.kr/journal/articleDetail?nodeId=NODE06751203, .
-
J. Y. Ahn, S. W. Chang, S. M. Lee, S. S. Kim, W. J. Chung, J. C. Lee, Y. J. Cho, K. S. Shin, D. H. Moon, and D. D. Nguyen, “Developing Ni-based honeycomb-type catalysts using different binary oxide-supported species for synergistically enhanced CO2 methanation activity”, Fuel, Vol. 250, 2019, pp. 277-284.
[https://doi.org/10.1016/j.fuel.2019.03.123]

-
J. Y. Kim, K. Y. Kim, and J. S. Lee, “Optimal layout design of offshore wind turbines by response surface analysis”, Journal of Korean of Coastal and Ocean Engineers, Vol. 23, No. 2, 2011, pp. 163-170.
[https://doi.org/10.9765/KSCOE.2011.23.2.163]